IL-1β通过加重脂质诱导的内质网应激导致人系膜细胞损伤*
施 静, 崔晶晶, 阳海平△, 刘 玮, 万俊丽, 王志铁, 邱桂霞, 李 秋△
(重庆医科大学附属儿童医院 1肾脏免疫科,2儿科研究所免疫室,重庆400014)
高脂血症是儿童原发性肾病综合征(primary ne- phrotic syndrome,PNS)重要的病理生理改变之一,脂质代谢紊乱或持续的高脂血症是肾脏损害的独立危险因素[1],可致肾小球硬化。本课题组前期研究结果证实炎症可加重脂质介导肾脏损害,在肾小球硬化过程中起重要作用[2]。内质网是细胞加工蛋白质和贮存Ca2+的主要场所,对各种理化因素如葡萄糖及氨基酸缺乏、缺血/缺氧、衣霉素等极为敏感,可引起内质网蛋白质加工、运输障碍及摄取、释放Ca2+障碍而致内质网应激(endoplasmic reticulum stress,ERS)。持续或过强的ERS可致细胞凋亡[3]及炎症反应[4]。研究表明高糖、高半胱氨酸等可诱导人肾小球系膜细胞(human mesangial cells,HMCs)发生ERS,从而促进其增殖、系膜外基质产生增多;但目前高脂是否可通过启动ERS致HMCs损害尚不清楚。本研究旨在探讨炎症能否加重高脂负荷下HMCs ERS及其具体的分子机制,为临床防治肾脏损害提供新的分子靶点。
材料和方法
1 主要试剂
RPMI-1640培养基购于 Gibco,优等胎牛血清(fetal bovine serum,FBS)购于天津TBD,白细胞介素1β(interleukin-1 beta,IL-1β)、兔抗人核转录因子 κB(nuclear factor-kappa B,NF-κB)购于SAB,人低密度脂蛋白(low-density lipoprotein,LDL)本实验室自备,4-苯基丁酸(4-phenyl butyric acid,4-PBA)及油红O(oil red O)购于Sigma,ELISA试剂盒购于Ray Biotech。
2 方法
2.1 细胞来源 HMCs由英国伦敦大学学院皇家自由医学院(University College London Medical School,Royal Free Campus)阮雄中教授惠赠。
2.2 细胞培养 使用含有10%FBS的RPMI-1640培养基,在37℃、5%CO2培养箱静置培养 HMCs。24 h换液1次,48 h可传代。
2.3 实验分组 待HMCs生长至对数生长期后,将细胞分为4组:(1)对照组:RPMI-1640+10%FBS;(2)高脂组(LDL):RPMI-1640+10%FBS+200 mg/L LDL;(3)IL-1β+高脂组(IL-1β+LDL):RPMI-1640+10%FBS+20μg/L IL-1β+200 mg/L LDL;(4)4-PBA干预组(4-PBA+IL-1β+LDL):RPMI-1640+10%FBS+5 mmol/L 4-PBA+20 μg/L IL-1β +200 mg/L LDL。继续培养48 h后进行各项实验分析。
2.4 油红O染色观察HMCs胞内脂质沉积情况HMCs以2×104cells/well的密度接种于24孔板内,实验干预后弃培养基,PBS洗涤3次。4%多聚甲醛固定30 min,ddH2O冲洗 2次,1,2-丙二醇孵育 2 min。室温下油红O工作液染色30 min,ddH2O洗3次,苏木素复染1~2 min,自来水冲洗5 min,风干,中性树胶封片。
2.5 免疫细胞化学方法检测葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)的表达 HMCs以2×104cells/well的密度接种于24孔板内,实验干预后弃上清,PBS洗3次,4%多聚甲醛固定,1%Triton X-100,3%H2O2灭活,抗原修复,血清封闭,GRP78Ⅰ抗4℃孵育过夜,Ⅱ抗孵育。二氨基联苯胺(diaminobenzidine,DAB)显色,苏木素复染,风干,中性树胶封片。
2.6 实时定量 PCR(real-time PCR)检测GRP78、蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)和 α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)mRNA 水平将处于对数生长期的HMCs按5×105cells/well的密度接种于6孔板内,每组设3复孔。经实验干预后收集细胞,按说明书提取细胞总RNA,RNA的A260/A280比值均为1.7~2.2。各组取等量RNA为模版逆转录合成cDNA。取1μL cDNA进行实时定量PCR,以β-肌动蛋白(β-actin)为内参照。扩增条件:95℃ 3 min,之后95℃ 10 s,61.4℃ 30 s,共40个循环。完成后用Gene Expression Analysis for iCycler iQ Real-Time PCR Detection System 1.10软件(Bio-Rad)计算各样本目的基因的相对表达量。PCR引物由Invitrogen合成,序列见表1。

表1 实时定量PCR引物序列Table 1.Primer sequences for real-time PCR
2.7 Western blotting检测胞核 NF-κB p65 蛋白的表达 将细胞接种于T25培养瓶中,经实验干预后收集细胞。按试剂盒说明书提取胞浆和胞核蛋白,BCA法进行蛋白定量并标化,每孔胞核蛋白上样量为40μg,β-actin作为内参照。样品加变性缓冲液煮沸5~10 min。SDS-PAGE垂直凝胶电泳,转膜,5%脱脂奶粉室温封闭1 h,TBST洗膜10 min×3次,加入Ⅰ抗 NF-κB(1∶2 000)和 β-actin(1∶1 000)进行杂交,4℃孵育过夜;TBST洗膜10 min×3次,Ⅱ抗(1∶5 000)杂交,室温孵育1 h,TBST漂洗10 min×3次。ECL光化学法进行显影。
2.8 ELISA法检测培养上清白细胞介素6(interleukin-6,IL-6)和转化生长因子β1(transforming growth factor β1,TGF-β1)的含量 操作按试剂盒说明书进行,以吸光度(absorbance,A)值表示上清中待测蛋白含量。
3 统计学处理
数据以均数±标准差(mean±SD)表示,组间差异采用单因素方差分析,采用SPSS 18.0软件进行数据处理,以P<0.05为差异有统计学意义。
结 果
1 油红O染色检测HMCs脂质沉积
油红O染色及半定量分析结果显示,正常组HMCs中仅可见少量红染颗粒,LDL组及 IL-1β+LDL组与其相比,红染颗粒明显增多(P<0.05),其中IL-1β+LDL组脂质沉积较LDL组显著增加(P<0.05);经4-PBA干预后HMCs胞内脂质沉积较IL-1β+LDL组显著减少(P<0.05),见图1。

Figure 1.Lipid accumulation in HMCs of different groups(oil red O staining,×400).A:control group;B:LDL(200 mg/L)group;C:IL-1β (20 μg/L)+LDL(200 mg/L)group;D:4-PBA(5 mmol/L)+IL-1β (20μg/L)+LDL(200 mg/L)group.Mean±SD.n=3.*P <0.05 vs A;#P <0.05 vs C.图1 各组HMCs油红O染色结果
2 不同干预对HMCs ERS信号通路GRP78-PERK轴的影响
如图2、3所示,正常组GRP78 mRNA及蛋白、PERK mRNA表达均处于较低的水平,予以LDL及IL-1β+LDL刺激后,可显著增加其表达(均 P<0.05),其中 IL-1β+LDL组GRP78 mRNA及蛋白、PERK mRNA水平显著高于LDL组(均P<0.05);经4-PBA干预后,其表达较IL-1β+LDL组显著降低(均 P<0.05)。
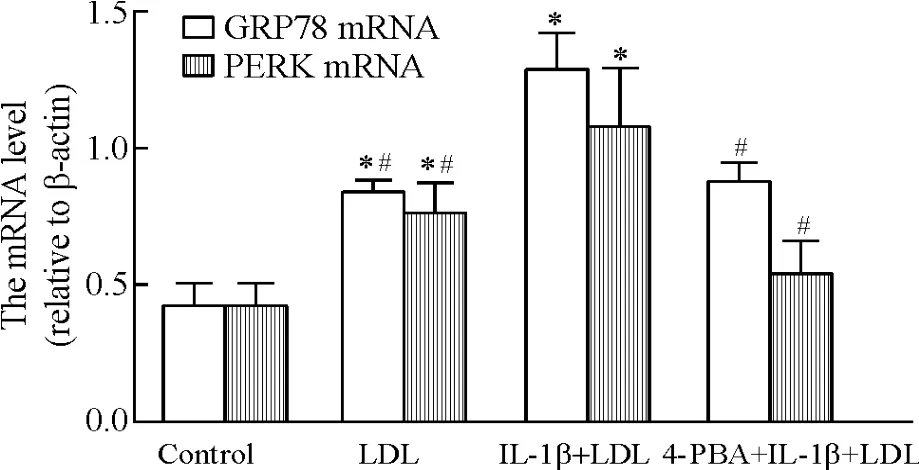
Figure 2.Expression of GRP78 and PERK mRNA in HMCs of different groups.Mean± SD.n=3.*P <0.05 vs control group;#P <0.05 vs IL-1β +LDL group.图2 各组HMCs GRP78与PERK mRNA的表达
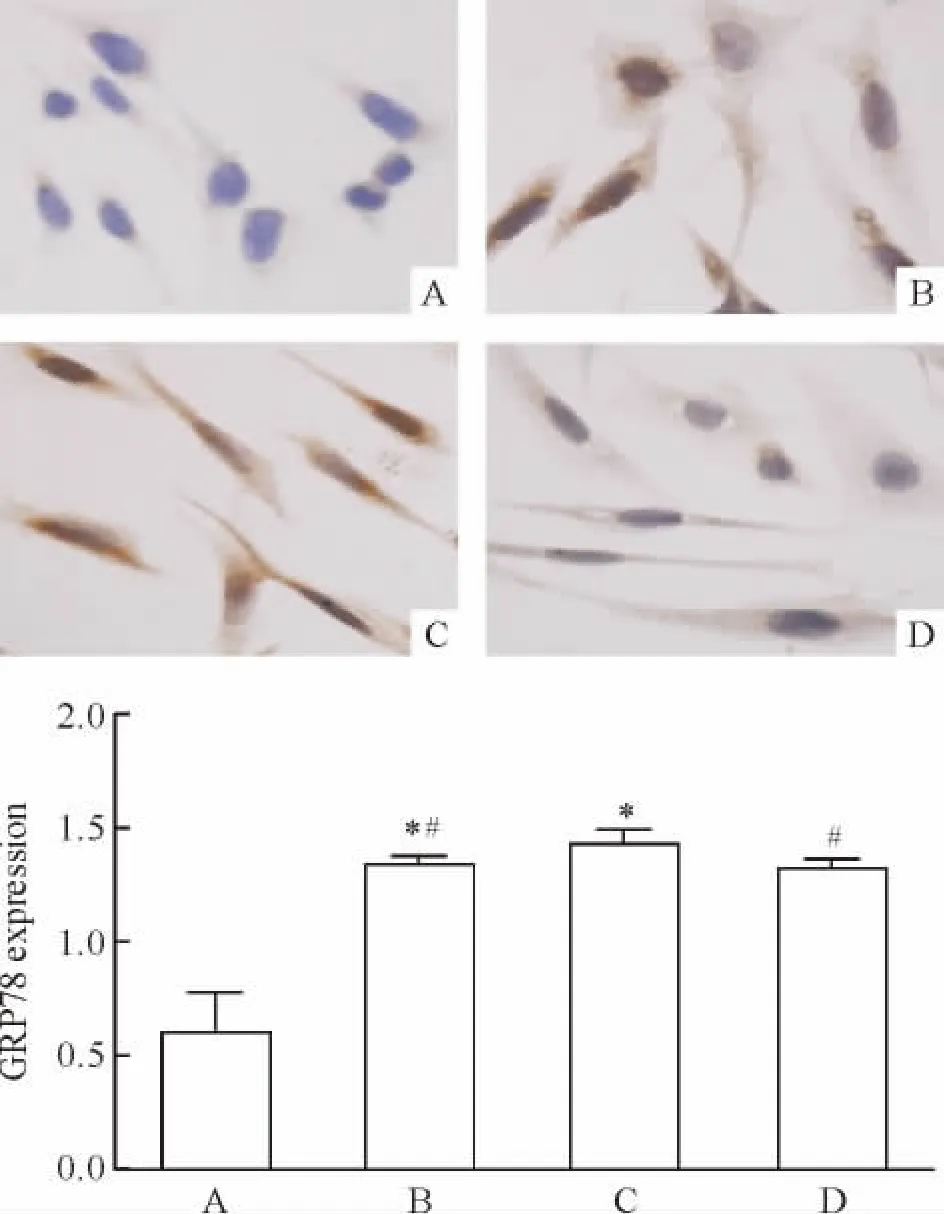
Figure 3.Immunocytochemistry results of GRP78 protein expression in HMCs of different groups(DAB staining,×400).A:control group;B:LDL(200 mg/L)group;C:IL-1β (20 μg/L)+LDL(200 mg/L)group;D:4-PBA(5 mmol/L)+IL-1β (20μg/L)+LDL(200 mg/L)group.Mean± SD.n=3.*P<0.05 vs A;#P<0.05 vs C.图3 各组HMCs GRP78蛋白的表达
3 Real-time PCR检测不同干预对HMCsα-SMA mRNA水平的影响
如图4所示,正常组存在低水平α-SMA mRNA表达,LDL刺激可增加其表达,IL-1β+LDL刺激后其表达水平显著高于正常组及LDL组(均P<0.05);4-PBA干预可显著抑制 IL-1β+LDL诱导 α-SMA mRNA表达(P<0.05)。
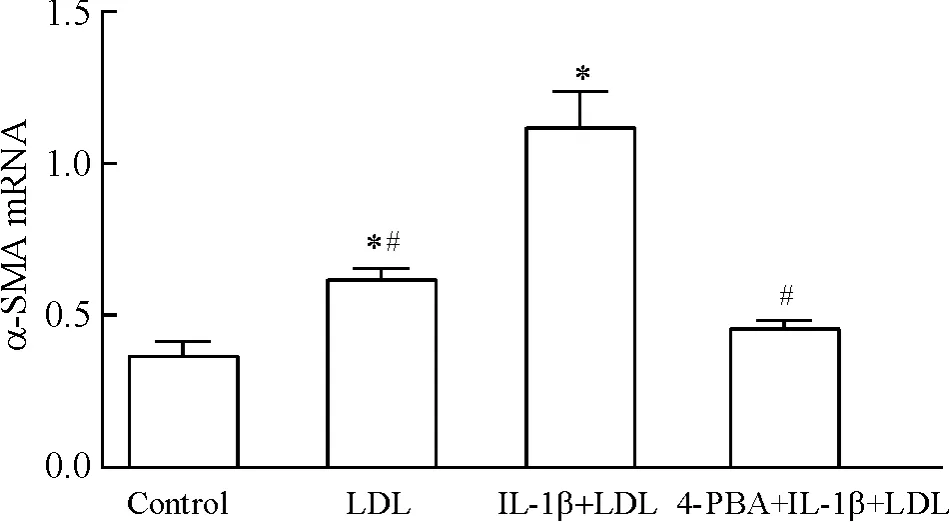
Figure 4.Expression ofα-SMA mRNA in HMCs of different groups determined by real-time PCR.Mean±SD.n=3.*P <0.05 vs control group;#P <0.05 vs IL-1β +LDL group.图4 各组HMCsα-SMA mRNA的表达
4 不同干预对HMCs核蛋白NF-κB p65及分泌IL-6、TGF-β1水平的影响
如图5及表2所示,正常组NF-κB p65蛋白表达量、IL-6分泌量处于较低水平,予以LDL及IL-1β+LDL刺激后,NF-κB p65蛋白及IL-6水平均较正常组显著上调(均P<0.05),其中 IL-1β+LDL组较LDL组明显增多(均P<0.05),予以4-PBA干预可以明显抑制 NF-κB p65及 IL-6的表达(均 P<0.05);而各组HMCs分泌TGF-β1差异无统计学意义(均P>0.05)。

Figure 5.Expression of NF-κB p65 protein in HMCs of different groups determined by Western blotting.Mean ± SD.n=3.*P<0.05 vs control group;#P <0.05 vs IL-1β+LDL group.图5 各组HMCs NF-κB p65蛋白的表达

表2 各组细胞培养上清中IL-6和TGF-β1含量的比较Table 2.The levels of IL-6 and TGF-β1 in HMCs culture supernatants detected by ELISA(ng/L.Mean±SD.n=3)
5 HMCs脂质沉积与内质网应激相关基因及炎症状态的相关性分析
HMCs胞内脂质沉积与GRP78蛋白水平、PERK mRNA、NF-κB p65和 IL-6水平呈正相关(分别为:r=0.818,P <0.01;r=0.486,P <0.05;r=0.858,P<0.01;r=0.582,P <0.05);GRP78 mRNA 与PERK mRNA、NF-κB p65 和 IL-6 水平呈正相关(分别为:r=0.660,P <0.01;r=0.784,P <0.01;r=0.825,P <0.01);NF-κB p65与 IL-6水平呈正相关(r=0.743,P<0.01);而HMCs胞内脂质沉积和NF-κB p65水平与α-SMA mRNA水平无显著相关性(分别为:r=0.021,P >0.05;r=0.137,P >0.05)。
讨 论
1982年Moorhead等[1]首次提出“脂质肾毒性”学说以来,越来越多的研究表明脂质代谢紊乱或持续高脂血症是肾损害的独立危险因素,可致慢性肾脏病或肾小球硬化。在局灶节段性肾小球硬化病人肾脏组织、高脂血症动物模型中,均能见到大量脂质在肾脏沉积或泡沫细胞形成。本课题组既往研究已证实高脂可促进HMCs分泌炎症因子,加重炎症反应,最终致肾小球硬化[5]。但高脂致肾脏损伤或肾小球硬化的机制尚不清楚。
近来研究表明内质网应激-未折叠蛋白反应(endoplasmic reticulum stress-unfolded protein response,ERS-UPR)在膜性肾病、膜增生性肾小球肾炎的发生发展中起重要作用[6-7];且 ERS-UPR是脂质代谢紊乱致动脉粥样硬化、炎症发生、凋亡的关键信号通路[8]。目前对肾脏脂质代谢紊乱与 ERS-UPR关系的研究较少。GRP78是ERS的主要分子伴侣及标志蛋白,在调控ERS-UPR信号通路活化过程中发挥重要作用。在Ruan等[9]的研究中证实,炎症因子IL-1β能明显促进HMCs脂质的吸收,促进胞内胆固醇的合成,并减少其外流[10],从而造成脂质在细胞内的异常积聚。本研究显示,HMCs予以LDL刺激,胞内脂质含量增多,GRP78、PERK表达上调;进一步给予IL-1β刺激,其胞内脂质沉积、GRP78及PERK水平较单独LDL刺激显著增多,且胞内脂质水平与ERS状态呈正相关。提示脂质在HMCs的异常沉积,可启动ERS-UPR,从而激活下游 PERK信号通路,导致细胞损伤;而炎症可加重该效应。
ERS-UPR启动后可激发内质网与高尔基体、细胞核之间的信号转导。NF-κB是一种广泛存在于真核细胞内的重要转录因子,可促进炎症反应、应激、细胞增殖与凋亡等。ERS启动下游不同的信号通路介导NF-κB的激活可能与不同刺激剂、不同细胞种类及种属相关[4],存在组织器官的特异性。如:毒胡萝卜素在人胚肾细胞中通过需肌醇酶1和肿瘤坏死因子受体相关因子2激活NF-κB[11],小鼠胚胎成纤维细胞中,磷酸化的eIF2α对激活NF-κB转录活性必不可少[12]。目前,高脂能否通过ERS-UPR信号通路活化NF-κB p65致HMCs损伤的相关研究甚少。本研究发现高脂联合炎症状态下,HMCs PERK、NF-κB p65及IL-6水平均较单纯高脂状态下显著增高;且脂质沉积与 GRP78-PERK轴、NF-κB p65及 IL-6水平呈正相关。因此,我们推测本实验中HMCs NF-κB p65水平增加可能与ERS下游GRP78-PERK信号通路活化相关,进而增加炎症因子(如IL-6)的分泌,形成恶性循环,扩大肾脏局部炎症反应。
α-SMA是HMCs表型转化的重要分子标记[13]。在高糖诱导HMCs ERS模型中,其表达显著上调[14]。在系膜增殖性肾炎中,HMCs的增殖、细胞外基质的积聚与α-SMA的表达,三者呈平行变化并具有高度相关性。我们发现在高脂诱导的HMCs ERS模型中,α-SMA mRNA水平明显上调,通过干预ERS,可使其表达下调。提示ERS在高脂介导的HMCs表型改变中发挥重要作用。
4-PBA是人工合成小分子化合物,在稳定内质网蛋白质构象、改善内质网折叠能力、运输突变蛋白等方面发挥作用,能有效缓解ERS的发生,是ERS的一种常用阻断剂。本实验经4-PBA干预后发现,4-PBA可通过降低分子伴侣GRP78及PERK的表达以达到缓解ERS发生的强度,从而降低其介导的炎症反应、抑制HMCs表型转化等细胞损害。同时在本实验中还意外的发现,4-PBA亦能显著降低HMCs胞内脂质沉积水平,但其具体分子机制尚不清楚。其是否在调控HMCs内质网膜上脂质代谢相关蛋白及转运胆固醇合成蛋白等方面发挥作用,还有待进一步的研究。这一发现有可能为干预脂质代谢紊乱介导的一系列病理生理改变提供新的治疗靶点及干预手段。
——疾病防治的新靶标

