二十二碳六烯酸对大鼠肺动脉平滑肌细胞大电导钙激活性钾通道的影响*
陈 蕊, 刘培晶, 严金川△, 顾雨春
(1江苏大学附属医院心内科,江苏镇江212001;2北京大学分子医学研究所,北京100871)
肺动脉高压是一种以肺循环阻力和肺动脉压进行性增加为特征的疾病,其发病率、致残率和病死率都很高。K+通道在调节肺血管张力、肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)静息膜电位、增殖凋亡及肺血管重构时发挥重要作用。PASMCs上主要存在5类钾离子通道,包括钙激活性钾离子通道(calcium-activated potassium channel,KCa)、电压门控型钾离子通道 (voltage-dependent potassium channel,KV)、内向整流性钾离子通道(inward rectifier potassium channel,KIR)、ATP 敏感性钾离子通道(ATP-sensitive potassium channel,KATP)和双孔钾通道(two-pore-domain potassium channel,K2P)[1]。大电导钙激活性钾通道(large-conductance calcium-activated potassium channel,BKCa)是 KCa的一种亚型,广泛分布于各类动脉平滑肌细胞上,对血管舒张起重要调节作用。
ω-3多不饱和脂肪酸(ω-3 polyunsaturated fatty acid,ω-3 PUFA)能通过减少缺氧性肺动脉高压模型中肺血管肌化、抑制肺纤维化等途径实现抗肺动脉高压的作用[2]。ω-3 PUFA主要包括二十二碳六烯酸(docosahexaenoic acid,DHA)和二十碳五烯酸(eicosapentaenoic acid,EPA)。目前研究发现,DHA对心肌细胞及冠状动脉平滑肌细胞上多类离子通道有作用,但其对PASMCs上离子通道的影响尚不明确。本研究采用膜片钳技术观察DHA对Sprague-Dawley大鼠PASMCs上BKCa的影响,探讨DHA抗肺动脉高压的离子机制。
材料和方法
1 动物和器材
清洁级Sprague-Dawley大鼠,体质量(180±30)g,雌雄不拘,由江苏大学动物中心提供。Multiclamp 700B膜片钳放大器(Axon),DigiData 1322型数/模(或模/数)转换器(Axon),pClamp 10.2 脉冲发放和数据采集软件(Axon)。C1SI激光扫描共聚焦显微镜(Nikon)。
2 试剂及溶液
DHA(Sigma)使用前以无水乙醇配制成10 mmol/L的母液,分装避光保存于-20℃备用。使用时无水乙醇的终浓度<0.4%,以防止无水乙醇对离子通道的影响。分离血管用生理盐溶液(PSS)成份(mmol/L):NaCl 130,KCl 5,MgCl21.2,CaCl21.5,HEPES 10,葡萄糖10。分离细胞用无钙PSS液,将分离血管用的PSS液中的CaCl2用等摩尔MgCl2代替。2种PSS液用NaOH调节pH至7.4。分离平滑肌细胞酶液(g/L):木瓜蛋白酶4,胶原酶Ⅰ型2,牛血清白蛋白1,二硫苏糖醇0.5,溶于无钙PSS液中。记录BKCa电流的细胞外液 (mmol/L):NaCl 145,KCl 4.0,CaCl21.0,MgCl21.0,HEPES 10,葡萄糖 10,用NaOH调pH至7.4。记录 BKCa电流的电极内液(mmol/L):KCl 125,Na2ATP 5,Na2GTP 0.5,MgCl24,HEPES10,EGTA 0.1,用 KOH 调节 pH 值至7.4。同时细胞外液加KV通道特异性抑制剂4-氨基吡啶(5 mmol/L)。急性缺氧溶液:2 mmol/L连二亚硫酸钠细胞灌流液,此时氧分压在60 min内为0 mmHg,pH 值不发生改变[3]。
3 DHA对BK Ca电流的作用
大鼠单个PASMC的分离采用传统的酶解方法[4]。取酶解获得的细胞悬液于预处理有L-多聚赖氨酸的玻片中,将玻片粘于灌流槽,待细胞充分贴壁,平放在倒置显微镜上,取状态良好的细胞进行膜片钳实验。记录电极用玻璃毛细管,经电极拉制仪拉制成微电极,阻抗为3~6 MΩ。用全细胞膜片钳记录方法,在电压钳下记录BKCa电流。记录电流时,钳制电压为-70 mV,指令电压从-60 mV至+60 mV,阶跃电压为10 mV,脉冲时间为400 ms的去极化刺激13次,频率为0.2 Hz,信号采集频率为10 kHz,滤波频率为2 kHz。采样后数据由Clampfit 10.2软件自动记录,存储于计算机硬盘内,供测量分析。所有实验均在室温(25±1)℃下进行。通道电流密度(pA/pF)为电流强度与细胞膜电容的比值,以消除不同细胞表面积的电流误差,膜电容可直接在放大器上读出。观察0、0.01、0.1、1 和10 μmol/L DHA对BKCa电流的影响。
4 急性缺氧及急性缺氧+DHA对BK Ca电流的作用
同样方法记录 BKCa电流,以含有终浓度为2 mmol/L连二亚硫酸钠的细胞灌流液灌流,观察急性缺氧对BKCa电流的影响。以含有10μmol/L DHA的急性缺氧溶液灌流,观察急性缺氧时DHA对BKCa电流的作用。
5 DHA对PASMCs胞内游离钙离子浓度([Ca2+]i)的影响
酶解法获得 PASMCs后,加入含 Fluo-8/AM(5 μmol/L)的D-Hanks液,置37℃培养箱中避光孵育20 min,弃孵育液,D-Hanks液清洗3次,将载有细胞的玻片移入激光共聚焦显微镜载物台的灌流槽,激发波长为488 nm,发射波长为530 nm。细胞内荧光强度(fluorescence intensity,FI)的变化可指示[Ca2+]i的相对变化。激光共聚焦显微镜下连续动态扫描,每视野观察3~4个细胞,每秒取一帧图像,共400 s,应用连续激光扫描曲线观察细胞内[Ca2+]i的变化。
6 统计学处理
计量资料以均数±标准差(mean±SD)表示。用SPSS 17.0统计分析软件进行统计分析,自身对照采用配对t检验或单因素方差分析,组间资料采用非配对t检验,以P<0.05为差异有统计学意义。数据处理使用OriginPro 7.5科技绘图及数据分析软件。
结 果
1 DHA对大鼠PASMCs BK Ca的影响
DHA浓度为0.01μmol/L时,BKCa的电流强度有所增加,但与对照组相比,差异无统计学意义;0.1、1和10μmol/L DHA对BKCa电流强度呈浓度依赖性增加(图 1A),I-V曲线上移(图 1B)(P<0.01),且该激活电流能被BKCa特异性抑制剂伊比利亚蝎毒素(iberiotoxin,IBTX)所抑制(图1C)。在指令电压为+60 mV时,不同浓度的 DHA(0.1、1和10μmol/L)使 BKCa电流密度分别增加(47.4±6.9)%、(323.0 ±13.1)%和(460.2 ±45.6)%。
2 急性缺氧及DHA对BK Ca的作用
急性缺氧能抑制 BKCa(图2A),I-V曲线下移(图2B)。指令电压为+60 mV时,BKCa电流密度从(32.7 ±8.5)pA/pF 降低至(11.9 ±5.8)pA/pF(P<0.01)。DHA(10μmol/L)能逆转急性缺氧对BKCa的抑制作用(P <0.01),见图3。
3 DHA 对 PASMCs[Ca2+]i的影响
未灌流DHA前,细胞荧光强度均匀;灌流DHA 50 s后,即刻发生荧光面积缩小,强度增加,在150 s达峰值,[Ca2+]i最大增加率为(71.9 ±4.1)%(P <0.01),之后逐渐降低,见图 4。

Figure 1.DHA increased whole-cell BKCa currents in rat PASMCs.A:representative tracings showed BKCa currents at different DHA concentrations(0,0.01,0.1,1 and 10 μmol/L).B:I-V relationships of BKCa currents at different DHA concentrations.Mean± SD.n=5.**P < 0.01 vs control.C:representative tracings showed that the DHA-activated K+currents were inhibited by iberiotoxin(IBTX).图1 不同浓度DHA对大鼠PASMCs BK Ca电流的影响
讨 论
肺动脉高压的发生机制复杂,目前尚未完全清楚,其病因包括肺血管床减少及低氧导致的肺血管收缩。低氧造成的PASMCs钾离子流减少,钾通道活性降低及其基因表达减少在肺动脉高压的发生发展过程中起重要作用[5]。BKCa分布广泛,其开放具有Ca2+敏感性和电压依赖性。持续激活BKCa会引起膜超极化,降低L型钙通道活性,发挥负反馈作用,引起血管平滑肌舒张;反之,抑制BKCa会导致血管收缩[6]。
DHA对心血管的保护作用已广为人知。DHA能抑制心肌细胞膜上短时外向钾电流(Ito)和延迟整流钾电流(IK),达到抗心律失常作用[7]。DHA经过细胞色素P450表氧化酶代谢产生的环氧二十碳烯酸,可激活BKCa,使冠状动脉平滑肌细胞处于超极化状态,从而舒张冠状动脉[8]。因此,DHA通过影响离子通道而产生的心血管保护作用亦已被人们熟知。本研究显示,DHA对离体 PASMCs细胞膜上BKCa有明显激活作用;急性缺氧能明显抑制BKCa,但这种抑制作用被DHA逆转。研究发现慢性低氧性肺动脉高压大鼠PASMCs上的BKCa电流较正常大鼠显著降低[9]。Dospinescu 等[10]发现肺静脉平滑肌细胞膜上BKCa的氧气敏感性与其α亚基的应激调控外显子(stress-regulated exon,STREX)结构相关。而PASMCs上BKCa的氧气敏感性是否也与STREX相关则有待进一步研究。Thuringer等[11]发现低氧对兔肺动脉主干PASMCs的BKCa无效应。急性缺氧时,肺动脉主干与体循环动脉相似,主要发生舒张反应,而阻力性肺动脉主要发生快速可逆的收缩反应[12]。因此我们认为不同实验组结果有差异可能与研究的肺动脉段标本不同有关。本研究发现在D-Hanks液中,DHA 可增加 PASMCs[Ca2+]i,这一效应即刻发生,在达到峰值后,[Ca2+]i逐渐降低。[Ca2+]i增加主要通过细胞外钙离子内流和细胞内基质网释放,后者又被称为钙闪烁[13]。钙闪烁现象可激活BKCa,引起平滑肌细胞的舒张[14]。研究发现,DHA可通过促进三磷酸肌醇产生,激活蛋白激酶C,使U937细胞系发生外钙内流和内钙释放,增加细胞内[Ca2+]i,进而诱导其凋亡[15]。DHA 亦可以通过这 2条途径增加T细胞内[Ca2+]i通道[16]。因此我们认为DHA诱导PASMCs的内钙释放,激活BKCa,K+外流增加导致细胞膜电位超极化,电压依赖性钙离子通道关闭,细胞内游离钙离子减少,引起血管舒张,从而抵抗低氧诱发的肺血管收缩,发挥其抗肺动脉高压作用。

Figure 2.Inhibition of BKCa currents by hypoxia in rat PASMCs.A:representative tracings showed BKCa currents elicited by step depolarization(-60 to+60 mV in 10 mV increments)from a holding potential of-70 mV under normoxia and hypoxia.B:I-V relationships of BKCa currents under normoxia and hypoxia.Mean ±SD.n=5.**P <0.01 vs normoxia.图2 急性缺氧对BK Ca电流的影响
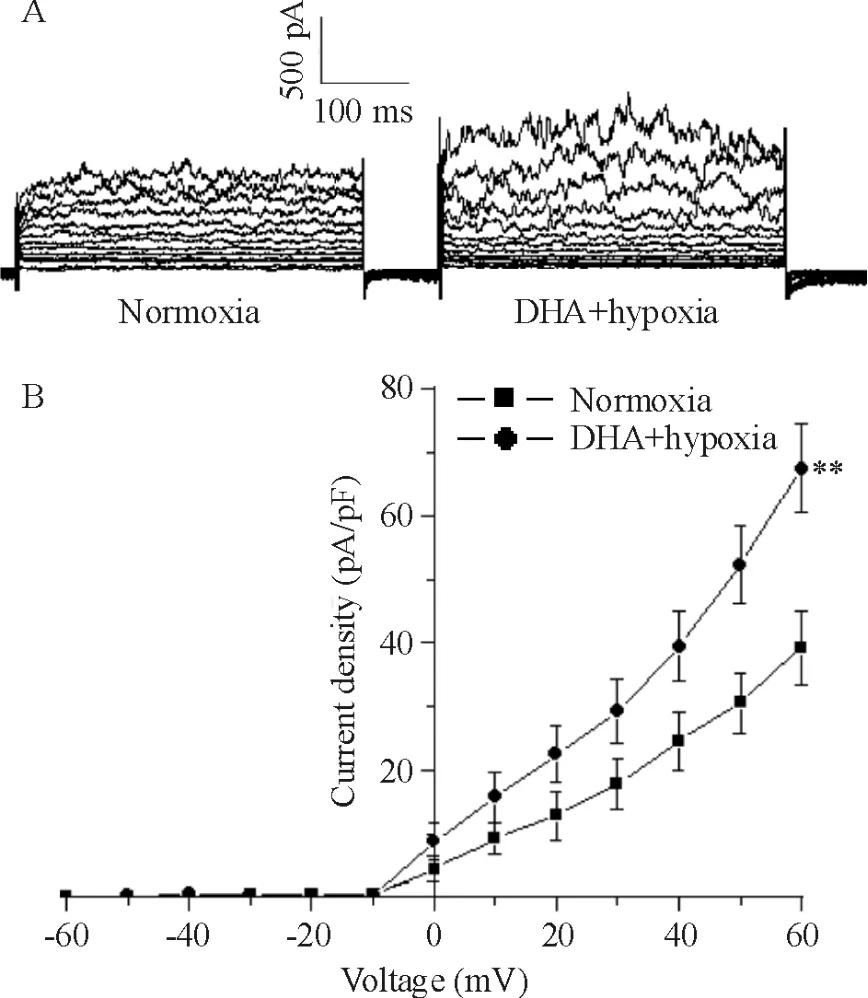
Figure 3.DHA increased whole-cell BKCa currents in rat PASMCs in hypoxia.A:representative tracings of BKCa currents under normoxia and hypoxia after preincubation with 10 μmol/L DHA.B:I-V relationships of BKCa currents under normoxia and hypoxia after pre-incubation with 10 μmol/L DHA.Mean±SD.n=5.**P <0.01 vs normoxia.图3 DHA预处理后,急性缺氧对BK Ca电流的影响
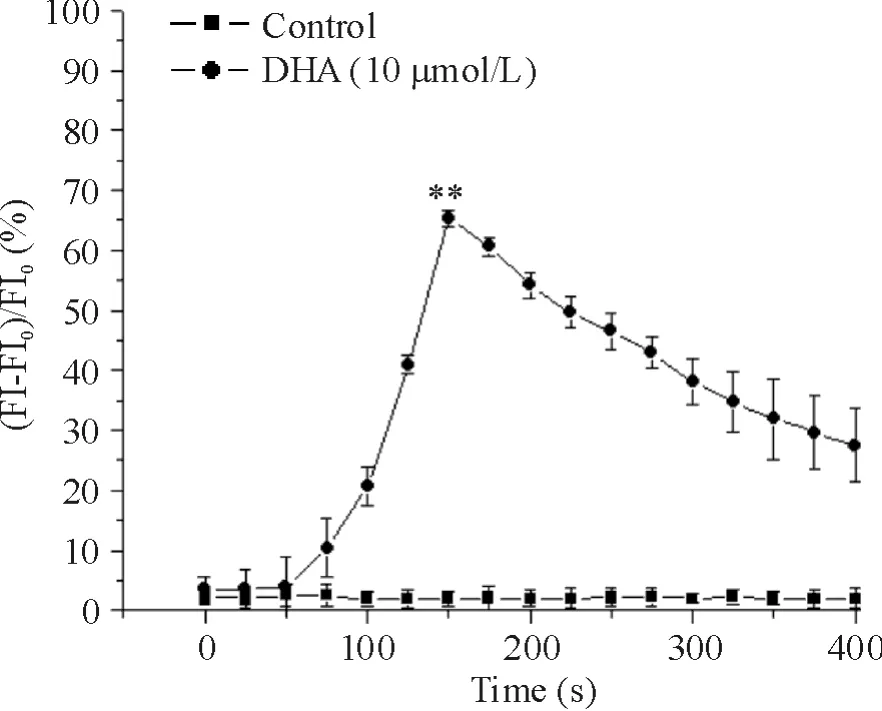
Figure 4.DHA increased[Ca2+]i in rat PASMCs.Mean±SD.n=17.**P <0.01 vs control at 150 s.图4 DHA对大鼠PASMCs[Ca2+]i的影响
肺动脉高压可致肺血管重构,PASMCs增殖增加,凋亡减少,增殖和凋亡之间平衡失调,中膜肥厚。钾通道的功能和表达与PASMCs增殖和凋亡密切相关。各种原因诱导的凋亡均存在较强的K+外流,使胞浆内K+浓度降低。DHA是否通过调节PASMCs上钾离子通道而抑制PASMCs的过度增殖尚需进一步研究。

