PK-15细胞α干扰素效应因子qPCR检测方法的建立及其初步应用
邹榕凯,李 俊,时建立,柳 晓,,丛晓燕,孙文博,杜以军,吴家强,王金宝,*
(1.青岛农业大学 动物科技学院,山东 青岛 266109;2.山东省农业科学院 畜牧兽医研究所,山东 济南 250100)
细胞因子(cytokine, CK)是一类能在细胞间传递信息,具有免疫调节效应的功能蛋白质或小分子多肽。细胞因子作为细胞间信号分子在机体的细胞与体液免疫中发挥着重要的作用。作为机体重要的细胞因子,干扰素(Interferon,IFN)自1957年被英国学者发现以来,一直是细胞因子研究中比较活跃的、进展最快的一种细胞因子。干扰素的生物学功能主要表现在广谱的抗病毒活性和免疫调节功能[1],体现在当病毒感染机体细胞后,细胞能够产生I型IFN(α-IFN,β-IFN,ω-IFN)并且很快释放到细胞外,作用于邻近的未受感染的细胞膜受体上,转录并激活ISGs(Interferon-stimuLated genes),产生OAS(2'-5'-oligoadenylate synthetase)和Mx(Myxovirus resistance)。通过这些酶发挥抗病毒活性,从而使细胞建立抗病毒状态[2]。
目前细胞因子表达量的检测主要是通过相关蛋白的表达水平和mRNA的转录水平两方面进行。从蛋白表达水平检测的方法主要有ELISA、Elispot和IFA等,这些检测技术均需要依赖特异性的抗体和一定的目的蛋白表达量,而且需要的时间较长、成本高[3]。从mRNA转录水平检测细胞因子的方法主要有Northern blot、原位杂交和qPCR等[4]。其中Northern blot能对靶基因进行定量分析,但需要大量的RNA,原位杂交消耗的时间比较长,常规的qPCR方法使用方便却难以准确定量。而qPCR方法作为一种较为简单的方法,仅需要少量的模板在较短的时间内即可对样品进行定量。这种方法有较高敏感性和良好重复性,以及耗时短、操作简单等优点,现在已被许多实验室接受,成为核酸定量检测及基因表达分析的首选方法而得到广泛的应用[5,6]。
本试验旨在建立一种用于检测PK-15细胞α-IFN效应因子的SYBR Green I qPCR方法,并利用该方法对转接种PCV2的PK-15细胞的Mx1、OAS等α-IFN效应因子进行相对定量分析,探讨PCV2对α-IFN效应因子的影响。同时为研究PCV2抑制α-IFN发挥效应的信号通路特别是JAK-STAT信号通路的机理奠定了基础。
1 材料与方法
1.1 菌种、细胞和载体
PK-15细胞和PCV2由本实验室保存,大肠杆菌DH5α购自北京全式金生物技术有限公司,pMD 18-T Vector购自宝生物工程(大连)有限公司。PK-15细胞培养于含10%胎牛血清的DMEM中,长满单层备用。
1.2 主要试剂
TRIzol Reagent购自Invitrogen公司;质粒提取试剂盒购自北京天根生物工程有限公司;TaqDNA聚合酶、dNTP、DNAMarkerDL 2 000、凝胶回收试剂盒、SYBR Premix Ex TaqTM (Tli RNase Plus)试剂盒、PrimeScript®RT reagent Kit With gDNA Eraser (Perfect Real Time)试剂盒等购自宝生物工程(大连)有限公司;DMEM、胎牛血清购自美国Gibco公司。
1.3 主要仪器
PTC-2000型PCR仪,美国MJResearch公司;核酸定量仪,美国Thermo公司;LightCycle®480,美国罗氏公司;冷冻离心机,德国Eppendorf公司;CO2培养箱,美国Thermo公司。
1.4 PK-15细胞α-IFN效应因子基因的引物设计及合成
根据GenBank中猪的β-actin、Mx1、OAS基因序列,选择保守区利用Premier 5.0软件设计相应的引物,经NCBI的BLAST分析证实引物的特异性后由上海生工生物工程技术服务有限公司合成,引物信息如表1所示。
1.5 RNA提取和cDNA的合成
RNA提取:按照TRIzol (Invitrogen)说明书,提取细胞总RNA,并测定其浓度。
cDNA合成:根据RNA的浓度调整RNA的用量,利用PrimeScript®RT reagent Kit With gDNA Eraser (Perfect Real Time)进行基因组DNA的去除并进行反转录,反转录后置于-20 ℃待用。
1.6 质粒标准品的制备
以cDNA为模板进行PCR反应,PCR产物经1.5%的琼脂糖凝胶电泳,用胶回收试剂盒提取DNA,然后将目的片段与pMD 18-T Vector连接,并转化DH5α感受态细胞,涂板后于37 ℃恒温箱中培养,12 h后挑取单菌落进行单克隆培养,提取质粒后进行PCR鉴定,并将阳性质粒送上海生工生物工程技术服务有限公司进行序列测定。
将测序正确的阳性重组质粒用核酸定量仪测定其浓度,并计算标准品的拷贝数。调整拷贝数后进行倍比稀释,分别以108、107、106、105、104、103、102、101、100拷贝/μL的质粒作为标准品,-80 ℃保存备用。
1.7 qPCR反应条件的优化
qPCR反应按照TaKaRa的SYBR Premix Ex TaqTM (Tli RNase Plus)试剂盒进行。通过比较Ct值、荧光强度、熔解曲线以及是否有引物二聚体峰来确定最佳引物浓度、退火温度、模板用量等,以得到最佳的qPCR反应条件。
1.8 qPCR标准曲线的建立
以稀释好的质粒标准品为模板,每个样品3次重复,经qPCR仪检测后得出Ct值,用仪器自动得出标准曲线和斜率,并由斜率计算扩增效率。公式为E=10-1/k-1(E为扩增效率,k为标准曲线斜率)。
1.9 qPCR灵敏性试验
以稀释好的拷贝数为1×100~1×107拷贝/μL质粒标准品为模板,每个样品3次重复,经qPCR仪扩增后,进行敏感度分析。
1.10 qPCR重复性试验
选取稀释好的质粒样本,每个样本3次重复,分别对其进行qPCR扩增。根据每次每个稀释度的Ct值进行变异系数的计算,确定该方法的批间重复性。
1.11 对IFN添加浓度、作用时间的筛选
用12孔板培养PK-15细胞,待细胞长满单层后,添加α-IFN进行刺激。参照Patel等[7]描述的方法,先以干扰素为1 000 U/mL的终浓度进行最佳α-IFN刺激时间筛选,根据筛选出来的最佳IFN刺激时间再进行IFN的添加浓度的筛选,以此筛选出最佳添加浓度和IFN刺激时间。
1.12 PCV2对PK-15细胞α-IFN效应因子mRNA水平的影响
PK-15细胞长满单层后,用0.25%的胰酶进行消化,将PCV2和PK-15细胞在37 ℃含5%的CO2培养箱中培养24 h后用α-IFN处理,分别于处理24 h后提取细胞总RNA,进行反转录,并利用LightCycle®480分别测每一个样品各个基因的Ct值,分别计算各个基因相对表达量。
1.13 数据分析
不同组别各细胞因子含量通过2-ΔΔCT法进行比较[8],所有数据用Microsoft Office Excel2003 One-way repeated measurement ANOVA进行统计分析。[ΔΔCt=(Ct目的基因-Ct内参基因)试验组-(Ct目的基因-Ct内参基因)对照组]。
2 结果与分析
2.1 PK-15细胞α-IFN效应因子基因的RT-PCR扩增与阳性标准质粒的构建
用常规RT-PCR方法,采用设计的特异性引物,对PK-15细胞的β-actin、Mx1、OAS基因进行扩增,获得了与各自预期片段大小一致的目的条带。与pMD 18-T Vector连接后,将阳性质粒测序并与参考序列进行一致性比较,结果核苷酸同源性均达到100%。纯化后阳性质粒OD260 nm/OD280 nm均介于1.8~2.0之间。
2.2 PK-15细胞α-IFN效应因子基因qPCR反应条件的优化
目的基因的Realtime PCR扩增产物的熔解曲线 (图1)分析表明,各目的基因扩增产物的溶解曲线呈单一峰,没有出现引物二聚体。所以本试验中所设计的引物特异性良好,可以用于下一步目的基因荧光定量检测的试验中。
优化后的PK-15细胞α-IFN效应因子β-actin、Mx1、OAS基因的qPCR反应体系为20 μL,其中2×SYBR Premix Ex TaqTM(Tli RNase Plus)10 μL、上下游引物终浓度为200 nmol/L、模板1 μL、余下用Rnasefree水补至20 μL。qPCR反应条件为:95 ℃ 5 min,95 ℃ 20 s,59℃10 s,40个循环。
2.3 荧光定量标准曲线的建立
将β-actin、Mx1、OAS阳性质粒标准品(浓度分别为1×103~1×107copies/μL)作为qPCR反应的模板,根据各稀释度得到的Cp值,绘制标准曲线。如图2所示,本研究建立的β-actin、Mx1、OAS基因的荧光定量检测方法线性关系良好,可用于目的基因表达量的检测。

图2 目的基因的动力学曲线、标准曲线及线性关系Fig. 2 Kinetic curve of the standard curve and the linear relationship of the target gene
2.4 灵敏性试验
以稀释好的拷贝数为1×100~1×107拷贝/μL质粒标准品为模板,根据各稀释度Ct值比较得出相应的检测范围。β-actin、Mx1、OAS的检测下限为100个拷贝。结果表明,该方法具有良好的敏感性,可以用于细胞因子相对表达量的分析中。
2.5 重复性试验
将每个样品每次3个重复进行qPCR反应。各细胞因子所有反应管平均Ct值相似,变异系数均在5%以内,说明该反应体系重复性较好(表2)。
2.6 对干扰素添加浓度、作用时间的筛选
通过比较不同α-IFN刺激时间、不同α-IFN终浓度下各个基因的相对表达量,最终筛选出最佳添加终浓度为750 U/mL和作用时间为24 h。

表2 目的基因组间重复性实验结果Table 2 The result of reproducibility of the experiments for target genes
2.7 PCV2对PK-15细胞α-IFN效应因子mRNA水平的影响
以未作任何处理的PK-15细胞作为对照,PK-15接种PCV2 24 h后用α-IFN处理,处理24 h后提取细胞总RNA进行qPCR检测。通过统计学分析,PCV2能够明显降低Mx1、OAS基因的mRNA的相对表达量,如图3所示。
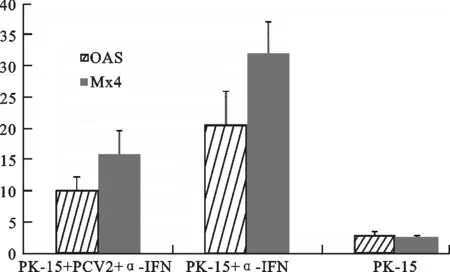
图3 PK-15细胞接种PCV2后各目的基因的相对表达量Fig.3 The relative mRNA expression level of target genein PK-15 cells infected with PCV2
3 讨 论
qPCR方法不仅实现了对DNA模板的定量,而且具有灵敏度高、准确性好和线性域值宽等优点,已逐渐应用于基因的表达的研究等诸多领域。但是,作为细胞因子研究热点,有关PK-15细胞α-IFN效应因子的实时荧光定量检测方法并未见相关报道,因此本研究建立了用于PK-15细胞α-IFN效应因子SYBR GreenI qPCR的检测方法,并利用建立的方法对PCV2抑制α-IFN发挥效应的信号通路进行了初步研究。
PCV2是一种无囊膜、单股环状DNA病毒,能够引起断奶猪多系统综合征等多种疾病,其典型临床症状主要表现为体重下降、皮肤苍白、呼吸困难以及黄疸,能够感染仔猪和育肥猪并发病[9]。其典型的病变是淋巴组织内伴随着组织细胞浸润的淋巴细胞减少,肺、肝、肾、心和肠等不同器官的肉芽肿[10-11]。目前,PCV2通过JAK-STAT信号通路抑制机体α-IFN产生的机制未见深入研究。本研究利用建立的SYBR Green I qPCR检测方法,检测PK-15细胞在感染PCV2后α-IFN效应因子Mx1、OAS的mRNA水平,结果表明PCV2能够明显降低Mx1、OAS基因的mRNA的相对表达量,这为进一步研究PCV2抑制α-IFN发挥效应的信号通路特别是JAK-STAT信号通路的机理奠定了基础。
参考文献:
[1] Bogdan C. The function of type I interferons in antimicrobial immunity[J]. Curr Opin Immunol, 2000, 12(4): 419-424.
[2] Yoo D, Song C, Sun Y, et al. ModuLation of host cell responses and evasion strategies for porcine reproductive and respiratory syndrome virus[J]. Virus Res, 2010, 154: 48-60.
[3] Garba M, Frelinger J. IntracelluLar cytokine staining for TGF-β[J]. J Immunol Methods, 2001, 258: 193-198.
[4] Ramos-Payán R, Aguilar-Medina M, Estrada-Parra S, et al. Quantification of cytokine gene expression using an economical real-time polymerase chain reaction method based on SYBR Green I[J]. Scand J Immunol, 2003, 57(5): 439-445.
[5] Bustin S, Benes V, Nolan T, et al. Quantitative real-time RT-PCR-a perspective[J]. J Mol Endocrinol, 2005, 34(3): 597-601.
[6] Bustin S. Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays[J]. J Mol Endocrinol, 2000, 25(2): 169-193.
[7] Patel D, Nan Y, Shen M, et al. Porcine Reproductive and Respiratory Syndrome Virus Inhibits Type I Interferon Signaling Blocking STAT1/STAT2 Nuclear Translocation[J]. J Virol, 2010, 84(21): 11 045-11 055.
[8] Livak K, Schmittgen T. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))[J]. Method, 2001, 25(4): 402-408.
[9] Harding J C S, Clark E G. Recognizing and diagnosing postweaning muLtisystemic wasting syndrome (PMWS)[J]. Swine Health Prod,1997,5:201-203.
[10] Chianini F, Majo N, Segales J. Immunohistochemical characterisationof PCV2 associate lesions in lymphoid and nonlymphoid tissues of pigs with natural postweaning muLtisystemic wasting syndrome (PMWS)[J]. Immunol Immunopathol,2003,94:63-75.
[11] Sorden S D. Update on porcine circovirus and postweaning multisystemic wasting syndrome[J]. Swine Health Prod, 2000,8:133-136.

