弱酸性环境对猪精液常温保存的影响
耿果霞,李雪涛,石美虹,李青旺*
(1.西北农林科技大学 动物医学院,陕西 杨凌 712100;2.西北农林科技大学 动物科技学院,陕西 杨凌712100)
随着猪人工授精技术的广泛应用,精液保存技术越来越受到重视。猪精液常温保存4~6 d,基本上能达到正常受胎率和产仔水平[1]。精清中含有抑制精子代谢的物质,较低程度的稀释可以促进精子的运动,而较高程度的稀释导致精子丧失运动能力、代谢活性和受精能力下降[2]。猪新鲜精液pH为7.2~7.5,低于猪精液pH的环境能降低猪精子的代谢和运动水平,延长精液的存活时间[3-5]。郭洪杞等[6]与Kuster 等[4]研究发现,保持稀释液的pH在5.5~6.5之间,稀释后精液pH就会维持在6.5~7.0之间,对延长精子寿命有显著效果[7]。何兰花等[8]研究认为,pH为6.4是猪精液保存最佳值。因此,弱酸环境被认为是精液保存的理想环境。但戈新等[9]认为,精液在保存过程中会产生酸性代谢产物,碱性稀释液能中和一部分酸性物质,防止稀释液过酸造成精子死亡[10]。因此,稀释液的pH没有统一的结论。除稀释液pH对猪精液的影响外,稀释液中添加一定量的缓冲剂可以中和精子的代谢产物,防止过酸化导致精子死亡,维持精液pH的动态平衡,同样可以起到保护精子的作用,如柠檬酸钠、磷酸盐类、Tris以及HEPES等[10]。本研究通过检测弱酸环境下不同pH的精子活率、质膜完整性和顶体完整率来反映精子的保存效果,从而确定用于保存猪精液的稀释液pH,为猪精液的常温保存提供参考和依据。
1 材料与方法
1.1 材 料
新鲜公猪精液(采集自武功县山佳生态种猪场健康种猪)仪器:台式冷冻离心机;超净工作台;普通冰箱;倒置显微镜;实验室用pH计;水浴锅;电子天平;数显恒温培养箱;超纯水仪等。试剂:BTS稀释液、柠檬酸盐精子低渗液、0.01 mol/L盐酸溶液、甲醛固定液、姬姆萨染色液。
1.2 方 法
1.2.1 稀释液 取7个10 mL离心管并编号,每个离心管中加入配制好的贝兹维尔解冻液(Beltsville thawing solution,BTS)2 mL,用0.01 mol/L盐酸溶液调节BTS稀释液的pH,使1~6号管的对应pH分别为6.2、6.3、6.4、6.5、6.6、6.7,7号管为对照组,pH为7.2。完成后保存于4 ℃冰箱中备用。
1.2.2 精液的稀释与保存 将检查合格的70 mL精液分装为7份,在15 ℃下低速(800×g)离心15 min,弃去上清,将1~7号离心管中的BTS稀释液加入,混匀后置于恒温培养箱中,17 ℃保存。
1.3 精液品质测定
1.3.1 精子活率的测定 从17 ℃恒温箱中取出保存的精液,用移液枪吸取10 μL置于载玻片上,盖上盖玻片后立即在400倍光学显微镜下观察[11]。每个样品随机观察5个视野,每次数200个精子,检测直线前进运动的精子数占总精子数的比例,计算精子活率。
精子活率=(直线前进运动精子数/精子总数)×100%
1.3.2 精子质膜完整性 从17 ℃恒温箱中取出保存的精液,用移液枪吸取10 μL置于载玻片上,用预热至37 ℃的柠檬酸盐低渗液混匀孵育30 min,盖上盖玻片后在400倍光学显微镜下观察[12]。每个样品随机观察5个视野,每次数200个精子,计算精子质膜完整率。
精子质膜完整率=(弯尾精子数/精子总数)×100%
1.3.3 精子顶体完整性 从17 ℃恒温箱中取出保存的精液,用移液枪吸取20 μL置于载玻片上,制成抹片后在空气中干燥,甲醛固定15 min后缓慢的用双蒸水冲洗,干燥后均匀滴加姬姆萨染色液,使其全部覆盖,染色1.5 h后缓慢的用双蒸水冲洗,置于空气中干燥,在400倍倒置显微镜下观察[11]。每个样品随机观察5个视野,每次数200个精子,计算精子顶体完整率。
精子顶体完整率=(顶体完整精子数/精子总数)×100%
1.4 统计分析
整个试验进行3次重复,所有试验样品每隔8 h进行一次品质测定,共测定7次,试验数据用SPSS 20.0软件处理,试验结果以“平均数±标准差”表示。
2 结果与分析
2.1 不同pH稀释液对猪精子活率的影响
用不同pH稀释液稀释后的精液每隔8 h进行一次精子活率测定,测定结果如表1所示。

表1 0~48 h中不同弱酸性环境下的精子活率Table 1 The sperm motility rate in weak acid environment with different pH after diluted 0~48 h %
注:同行肩标不同字母表示差异显著(P<0.05)。下同。
Note: In the same row, different superscripts mean significant difference (P<0.05).The same below.
精液在刚经过稀释后的活率无显著性差异(P>0.05),24 h后精子活率明显下降,其中用pH为6.4和6.5的稀释液稀释的精液精子活率最高,且分别高于对照组15.17%和14.82%(P<0.05)。48 h后,用pH为6.2、6.3和6.7的稀释液的精子活率明显降低,而pH为6.4的稀释液保存的精子活率仍高于对照组18.34%(P<0.05)。72 h后观察精子全部死亡。
2.2 不同pH稀释液对精子质膜完整性的影响
通过每隔8 h对用不同pH稀释液稀释后的精子质膜完整性测定,精液在刚经过稀释后质膜完整性无显著性差异(P>0.05),表明在刚进行处理后的精液还未受到影响(表2)。24 h后,精子质膜完整性明显下降,其中用pH为6.4和6.5的稀释液稀释的精液精子质膜完整率较高,分别比对照组高7.34%和12.34%(P<0.05)。48h后,pH为6.5的稀释液保存的精子质膜完整性最好,达到42.17%,比对照组高19.36%(P<0.05)。pH为6.4的稀释液中的精子质膜完整率略低,pH为6.5的低6.65%;而pH6.2的稀释液中的精子质膜完整性最差,比对照组低3.13%。
2.3 不同pH稀释液对精子顶体完整性的影响
用不同pH稀释液稀释后的精液每隔8 h进行精子顶体完整性测定结果如表3。精液在刚经过稀释后,顶体完整性无显著性差异(P>0.05),说明未处理前初始条件相同。24 h后观察精子顶体完整性出现明显下降,其中用pH为6.4和6.5的稀释液稀释的精液精子顶体完整率较高,分别比对照组高出16.18%%和14.18%(P<0.05)。48 h后,pH为6.2、6.6、6.7的稀释液保存的精子顶体完整率较低。pH为6.4和6.5的稀释液稀释的精液精子顶体完整率仍较高,分别高出对照组19.02%和18.83%(P<0.05)。72 h后观察精子顶体完整性都降至为0。

表2 0~48 h中不同弱酸性环境下的精子质膜完整性Table 2 The sperm plasma membrane integrity in weak acid environment with different pH after diluted 0~48 h %
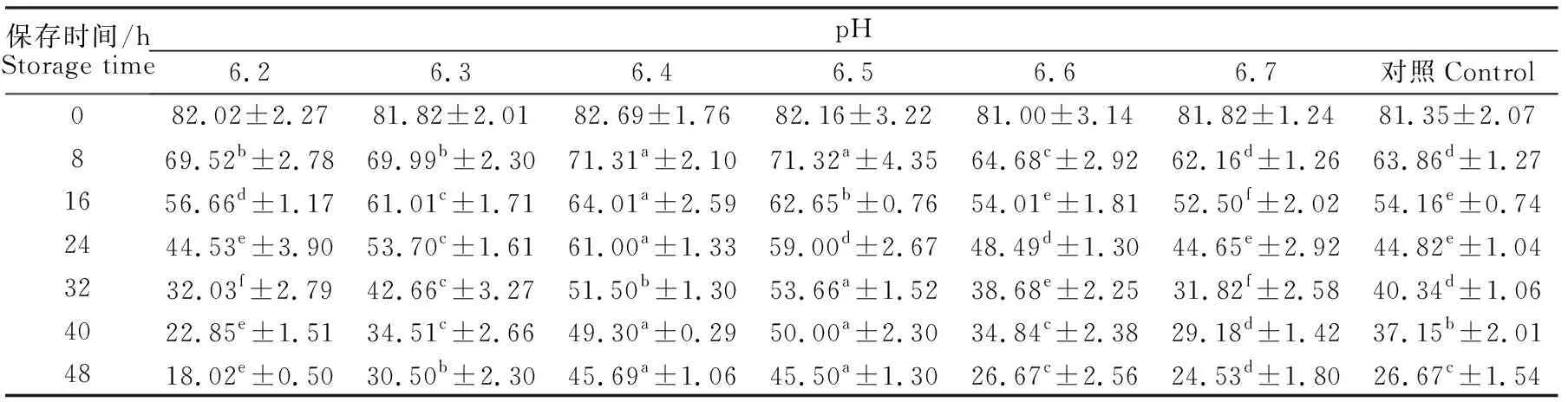
表3 0~48 h中不同弱酸性环境下的精子顶体完整性Table 3 The sperm acrosome integrity in weak acid environment with different pH after diluted 0~48 h %
3 讨 论
关于稀释液的pH对猪新鲜精液的保存的影响,国内外仍然不是十分清楚。一些研究认为当猪新鲜精液pH为7.2~7.5时,通过降低猪精子的代谢和运动水平,可延长精子的存活时间[3-5]。郭洪杞等[6]与Kuster等[4]研究揭示,猪精液pH维持在6.5~7.0之间,有利于延长精子存活时间[7]。何兰花等[8]研究发现,猪精液pH为6.4时保存效果较好。因此,猪精液保存在弱酸环境条件下被认为是较为理想的环境。在本试验中,通过检测不同pH的弱酸性环境下的稀释液保存的常温猪精液品质,表明pH为6.4的稀释液精子活率较高, pH为6.5的稀释液的精子质膜完整性较高,而pH 6.4和6.5环境下的精子顶体完整性均较高。这一结果与何兰花等[8]的研究结果较为一致,表明猪精液稀释液pH对猪常温精液保存具有明显的影响作用。但是在pH 6.4到6.5之间适宜精子保存的弱酸性环境稀释液的更适宜的范围仍有待于进一步的研究。
4 结 论
不同pH的弱酸性环境稀释液对猪精液常温保存具有明显的影响,而pH为6.4和6.5的弱酸环境稀释液常温保存猪精液效果在24 h内较好。
参考文献:
[1] 程文聪,刘春华.猪精液常温保存稀释液的筛选试验[J].养殖与饲料,2006(8):8-11.
[2] Maxwell W M, Johnson L A.Physiology of spermatozoa at high dilution rates: the influence of seminal plasma[J]. Theriogenology,1999,52 (8): 1 353-1 362.
[3] Johnson L A, Weitze K F,Fiser P,et al. Storage of boar semen[J]. Animal Reproduction Science,2000, 62(1-3):143-172.
[4] Kuster C E, Althouse G C.The fecundity of porcine semen stored for 2 to 6 days in Androhep and Xcelitm extenders[J].Therigenology, 1999,52:365-376.
[5] 高建明,虞桂平,邵世义,等.不同稀释液对猪精液常温保存效果的影响[J].中国畜牧杂志, 2007,43(13):17-19.
[6] 郭洪杞,罗 杰,王文强,等.猪精液稀释液常温保存研究[J].安徽农业科学, 2005,33(12):2 344.
[7] 林 峰,杨 婷,陈玉霞,等.温度与稀释pH对猪精液常温保存效果的影响[J].家畜生态学报,2012,33(4):66-68.
[8] 何兰花,周美华,陆少华,等.猪精液常温保存的试验[J].黑龙江动物繁殖,2005,13(4):8-9.
[9] 戈 新,张宝殉,王建华,等.商品稀释剂pH、渗透压测定及其对猪常温精液保存效果的比较[J].畜牧与兽医,2011,43(2):37-40.
[10] 高 飞,岳奎忠,杨增明.精液液态保存的研究进展[J].中国畜牧杂志, 2004,40(6):46-49.
[11] 张忠诚.家畜繁殖学[M].北京:中国农业出版社,2006.
[12] 徐振军,季慧苹,赵 冰,等. 哺乳动物冻融精子质膜检测方法研究[J].黑龙江畜牧兽医,2011(3):56-59.

