人参蛋白对β淀粉样蛋白140和H2O2损伤神经元的保护作用及其机制
李红艳,曹 阳,白雪媛,赵 丹,张晓丹,杨静娴,康廷国
(1.辽宁中医药大学药学院药理学教研室,辽宁 大连 116600;2.辽宁省大连市华信理化检测中心有限公司检测部, 辽宁 大连 116600;3.长春中医药大学中医药与生物工程研发中心,吉林 长春 130117)
杨静娴(Tel:0411-87586009,E-mail:jingxianyang@yahoo.com)
人参蛋白对β淀粉样蛋白140和H2O2损伤神经元的保护作用及其机制
李红艳1,曹 阳2,白雪媛3,赵 丹1,张晓丹1,杨静娴1,康廷国1
(1.辽宁中医药大学药学院药理学教研室,辽宁 大连 116600;2.辽宁省大连市华信理化检测中心有限公司检测部, 辽宁 大连 116600;3.长春中医药大学中医药与生物工程研发中心,吉林 长春 130117)
目的:探讨人参蛋白(GP)对β淀粉样蛋白1-40(Aβ1-40)和过氧化氢(H2O2)诱导神经元损伤的影响,阐明GP对神经元的保护作用及其机制。方法:从新生乳鼠大脑皮层中分离纯化神经元,培养12 d后,分别采用Aβ1-40(30 μmol·L-1)和H2O2(200 μmol·L-1)诱导神经元损伤,并随机分为模型组(Aβ1-40模型组与H2O2模型组,不加药物)、GP组和GP含药血清组。采用MTT法检测各组神经元存活率;试剂盒法检测细胞培养上清液中一氧化氮合酶(NOS)活性和一氧化氮(NO)水平;Hoechst 33342/PI荧光染色检测细胞凋亡与坏死率。结果:倒置荧光显微镜,Aβ1-40和H2O2处理后,神经元数量明显减少,轴突缩短或消失,胞体变圆、缩小,大小不等,核固缩,核染色质聚集;Heochst 33342染色呈现高蓝光;部分细胞PI染色呈现高红光。加入GP及其含药血清后,神经元数量增多,胞体增大,细胞核着色形态为圆形、淡蓝色,PI阳性细胞数量减少。MTT法,GP组细胞存活率明显高于模型组(Plt;0.05或Plt;0.01),GP含药血清组与模型组无显著差异(5%GP含药血清组除外,Pgt;0.05);试剂盒法,GP组细胞培养上清液中NOS活性与NO水平明显低于模型组(Plt;0.05 或Plt;0.01);Hoechst 33342/PI法,GP及其含药血清组细胞凋亡率低于模型组,以GP组差异更明显(Plt;0.05或Plt;0.01),GP及其含药血清组细胞坏死率与模型组比较差异无统计学意义(Pgt;0.05)。结论:GP具有神经保护作用,作用机制与减少NOS活性、降低NO水平、抑制神经元凋亡有关。
人参蛋白;血清;神经元;β淀粉样蛋白;细胞凋亡
人参系五加科植物人参(PanaxginsengC.A.Meyer.)的干燥根及根茎,具有安神益智等功效[1]。目前已有关于人参促智作用的研究,但研究大多以人参皂苷为活性成分[2-4],人参蛋白(ginseng protein,GP)已被证明具有抗氧化[5-6]、增强免疫等药理活性[7],这些活性为GP的抗衰老研究提供了药理学基础。然而,关于GP的促智作用及其对神经细胞的影响目前尚未见相关报道。本实验通过研究GP对神经细胞的保护作用,为进一步研究人参安神益智的物质基础提供科学依据,为探讨GP抗衰老作用及其机制奠定基础。
1 材料与方法
1.1 实验动物、主要试剂和仪器
出生24 h内昆明种小鼠15只,用于制备神经元;5月龄昆明种清洁级小鼠30只(体质量25~28 g,雌雄各半),用于制备含药血清。小鼠均购自大连医科大学实验动物中心,合格证号:SCXK辽2008-0002;人参购自吉林省靖宇县,经长春中医药大学中药鉴定教研室姜大成教授鉴定为五加科植物人参(符合中国药典2010版规定),DMEM高糖培养基、胎牛血清(FBS,美国Gibco公司),β淀粉样蛋白1-40(beta-amyloid protein1-40,Aβ1-40)、Hoechst 33342、碘化丙啶(PI)、多聚赖氨酸和Bradford蛋白含量试剂盒(德国Sigma公司),一氧化氮合酶(nitric oxide synthase,NOS)和一氧化氮(nitric oxide,NO)试剂盒(南京建成生物工程研究所),NU-4750型二氧化碳培养箱(美国Nuaire公司);MR-96A型酶标仪(深圳迈瑞生物医疗电子股份有限公司),UV-1800型紫外-可见分光光度计(北京瑞利分析仪器公司),DW-86L386型超低温冰箱(青岛海尔电器有限公司),NIB-100F型倒置荧光显微镜(宁波永新光学有限公司)。
1.2 GP的制备
GP由长春中医药大学赵雨教授提供,经Bradford蛋白浓度测定试剂盒检测,蛋白浓度为80.6%。具体制备方法为:新鲜人参洗净、室温自然干燥,经高速组织粉碎机粉碎,加入10倍量(W/V=g·mL-1)pH7.5 PBS缓冲液,4℃浸提2次,每次12 h,浸提液离心,合并上清。经中空纤维膜过滤装置,采用0.45 μm微滤膜和相对分子量为10 000的超滤膜分别进行微滤除杂、超滤除杂及浓缩,收集超滤浓缩液,冷冻干燥即得。
1.3 GP含药血清制备
30只5月龄昆明小鼠随机分为GP高剂量组(1 g·kg-1·d-1)、GP低剂量组(0.5 g·kg-1·d-1)和空白组(给予生理盐水),每组10只,各组小鼠以灌胃方式给药,每日2次,连续30 d。末次给药后,各组小鼠眼球取血,4℃、2 000 r·min-1离心10 min,收集上层浅黄色血清,即得GP高、低剂量小鼠含药血清和空白血清,相同组合并。各留取500 μL,56℃灭活30 min,放凉后无菌过滤分装,-20℃冰箱保存备用,其余血清分装后存放于-80℃冰箱。
1.4 小鼠神经元制备及培养
15只新生乳鼠置于75%酒精中,使其窒息而死并消毒5 min,无菌分离大脑皮层,剪碎,用0.25%胰酶(含EDTA)37℃消化30 min,加入DMEM培养基(含10% FBS)终止消化,70 μm细胞筛网研磨、过滤,离心收集上清液,吹打分散细胞,以1×106mL-1接种于经0.1 g·L-1多聚赖氨酸包被过夜的96孔板中[8-9],每孔100 μL,于37℃、5% CO2培养箱中培养,每3 d换液1次,第5天时加入终浓度2.5 μmol·L-1阿糖胞苷处理24 h抑制胶质细胞生长,第12天时神经元铺满形成网络状,经神经丝蛋白-M(neurofilament protein NF-M)-DAPI检测,神经元纯度在90%以上[10]。
1.5 MTT法检测神经元存活率
1.5.1 GP作用后神经元存活率 Aβ1-40干粉溶于去离子水配成1 000 μmol·L-1溶液,37℃孵育7 d备用[11]。待神经元培养至第12天成熟时,将96孔板内细胞平均分成2份。一份用终浓度为30 μmol·L-1Aβ1-40(每孔20 μL)诱导神经元损伤,并将损伤后细胞随机分为Aβ1-40模型组(Aβ1-40model,不加药物)、GP组(GP 40、80、400、800及8 000 mg·L-1,每孔20 μL)、空白对照组(每孔加20 μL PBS)和正常对照组(未经损伤的神经元,正常加培养基培养),各做3个复孔,平行实验3次。另一份用终浓度为200 μmol·L-1H2O2(每孔20 μL)诱导神经元损伤,分组与操作同上,模型组为H2O2模型组(不加药物)。
1.5.2 GP含药血清作用后神经元存活率 操作步骤同1.5.1,给药组为GP含药血清(1 g·kg-1·d-1GP灌胃后的小鼠血清,终浓度为5%、10%和15%,每孔20 μL),对照组为空白小鼠(灌胃生理盐水的小鼠)的血清。各组细胞孵育48 h后,于各孔加入20 μL终浓度5 g·L-1MTT,继续培养4 h,吸净孔内液体,每孔加入150 μL DMSO,于酶标仪上震荡至深蓝色结晶完全溶解,490 nm处测各孔吸光度(A)值,并计算细胞存活率。细胞存活率=(A实验组/A正常组)×100%[12],其中给药组(人参蛋白组和人参蛋白含药血清组)细胞存活率要扣除各自空白对照组细胞存活率,细胞存活率=[A给药组-(A空白组-A模型组)]/ A正常组×100%。
1.6 试剂盒法检测神经元NOS活性和NO水平
采用Aβ1-40和H2O2诱导神经元损伤,并加入80、400、800 mg·L-1GP及其1 g·kg-1·d-1给药组小鼠5%、10%、15%含药血清,孵育48 h后,吸取细胞上清液,按试剂盒说明书测定NOS活性(U·L-1)和NO水平(μmol·L-1)。
1.7 Heochst 33342/PI双染色法检测神经元凋亡与坏死率
孵育48 h后的神经元采用0.25%胰酶消化、离心,用培养基调整细胞密度为1×105~1×106mL-1,吸取1 mL细胞,加入10 μL Heochst 33342染液(终浓度10 mg·L-1),混匀,37℃孵育10 min,离心,弃上清,再加入1.0 mL PBS悬浮细胞,加入5 μL PI染液(终浓度20 mg·L-1),混匀,避光染色10 min。取5 μL于玻片上,倒置荧光显微镜下随机计数200个细胞,区分活细胞、凋亡细胞和坏死细胞,实验平行3次,计算凋亡率及坏死率。凋亡率=(凋亡细胞数/视野内神经元总数)×100%,坏死率=(坏死细胞数/视野内神经元总数)×100%[13]。
1.8 统计学分析
2 结 果
2.1 GP作用后各组小鼠神经元存活率
经Aβ1-40处理后,小鼠神经元存活率明显降低(Plt;0.01)。除40 mg·L-1GP组与Aβ1-40模型组神经元存活率差异无统计学意义(Pgt;0.05),其余各浓度GP组均较Aβ模型组细胞存活率明显增加(Plt;0.01);各浓度GP组大鼠细胞存活率均较H2O2模型组显著增加,GP浓度增加并不会引起细胞存活率明显增加,故初步选择80、400和800 mg·L-1GP进行下一步研究。见表1。
2.2 GP含药血清作用后各组小鼠神经元存活率 经Aβ1-40和H2O2处理后,小鼠神经元存活率明显降低(Plt;0.01);加入终浓度5%、10%和15%GP含药血清后,仅5%GP含药血清组较H2O2模型组神经元存活率增加(Plt;0.05),其他各浓度GP含药血清组与模型组比较差异无统计学意义(Pgt;0.05)。见表2。
2.3 各组小鼠神经元NOS活性与NO水平
经Aβ1-40和H2O2损伤后,神经元培养上清液中NOS活性及NO水平与空白对照组比较均明显增加(Plt;0.01);加入不同浓度GP后,NOS活性及NO水平与模型组比较均有不同程度降低(Plt;0.05或Plt;0.01)。见表3。
表1 GP作用后各组小鼠神经元存活率
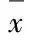
Tab.1 Survival rates of neurons of mice in various groups after treated with GP [n=3,η/(±s)%]
*Plt;0.01vsblank control group;△Plt;0.05,△△Plt;0.01vsmodel group.
2.4 各组小鼠神经元凋亡与坏死率
经Aβ1-40和H2O2处理后,神经元出现胞体变圆、缩小,大小不等,核固缩、破裂,核染色质聚集等凋亡形态学改变;Heochst 33342染色呈现高蓝光;少量细胞坏死,PI染色呈现高红光。加入GP及其含药血清后,细胞凋亡数目与模型组比较明显减少,400和800 mg·L-1GP组小鼠神经元凋亡率与Aβ1-40模型组比较明显降低(Plt;0.01);80、400和800 mg·L-1GP组小鼠神经元凋亡率较H2O2模型组明显降低(Plt;0.05或Plt;0.01)。GP含药血清组神经元坏死率与Aβ1-40模型组和H2O2模型组比较虽有降低趋势,但差异无统计学意义(Pgt;0.05)。见图1(插页二)、表4和5。
表2 GP含药血清作用后各组小鼠神经元存活率
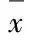
Tab.2 Survival rates of neurons of mice in various groups after treated with serum containing GP [n=3,η/(±s)%]
*Plt;0.01vsblank control group;△Plt;0.05vsmodel group.
表3 各组小鼠神经元NOS活性和NO水平


GroupDose(mg·L-1)ActivityofNOS[λB/(U·L-1)]DamagedbyAβ1⁃40DamagedbyH2O2LevelofNO[cB/(μmol·L-1)]DamagedbyAβ1⁃40DamagedbyH2O2Blankcontrol 010.465±0.94110.465±1.00416.982±1.04216.982±1.324Model 015.349±1.113∗18.206±1.633∗35.221±3.262∗40.022±2.548∗GP8013.026±1.23316.826±1.55134.128±3.33533.124±2.041△40011.265±1.061△13.261±1.225△30.342±1.38926.828±1.881△△8009.688±0.816△△9.678±0.995△△25.685±1.967△21.306±1.956△△
*Plt;0.01vsblank control group;△Plt;0.05,△△Plt;0.01vsmodel group.
表4 GP作用后小鼠神经元凋亡率和坏死率
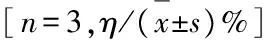
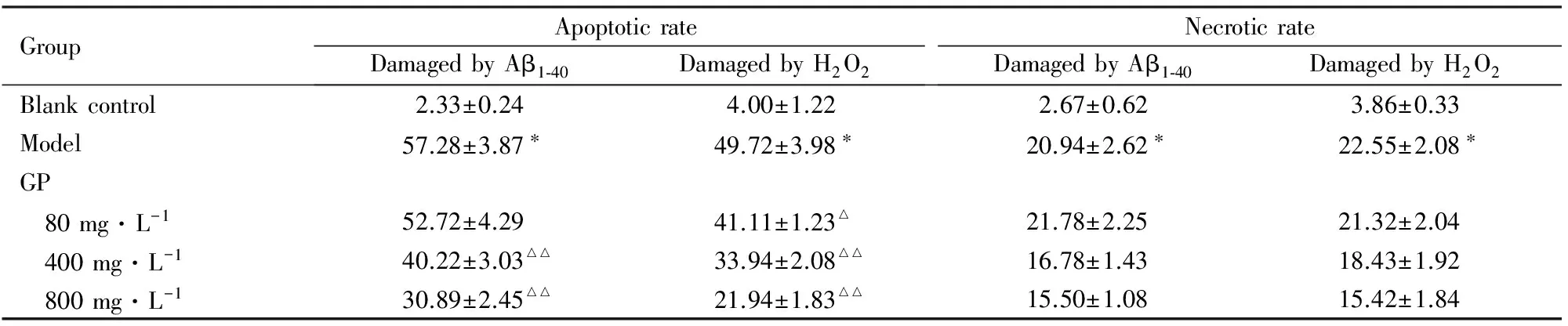
GroupApoptoticrateDamagedbyAβ1⁃40DamagedbyH2O2NecroticrateDamagedbyAβ1⁃40DamagedbyH2O2Blankcontrol2.33±0.244.00±1.222.67±0.623.86±0.33Model57.28±3.87∗49.72±3.98∗20.94±2.62∗22.55±2.08∗GP 80mg·L-152.72±4.2941.11±1.23△21.78±2.2521.32±2.04 400mg·L-140.22±3.03△△33.94±2.08△△16.78±1.4318.43±1.92 800mg·L-130.89±2.45△△21.94±1.83△△15.50±1.0815.42±1.84
*Plt;0.01vsblank control group;△Plt;0.05,△△Plt;0.01vsmodel group.
3 讨 论
神经元是神经系统结构与功能的基本单位,参与学习与记忆过程。Aβ1-40可引起神经元变性和死亡,其产生与聚集是老年痴呆症的重要病理学特征[14-15]。H2O2具有很强的氧化性,对神经细胞有损害。本实验采用Aβ1-40和H2O2诱导神经元损伤,并研究GP对2种模型的保护作用,为GP抗衰老、抗老年痴呆等作用研究奠定基础。
表5 GP含药血清作用后小鼠神经元凋亡率和坏死率
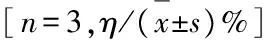
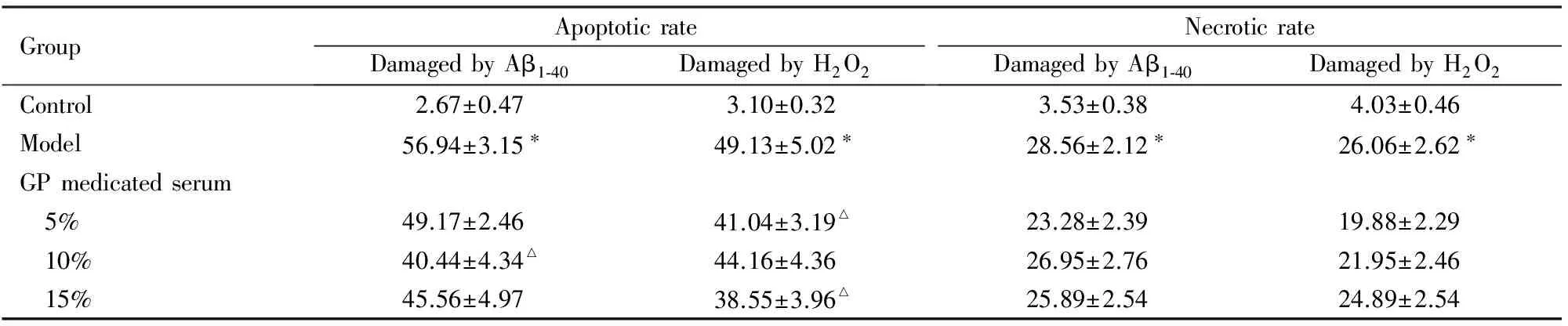
GroupApoptoticrateDamagedbyAβ1⁃40DamagedbyH2O2NecroticrateDamagedbyAβ1⁃40DamagedbyH2O2Control2.67±0.473.10±0.323.53±0.384.03±0.46Model56.94±3.15∗49.13±5.02∗28.56±2.12∗26.06±2.62∗GPmedicatedserum 5%49.17±2.4641.04±3.19△23.28±2.3919.88±2.29 10%40.44±4.34△44.16±4.3626.95±2.7621.95±2.46 15%45.56±4.9738.55±3.96△25.89±2.5424.89±2.54
*Plt;0.01vscontrol group;△Plt;0.05,△△Plt;0.01vsmodel group.
本实验所用GP为水溶性总蛋白,由于蛋白质相对分子质量较大,体内能否吸收尚存在质疑,因此,本文作者采用灌胃给药方式制备小鼠GP含药血清,并对其进行相关药理学研究。
MTT细胞活性检测结果表明:GP及其含药血清能提高细胞存活能力、减少细胞死亡;Hoechst 33342/PI荧光双染和NOS活性、NO水平分析结果表明:GP及其含药血清能抑制细胞凋亡、增加细胞抗氧化水平。提示GP能抵抗Aβ1-40和H2O2引起的神经元损伤,其作用机制与抑制神经元凋亡、提高细胞抗氧化水平等有关联。GP含药血清对神经元的保护作用不及GP明显,这可能是由于GP体内吸收差,难以达到神经元保护作用的有效血药浓度,也可能是血清灭活过程中导致药效降低,本文作者正在进行进一步实验研究。
综上所述,GP具有神经保护作用,具有抗衰老和治疗退行性疾病的潜力,有必要开展相关动物模型实验以进一步验证。
[1] 中国药典委员会.中国药典[M].北京:中国医药科技出版社,2010.
[2] Lee HS,Kim MR,Park Y,et al. Fermenting red ginseng enhances its safety and efficacy as a novel skin care anti-aging ingredient:in vitro and animal study[J]. J Med Food,2012,15(11):1015-1023.
[3] Cho S,Won CH,Lee DH,et al. Red ginseng root extract mixed with Torilus fructus and Corni fructus improves facial wrinkles and increases type I procollagen synthesis in human skin:a randomized,double-blind,placebo-controlled study[J]. J Med Food,2009,12(6):1252-1259.
[4] Chen X,Zhang J,Fang Y,et al. Ginsenoside Rg1 delays tert-butyl hydroperoxide-induced premature senescence in human WI-38 diploid fibroblast cells[J]. J Gerontol A Biol Sci Med Sci,2008,63(3):253-264.
[5] Li HY,Zhao Y,Cao Y,et al. Purification and characterization of a superoxide dismutase from Panax ginseng[J]. Biomedi Chromatography,2010,24(11):1203-1207.
[6] 徐云凤,赵 雨,张 惠,等. 人参蛋白对小鼠的耐缺氧及抗氧化作用[J].食品科技,2012,37(3):79-82.
[7] 李 霞,孙立伟,申 野.人参水溶性蛋白活性研究进展[J].中国实用医药,2010,5(27):243-244.
[8] 周国凤,汤京龙,周 亮,等.一种改进的大脑皮层神经元原代培养方法的研究[J].药物分析杂志,2011,31(2):299-301.
[9] 陈雪松,马 姬,薛 燕,等.ICR胎鼠原代神经元细胞培养及鉴定[J].上海交通大学学报:医学版,2013,33(2):249-252.
[10]张晓丹,胡 昱,张 囡,等.独活香豆素对Aβ25-35损伤神经元的保护作用及机制研究[J].中药药理与临床,2012,28(5):57-61.
[11]Liu T,Jin H,Sun QR,et al. Neuroprotective effects of emodin in rat cortical neurons against beta-amyloid-induced neurotoxicity[J]. Brain Res,2010,1347:149-160.
[12]Liu WB,Zhou J,Qu Y,et al. Neuroprotective effect of osthole on MPP+-induced cytotoxicity in PC12 cells via inhibition of mitochondrial dysfunction and ROS production[J]. Neurochem Int,2010,57(3):206-215.
[13]Yang JX,Yan YP,Ciric B,et al. Evaluation of bone marrow- and brain-derived neural stem cells in therapy of central nervous system autoimmunity[J]. Am J Pathol,2010,177(4):1989-2001.
[14]Deng Y,Wang Z,Wang RT,et al. Amyloid-β protein (Aβ) Glu11 is the major β-secretase site of β-site amyloid-β precursor protein-cleaving enzyme 1(BACE1),and shifting the cleavage site to Aβ Asp1 contributes to Alzheimer pathogenesis[J]. Eur J Neurosci,2013,37(12):1962-1969.
[15]Lefort R,Pozueta J,Shelanski M. Cross-linking of cell surface amyloid precursor protein leads to increased β-amyloid peptide production in hippocampal neurons:implications for Alzheimer's disease [J]. J Neurosci,2012,32(31):10674-10685.
Protectiveeffectofginsengproteinonneuronsdamagedbyamyloid-βprotein1-40andH2O2anditsmechanism
LI Hong-yan1,CAO Yang2,BAI Xue-yuan3,ZHAO Dan1,ZHANG Xiao-dan1, YANG Jing-xian1,KANG Ting-guo1
(1. Department of Pharmacology,Liaoning University of Traditional Chinese Medicine,Dalian 116600,China;2. Department of Detection,Huaxin Physical and Chemical Analysis Center CO.,Ltd, Dalian 116600,China;3. Chinese Medicine and Bioengineering Research Center,Changchun University of Traditional Chinese Medicine,Changchun 130117,China)
ObjectiveTo investigate the effect of ginseng protein (GP) on neurons damaged by beta amyloid protein1-40(Aβ1-40) and hydrogenperoxide (H2O2),and to clarify the neuroprotective effect of GP and its mechanism.MethodsThe primary neurons were isolated and purified from cerebral cortex of suckling mouse and cultured for 12 d,and damaged by 30 μmol·L-1Aβ1-40and 200 μmol·L-1H2O2. Then the damaged cells were randomly divided into model group (Aβ1-40model group and H2O2model group,no drugs),GP group and GP medicated serum group. MTT method was used to detect the survival rates of cells;Qiagen was used to detect the activities of NOS and levels of NO in culture supernatant,and Hoechst 33342/PI fluorescent staining method was used to detect the apoptotic and necrotic rates of cells.ResultsIt was observed that by the treatment of Aβ1-40and H2O2,the number of neuron was decreased,the axons shortened or disappeared,the karyopyknosis concentrated into a bright blue(dyed by Hoechst 33342),and some cells were dyed into red by PI under inverted flurescence microscope; after adding GP and its medicated serum,the number of cells was obviously increased,the cells stretched,the nuclei were round and light blue,and the number of cells dyed by PI into red was reduced. The MTT results showed that the survial rate of cells in GP group was obviously higher than that in model group (Plt;0.05 orPlt;0.01).There was no significant difference in the survival rate of cells between GP medicated serum group and model group (except 5% GP medicated serum group,Pgt;0.05). The activity of NOS and level of NO in culture supernatant in GP group were significantly lower than those in model group (Plt;0.05 orPlt;0.01). The apoptotic rates of cells in GP group and GP medicated serum group were obviously lower than that in model group detected by Hoechst 33342/PI method(Plt;0.05 orPlt;0.01). There was no significant differences of the necrotic rates of neurons between GP group, GP medicated group and model group(Pgt;0.05).ConclusionGP protein has the neuroprotective effect,and its mechanism is related to the reduction of the activity of NOS and the level of NO and the inhibition of apoptosis of neurons.
ginseng protein;serum;neuron;amyloid-β protein;apoptosis
1671-587Ⅹ(2013)06-1138-05
10.7694/jldxyxb20130611
2013-04-07
中国博士后基金资助课题(2013M530945);辽宁省科技厅科研项目资助课题(2008226011-1)
李红艳(1982-),女,内蒙古自治区赤峰市人,讲师,中药学博士,主要从事中药药理学研究。
康廷国(Tel:0411-87586078,E-mail:kangtg@126.com);
R961
A

