首发青年抑郁症患者海马磁共振波谱与记忆功能的相关性研究
刘微波,禹华良,蒋飚,郑磊磊,俞少华,潘冰,余日胜
(浙江大学医学院附属第二医院,浙江杭州 310009)
抑郁症是一种具有高患病率、高自杀率和高复发率特点的精神疾病,疾病所致的认知损害严重影响患者的记忆水平及社会功能[1-2]。海马脑区是参与情绪调节的颞边缘系统-额叶-皮层下结构的组成部分,在抑郁症发病机制中起着重要的作用[3]。质子磁共振波谱分析(Proton magnetic resonance spectroscope,1H-MRS)是一种无创性活体检测脑组织神经生化代谢的脑功能影像技术,为抑郁症认知功能研究提供了新方法[4]。本研究旨在通过1H-MRS与神经心理学评定相结合的方法,探讨首发青年抑郁症患者的海马脑区神经生化代谢物变化情况及其与记忆功能的关系,探索抑郁症患者记忆障碍的病理生理机制。
1 材料和方法
1.1 研究对象
1.1.1 患者组 首次发作的青年抑郁症患者,年龄18~36周岁,符合国际疾病分类第l0版(ICD-10)精神与行为障碍分类中抑郁发作的诊断标准(F32)[5],汉密尔顿抑郁量表 (The Hamilton rating scale for depression,HAMD)17项评定总分大于17分,就诊时主诉存在记忆力减退的现象。能够理解并配合检查;排除严重躯体疾病、脑器质性疾病、精神发育迟滞、酒精及精神活性物质滥用史,听力障碍者,患者病前无记忆障碍的症状,未接受过电休克治疗。共入组20例,其中女性12例,男性8例;年龄平均(26.1 ±5.23)岁;平均病程(2.73 ±1.06)月;初中以上文化程度,平均受教育年限(12.8±1.61)年。
1.1.2 对照组 健康志愿者,同期从医学院学生、医院职工和志愿者中招募,年龄18~36周岁,HAMD17项评定总分小于7分,既往无心、脑、肺、肝、肾疾病史及精神疾病史,无精神发育迟滞、酒精和精神活性物质滥用史及听力障碍和记忆障碍者;共入组15例,其中女性9例,男性6例;年龄平均(27.47 ±6.05)岁;初中以上文化程度,平均受教育年限(12.07±1.79)年。
患者组和对照组均为右利手,在年龄、性别构成、文化程度方面比较,差异无统计学意义(P>0.05)。研究开始前获得受试者知情同意。
1.2 研究方法
1.2.1 抑郁症状学评定 两组受试者入组后,即由2名精神科主治医师采用HAMD17项对受试者的抑郁症状进行心理学评定(测试前经过一致性培训,Kappa值>0.84)。HAMD是临床上评定抑郁状态时应用最普遍的量表,HAMD17项版本的结果判断:总分大于17分为有肯定的抑郁,小于7分为无抑郁症状[6]。
1.2.2 认知心理学评定 两组受试者在一独立、安静房间内,由1名专职心理测验员采用韦氏记忆量表(Wechsler Memory Scale,WMS)对受试者进行记忆功能评定。WMS包括10项分测验:顺数、倒数、积累、再认、记图、再生、联想、触摸、理解、背数;1~3项分测验为长时记忆的测定,4~9项分测验为短时记忆的测定,第10项分测验为瞬时记忆的测定。每一分测验的原始分相加,根据受试者的年龄和全量表分,查得相应的记忆商数(Memory quotient,MQ)。MQ的得分及结果判断为:130分以上为极超常,120~129分为超常,110~119分为高于平常,90~109分为平常,80~89分为低于平常,70~79分为临界,69分以下为记忆缺损[7]。
1.2.3 质子磁共振波谱分析(Proton magnetic resonance spectroscope,1H-MRS) 采用 3.0-Tesla磁共振扫描仪(美国GE公司),在医院放射科磁共振检查室,对两组受试者进行头颅MRS检查。受试者平躺于检查床,将受试者头部固定于舒适的位置减少运动造成的伪影,先行头颅磁共振平扫检查,再利用空间定位技术,根据神经解剖图谱的定义和描述,选取双侧海马对称部位相同容量的兴趣范围区域进行扫描;检查时尽量保持均匀主磁场,并运用水抑制技术减少干扰,信号经软件处理后转换为数据和图像,用生产商随仪器提供的软件,测量相关神经生化代谢物(N-乙酰天门冬氨酸(N-acetylaspartate,NAA)、胆碱复合物 (Choline,Cho)、肌酸(Creatine,Cr)、肌醇(Myoinositol,mI))的峰下面积,该值以百万单位(ppm)来表示。应用Cr作为对照的内标准,并计算 NAA/Cr、Cho/Cr、mI/Cr的比值。
1.3 统计学分析 所有数据均采用SPSS 16.0统计软件包进行统计处理,结果以的形式表示,组间性别差异的比较采用卡方检验,其余各参数比较采用独立样本t检验,组内各参数比较采用pearson等级相关方法。P<0.05为差异有统计学意义。
2 结果
2.1 两组受试者HAMD评分结果 患者组HAMD17项评分分值平均(24.45 ±2.7),提示患者组的抑郁症状明确;对照组HAMD17项评分分值平均为2.6±1.8,提示无抑郁症状。
2.2 两组受试者WMS的测评结果 患者组的记忆商数(MQ)明显低于对照组(P<0.01),在积累、再认、再生、联想、触摸和背数的分测验方面,分值较对照组相比差异有显著统计学意义(P<0.05~0.01)。显示涉及记忆功能三方面的指标:长时记忆、短时记忆和瞬时记忆均有下降的现象。患者组与对照组WMS的结果比较,见表1。
表1 患者组与对照组WMS测定结果的比较(,分)Table 1 Comparision of the scores of WMS between patients group and control group
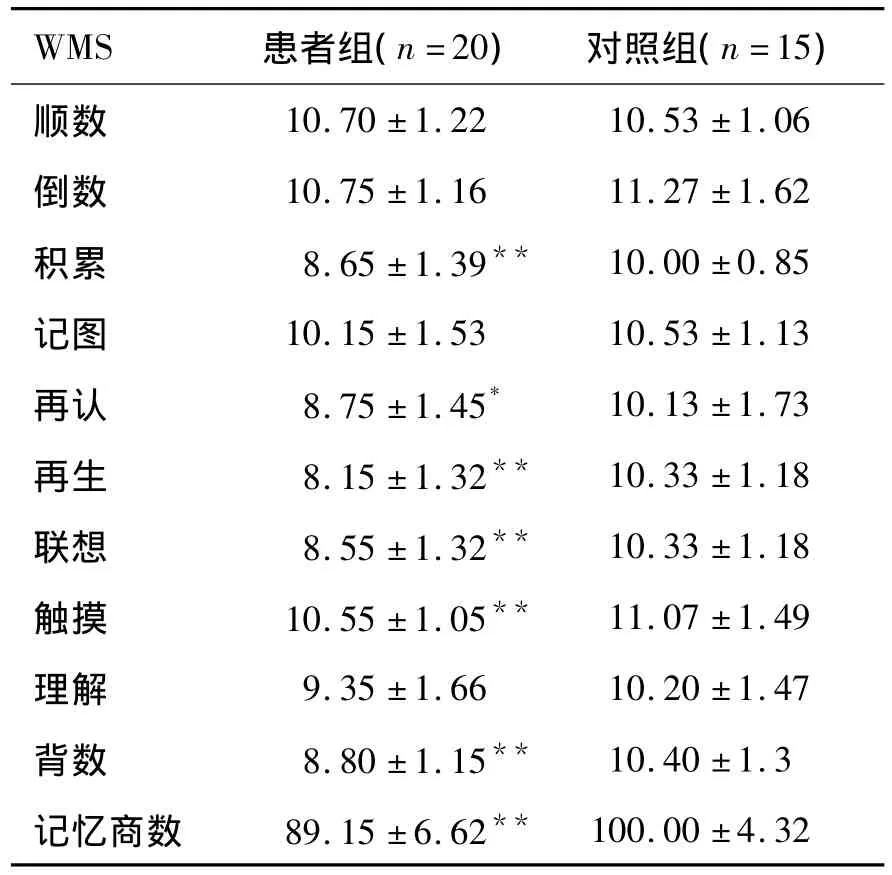
表1 患者组与对照组WMS测定结果的比较(,分)Table 1 Comparision of the scores of WMS between patients group and control group
与对照组比较,*:P <0.05,**:P <0.01.
WMS 患者组(n=20) 对照组(n=15)10.70 ±1.22 10.53 ±1.06倒数 10.75 ±1.16 11.27 ±1.62积累 8.65 ±1.39** 10.00 ±0.85记图 10.15 ±1.53 10.53 ±1.13再认 8.75 ±1.45* 10.13 ±1.73再生 8.15 ±1.32** 10.33 ±1.18联想 8.55 ±1.32** 10.33 ±1.18触摸 10.55 ±1.05** 11.07 ±1.49理解 9.35 ±1.66 10.20 ±1.47背数 8.80 ±1.15** 10.40 ±1.3记忆商数 89.15 ±6.62**顺数100.00 ±4.32
2.3 两组受试者海马脑区1H-MRS检查的结果 两组受试者完成1H-MRS检查后,获得双侧海马脑区神经生化代谢物NAA/Cr、Cho/Cr、mI/Cr的比值。大脑感兴趣区域双侧海马脑区的选取部位,见图1。比较发现,患者组左侧海马NAA/Cr比值较对照组明显降低,差异有显著统计学意义(P<0.01),双侧海马 mI/Cr比值较对照组均有增高,差异有统计学意义(P<0.05),而右侧海马的 NAA/Cr比值、双侧海马的Cho/Cr比值与对照组比较,差异无统计学意义(P>0.05)。患者组与对照组海马1H-MRS检查结果的比较,见表2。
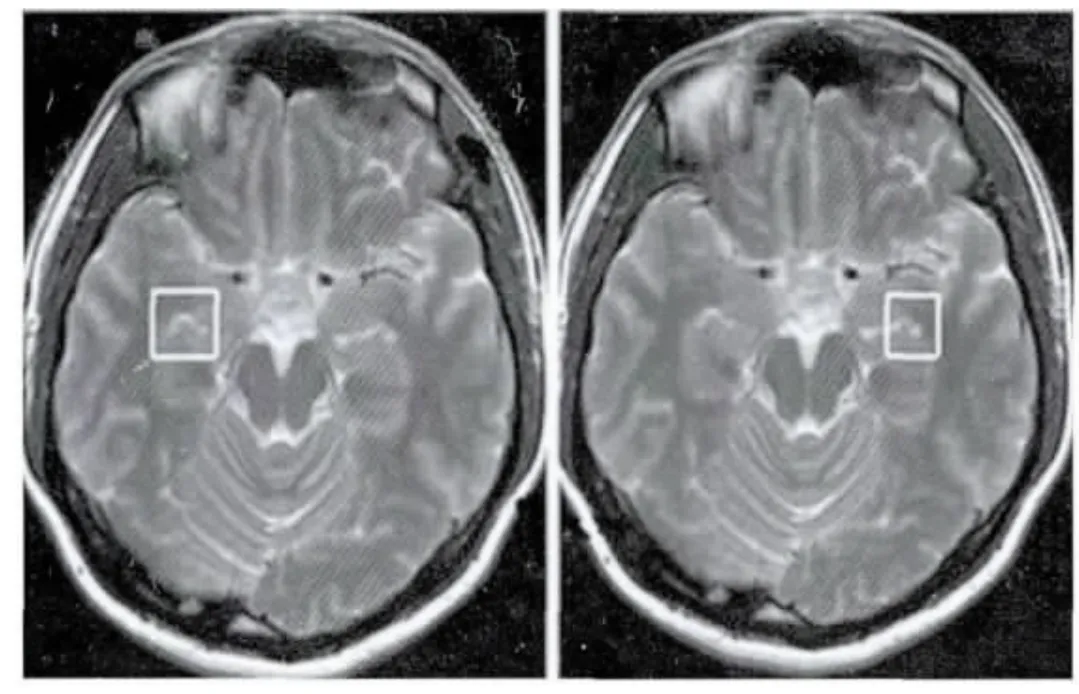
图1 头颅1 H-MRS双侧海马脑区的选取部位Fig.1 Sample of brain T2-weighted axial1 H-MRS image showing the location of the voxel in the bilateral hippocampus
2.4 患者组1H-MRS检查指标与WMS分值进行相关性分析显示,患者组双侧NAA/Cr比值与WMS部分分值呈一定程度的正相关,尤其以左侧NAA/Cr与MQ、再生分值呈显著正相关(r值分别为 0.592 和 0.75,P <0.01);左侧mI/Cr比值与MQ呈一定程度的负相关(r值为 -0.531,P <0.05)。而双侧Cho/Cr及右侧mI/Cr的比值与WMS的MQ和各因子分无相关性(P>0.05)。患者组1H-MRS检查结果与WMS的MQ及部分测验分值的相关性比较,见表3。
表2 患者组与对照组海马1 H-MRS检查结果的比较()Table 2 Comparision of the NAA/Cr,Cho/Cr,mI/Cr in hippocampus between patient group and control group
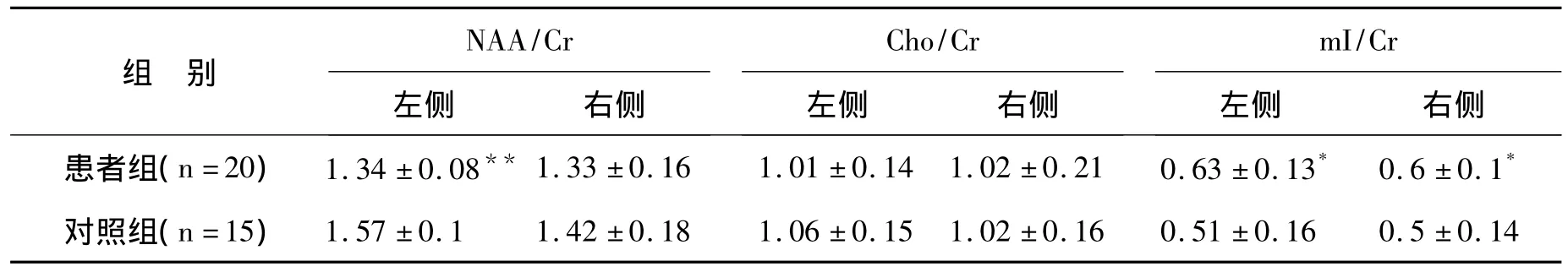
表2 患者组与对照组海马1 H-MRS检查结果的比较()Table 2 Comparision of the NAA/Cr,Cho/Cr,mI/Cr in hippocampus between patient group and control group
与对照组比较,*:P <0.05,**:P <0.01.
NAA/Cr Cho/Cr mI/Cr组 别左侧 右侧患者组(n=20) 1.34 ±0.08** 1.33 ±0.16 1.01 ±0.14 1.02 ±0.21 0.63 ±0.13* 0.6 ±0.1左侧 右侧 左侧 右侧*对照组(n=15) 1.57 ±0.1 1.42 ±0.18 1.06 ±0.15 1.02 ±0.16 0.51±0.16 0.5 ±0.14
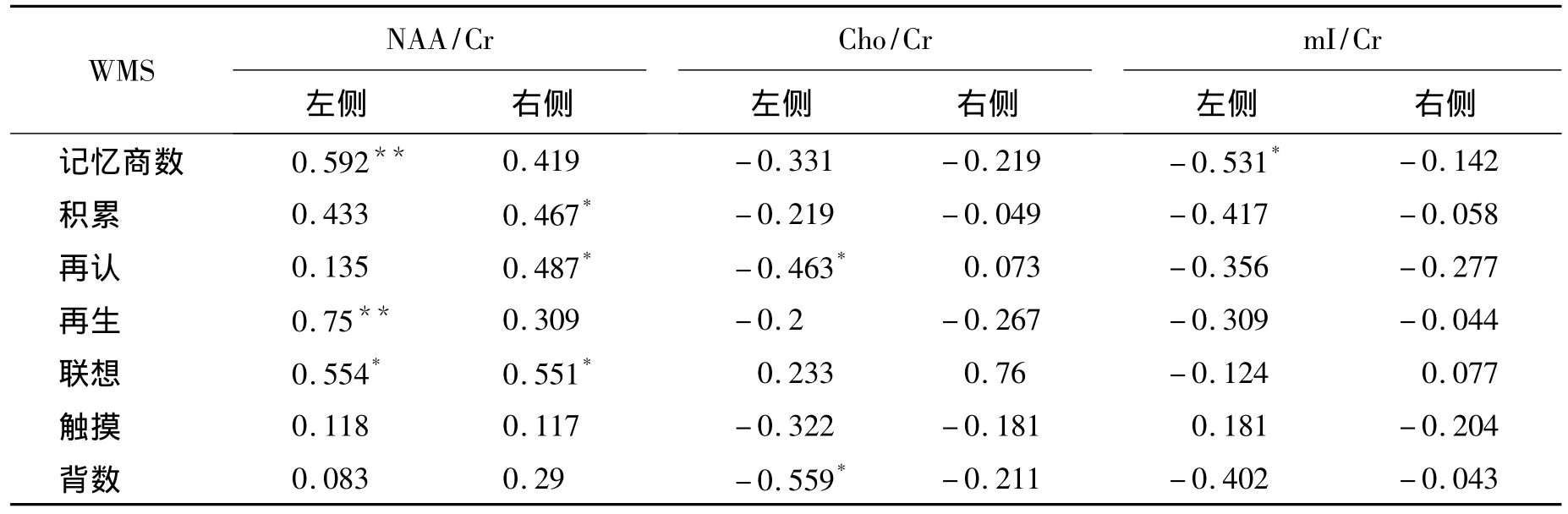
表3 患者组1 H-MRS检查结果与WMS分值的相关性比较(r值)Table 3 Correlation between the 1 H-MRS and WMS scores in patient group
3 讨论
抑郁症临床表现主要为情绪低落和相应的认知行为改变,其认知功能变化的特点为注意力减退、记忆力下降、思维迟缓、反应能力低下等,其中记忆力下降对患者社会功能和痛苦体验的影响最为突出。本研究选取的患者为首发青年患者,经过HAMD17项测评显示抑郁症状典型,同时存在记忆障碍的主观体验,因此能够为抑郁症记忆障碍的脑基础研究提供良好的研究对象。
近年来的研究提示,抑郁症的认知功能障碍可能独立于情绪症状之外,是疾病严重程度和治疗预后的重要相关因素[8-9]。记忆是衡量认知功能的重要指标,Veiel[10]通过荟萃分析揭示了抑郁症患者的认知障碍是脑功能的全面损害,主要体现为以记忆障碍为特征的颞叶损害和以执行功能障碍为特征的额叶损害。本研究通过WMS的神经心理评估,发现首发青年抑郁症患者与对照组相比,记忆功能呈现全面减退现象,记忆总水平及各种记忆功能包括长时记忆(积累)、短时记忆的各个方面(再认、再生、联想、触摸)和瞬时记忆(背数)均明显受损。抑郁症表现的明显记忆减退现象在临床上被称为“抑郁性假性痴呆”,研究提示抑郁症的记忆障碍是不同于神经组织退化性痴呆的一种脑功能性障碍[11];Harvey 等[12]的研究发现,青年抑郁症患者更易显现出广泛的工作记忆损害,这可能预示了患者对于药物治疗缺乏反应,从而更易发展成为难治性抑郁症。因此提示对于首发青年抑郁症患者存在的记忆障碍,可能需要从神经心理学和神经生理机制两方面进行研究。
记忆是大脑将接受的新信息进行组织,并与既往有关痕迹进行联系的过程;如果负责组织和联系的脑区发生障碍,会直接影响记忆功能。目前,与抑郁情绪和认知功能相关的神经解剖学异常发现主要集中于边缘系统,海马是边缘系统的主要结构,参与连续的记忆过程和长时程记忆的巩固[13]。研究发现,随着抑郁症病程的延续,海马结构异常现象逐渐明显,海马萎缩是抑郁症发病和预后的关键机制;而对于首发抑郁症患者,海马结构变化可能相对不明显,但存在着海马功能的改变[14-15]。本研究1HMRS检查结果显示,首发青年抑郁症患者海马神经生化代谢物与对照组比较存在异常,主要为左侧海马NAA/Cr比值明显低于正常,双侧海马mI/Cr比值高于正常;与国内外研究报道类似[14,16]。由于脑内 NAA 主要存在于神经元及轴索中,与神经元发育及髓鞘形成有关,是代表神经功能完整性的标记物,NAA降低的程度可以反映神经元功能受损的情况[4,16];因此,患者组NAA/Cr的显著降低提示,首发青年抑郁症可能存在左侧海马区神经元或轴突丧失和神经功能紊乱。因为mI存在于神经胶质细胞中,是胶质细胞的标记物[14];因此患者组mI/Cr的增高提示,首发青年抑郁症可能存在双侧海马区神经胶质细胞的增生活跃。Cho是细胞膜磷脂代谢的中间产物,反映细胞膜的更新状况[4];国外研究发现,复发性抑郁症存在Cho/Cr增高和海马体积减少而首发者未见上述变化,推测与反复应激和病程慢性化相关[14]。本研究未发现Cho/Cr与对照组的统计学差异,考虑可能与首发患者对Cho影响相对较少有关。文献中关于抑郁症患者神经生化代谢物质与记忆障碍相互关系的研究不多。本研究从1HMRS与WMS之间相关性分析结果看,主要以左侧海马神经代谢物指标NAA/Cr和mI/Cr的异常与记忆减退程度存在显著相关性。研究发现记忆障碍与左侧海马脑区存在关联现象,提示与抑郁相关的记忆障碍可能存在大脑两侧半球的功能偏侧化现象,推测首发青年患者的记忆障碍更倾向于左侧海马脑区功能受损所致。海马脑区NAA的低水平可能存在神经髓鞘形成和维持障碍,而mI的高水平可能存在神经胶质细胞密度的增加,两者均可能影响记忆相关的神经传导速度,从而干扰记忆活动[2,13]。因此推测左侧海马NAA/Cr比值降低与mI/Cr比值增高偏离正常对照范围越明显,可能预示着疾病的记忆功能缺损情况越严重。
本研究利用WMS的神经心理学评定和海马脑区1H-MRS的脑功能影像学检查相结合的方法,能够比较客观地评估首发青年抑郁症患者的记忆功能。研究提示首发青年抑郁症患者存在记忆障碍,海马脑区异常的神经生化代谢物与记忆障碍之间存在一定程度的相关性,推测首发青年抑郁症可能在疾病初期存在局部神经细胞代谢功能障碍,考虑记忆障碍的病理生理机制可能与左侧海马NAA/Cr降低和mI/Cr增高相关。NAA/Cr和mI/Cr是否可能作为首发青年抑郁症记忆障碍的生物学标记,有待今后扩大样本量以及通过临床抗抑郁治疗前后对比的方法来进行进一步研究。
[1]DEN HARTOG H M,DERIX M M,VAN BEMMEL A L,et al.Cognitive functioning in young and middle—aged unmedicated outpatients with major depression:testing the effort and cognitive speed hypotheses[J].Psychol Med,2003,33:1443-1451.
[2]SU Hui,JIANG Kai-da,XU Yi-feng,et al(苏 晖,江开达,徐一峰,等).The cognition function in first-episode patients with major depressive disorder[J].Chin J Psychiatry(中华精神科杂志),2005,38(3):146-149.(in Chinese)
[3]CAMPBELL S,MACQUEEN G.The role of the hippocampus in the pathophysiology of major depression [J].Journal of psychiatry &Neuroscience,2004,29:417-426.
[4]RAO N P, VENKATASUBRAMANIAN G,GANGADHAR B N.Proton magnetic resonance spectroscopy in depression [J].Indian J Psychiatry,2011,53(4):307-311.
[5]FAN Xiaodong,WANG Xiangdong,YU Xin(范肖冬,汪 向 东,于 欣,译).The ICD-10 Classification of Mental and Behavioural Disorders(ICD-10精神与行为障碍分类)[M].Beijing:People's Medical Publishing House,1993:72-78.(in Chinese)
[6]ZHANG Mingyuan(张 明 园).The manual of Psychiatric rating scale(精神科评定量表手册)[M].Changsha:Hunan Medical University Press,1998.(in Chinese)
[7]GONG Yaoxian,JIANG Dawei,DENG Junlin,et al(龚耀先,江达威,邓君林,等).The Revision Handbook of Wechsler Memory Scale(修订韦氏记忆量表手册)[M].Changsha:Hunan MedicalUniversity Press,1989.(in Chinese)
[8]XU Ye,CHEN Jindong,GUAN Xiaofeng(徐 晔,陈晋东,关晓峰).Comparison of memory function between first-episode and recurrent depressive patients[J].J Clin Res(医学临床研究),2008,25(11):1952-1954.(in Chinese)
[9]ŠOŠTARIČ M,ZALAR B.The overlap of cognitive impairment in depression and schizophrenia:a comparative study [J].Psychiatria Danubina,2011,23(3):251-256.
[10]VEIEL H. A preliminary profile of neuropsychological deficits associated with major depression [J].J Clin Exp Neuropsychol,1997,19(4):587-603.
[11]DOLAN R J,BENCH C J,BROWN R G,et al.Regional cerebral blood flow abnormalities in depressed patients with cognitive impairment[J].J Neurol Neurosurg Psychiatry,1992,55:768-773.
[12]HARVEY P O,LE BASTARD G,POCHON J B,et al.Executive functions and updating of the contents of working memory in unipolar depression[J].J psychiatr Res,2004,38(6):567-576.
[13]SWEATT J D.Hippocampal function in cognition[J].Psychopharmacology,2004,174:99-110.
[14]MILNE A,MACQUEEN G M,YUCEL K,et al.Hippocampal metabolic abnormalities at first onset and with recurrent episodes of a major depressive disorder:A proton magnetic resonance spectroscopy study[J].NeuroImage,2009,47:36-41.
[15]BLOCK W,TR BER F,VON WIDDERN O,et al.Proton MR spectroscopy of the hippocampus at 3T in patients with unipolar major depressive disorder:correlates and predictors of treatment response [J].Int J Neuropsychopharmacol,2009,12(3):415-422.
[16]LI Jin,KUANG Weihong,ZOU Ke,et al(李 进,况伟 宏,邹 可,等).A proton magnetic spectroscopy research on hippocampus metabolisms in people with suicide-attempted depressions[J].J Sichuan Univ:Med Sci Edi(四川大学学报:医学版),2009,40(1):59-62.(in Chinese)

