肥胖儿童青少年非酒精性脂肪肝病早期肾功能状况研究
林 胡,傅君芬,陈雪峰,黄 轲,吴 蔚,梁 黎,2
(1.浙江大学医学院附属儿童医院内分泌科、2.浙江大学医学院附属第一医院儿科,浙江 杭州, 310003)
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是指除外过量饮酒和其他明确的损肝因素所致的肝细胞内脂肪沉积,包括从单纯的肝脂肪变性到非酒精性脂肪肝炎(nonalcoholic steatohepatitism,NASH),以致一部分最终发展为肝硬化,甚至演变为肝细胞癌。代谢综合征(metabolic syndrome,MS)是以肥胖、高血糖、血脂异常以及高血压等集结发病的一种临床综合征。胰岛素抵抗(IR)在NAFLD以及MS发病和进展中均起着重要作用,目前多数研究者认为NAFLD是代谢综合征(MS)的肝脏表现[1-4]。慢性肾脏病(CKD)是一个全球性的健康问题,CKD有许多潜在的原因,越来越多的研究显示,高血压、糖尿病、肥胖和血脂异常,同 CKD的发生和发展有着密切的联系[5]。随着NAFLD在肥胖儿童中的患病率越来越高,其同CKD的相关性也越来越受到重视。众多研究显示,成人NAFLD患者CKD的发病率增加[6-13]。而儿童时期NAFLD引起的肾脏损害常是成人CKD的潜在因素,故识别早期的肾功能损害并加以干预显得尤为重要。但迄今为止,国外对于NAFLD及CKD的相关性研究多局限在CKD发病之后,对于其早期识别及预防帮助甚少,而国内对此方面的研究更是非常有限。尿微量白蛋白作为糖尿病肾病、高血压肾病等的早期肾脏受损的指标,可作为CKD的早期识别标志。本研究对386例肥胖患儿的a-1微球蛋白、尿微量白蛋白、尿免疫蛋白G以及尿分泌型IgA进行检测,探讨肥胖儿童NAFLD和MS,与早期肾功能损害之间的关系及影响机制,并进一步分析其相关因素,为临床上肥胖儿童CKD的预防和治疗提供理论依据。
1 对象和方法
1.1 研究对象 2009-2011年住院治疗的4~17岁肥胖儿童386例。纳入标准:体重指数(BMI)在2010年全国学生体质与健康调研报告同年龄同性别第95百分位以上[14],经各项检查排除了内分泌和遗传代谢疾病或药物引起的继发性肥胖患儿。根据肝脏有无病变分为2组:第1组为非酒精脂肪肝病组,即NAFLD组,共279例,占肥胖儿童的57.4%;其中男207例,女72 例,平均年龄(10.86 ±2.04)岁,平均BMI(28.11 ±3.84)kg/m2;第2 组单纯肥胖儿童为对照组,无肝脏 B超或肝功能异常,即OCWLD(Obese children without liver damage)组,共107例,其中男60例,女47例,平均年龄(9.38 ±2.68)岁,平均 BMI(26.17 ±3.40)kg/m2。我们对其中10岁以上234例肥胖儿童根据是否合并代谢综合征,再进一步分为MAFLD患儿合并 MS儿童,即 NAFLD+MS组,共92例,其中男73例,女19例,平均年龄(12.21±1.51)岁,平均 BMI(29.86 ± 4.50)kg/m2;NAFLD组98例,其中男81例,女17例,平均年龄(11.62 ± 1.25)岁,平均 BMI(27.95 ±3.02)kg/m2;对照组为单纯肥胖儿童,即OCWLD组,共44例,其中男29例,女15例,平均年龄(11.93 ±1.74)岁,平均 BMI(27.42 ±3.02)kg/m2。参照2010年2月修订的NAFLD诊疗指南设定的诊断标准[15],NAFLD指肝脏B超表现符合弥漫性脂肪肝诊断标准,同时排除常见肝炎病毒感染、药物性肝病、全胃肠外营养和自身免疫性肝病,及常见可能引起肝脂肪变性的代谢性疾病者,可伴有乏力、消化不良、肝区隐痛、肝脾肿大等症状和体征,伴或不伴有谷丙转氨酶(ALT)水平升高。代谢综合征的诊断标准参照2012年中国儿童青少年代谢综合征定义的探索及意义[16],即≥10岁儿童青少年,中心性肥胖:腰围≥同年龄同性别P95(临床上以腰围身高比(waist to-height ratio,WHtR)为快速识别指标,男童≥0.48,女童≥0.46),并同时具备至少下列2项:①高血糖,即空腹血糖受损(IFG),空腹血糖≥5.6 mmol/L;或糖耐量受损(IGT),口服葡萄糖耐量试验(OGTT)2 h血糖≥7.8 mmol/L 但 <11.1 mmol/L;或 2 型糖尿病(type 2 diabetes mellitus,T2DM)。②高血压:收缩压≥同年龄同性别P95,或舒张压≥同年龄同性别P95(临床上以收缩压≥130 mmHg,舒张压≥85 mmHg为快速识别标准)。③低高密度脂蛋白胆固醇[HDL-C<1.03 mmol/L(40 mg/dl)=或高非高密度脂蛋白胆固醇[non-HDL-C≥3.76 mmol/L(145 mg/dl)]。高甘油三酯[TG≥1.47 mmol/L(130 mg/dl)]。所有研究对象都无饮酒史。NAFLD组及对照组患儿的一般资料见表1。本次研究得到了浙江大学医学院附属儿童医院医学伦理委员会的批准,并得到参加研究的患儿和家长的知情同意。
1.2 方法 物理学指标测量:受检者脱鞋帽,穿单衣,测量身高、体重、腰围(髂前上棘与肋骨下缘中点的周径),分别精确到0.1 cm、0.1 kg、0.1 cm,并计算体质指数(BMI)及腰围身高比(WHtR)。血清及尿液的采集和制备:受检者禁食10 h后,于次日早晨8点测空腹血糖(FBG)、空腹胰岛素(FINS)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、甘油三酯(TG)、高密度脂蛋白(HLD)、非高密度脂蛋白(Non-HDL)等;并留取晨中断尿检测a-1微球蛋白、尿微量白蛋白、尿免疫蛋白G以及尿分泌型IgA;继而行口服葡萄糖耐量试验和胰岛素释放试验,检测30、120 min血糖和胰岛素。血浆葡萄糖测定采用葡萄糖氧化酶法,胰岛素测定采用化学发光法。计算稳态模型的胰岛素抵抗指数(HOMA-IR)和糖负荷后总体胰岛素敏感指数(WBISI)。HOMA-IR=空腹胰岛素(mU/L)×空腹血糖(mmol/L)/22.5。WBISI=10000/{[空腹胰岛素(mU/L)×空腹血糖(mg/dl)]×[平均胰岛素(mU/L)×平均血糖(mg/dl)]}1/2。肝脏B超检查:患儿空腹8~12 h后进行检查,采用GE公司LOGIC 500型超声诊断仪,探头频率3.5~5.0 MHz。脂肪肝B超表现:①肝区近场弥漫性点状高回声,回声强度高于脾脏和肾脏,少数表现为灶性高回声;②远处回声衰减,光点稀疏;③肝内管道结构显示不清;④肝脏轻度或中度肿大,肝前缘变钝。具备第①项加其余任1项以上者可确诊为脂肪肝。
1.3 统计学处理 采用SPSS 16.0软件分析。实验数据计量资料以均数±标准差()表示,组间均数的比较采用单因素方差分析(两两比较采用LSD法或非配对的t检验);相关性分析采用spearman相关性分析和多元线性回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 NAFLD组儿童及OCWLD各项指标比较结果 NAFLD组年龄较OCWLD组偏大,且收缩压(SBP)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、甘油三酯(TG)、∝-1微球蛋白、尿微量白蛋白、尿免疫蛋白、胰岛素抵抗指数均高于OCWLD组,高密度脂蛋白(HDL)及胰岛素敏感指数较OCWLD组降低,差异有统计学意义,P < 0.05。NAFLD 组 BMI、WHtR、舒张压(DP)、尿酸、胆固醇、非高密度脂蛋白、空腹血糖及2h餐后血糖较OCWLD组无明显统计学差异。见表1。
表1 NAFLD组和单纯肥胖组儿童各项指标比较Table 1 Clinical and laboratory data of NAFLD compared with OCWLD()
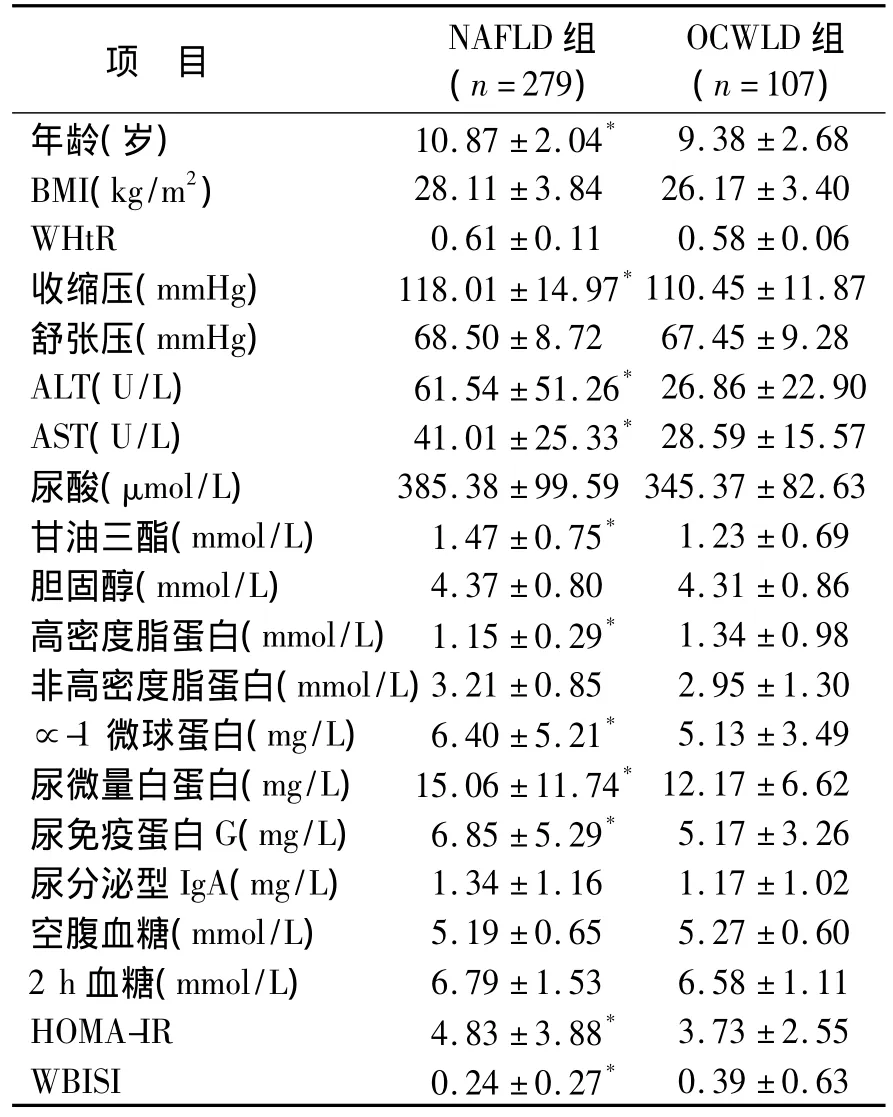
表1 NAFLD组和单纯肥胖组儿童各项指标比较Table 1 Clinical and laboratory data of NAFLD compared with OCWLD()
NAFLD组与OCWLD组比较,*:P<0.05.
2.2 大于10岁儿童中,NAFLD合并MS儿童与单纯肥胖儿童各项指标比较结果 根据MS诊断标准,将10岁以上患儿进一步分为单纯肥胖儿童组(OCWLD组)、NAFLD组以及NAFLD合并MS组,即 NAFLD+MS组,共3组;其中NAFLD+MS组 92例,NAFLD组 98例,OCWLD组44例,将各组各项指标进行比较显示,NAFLD+MS组较NAFLD组及OCWLD组BMI均偏大,且收缩压、丙氨酸转氨酶、甘油三酯、胆固醇、尿微量白蛋白、尿免疫蛋白、胰岛素抵抗指数均高于NAFLD组及OCWLD组,差异有统计学意义,P<0.05。NAFLD+MS组腰围身高比、天冬氨酸转氨酶、非高密度脂蛋白、∝-1微球蛋白、尿分泌型IgA均高于OCWLD组,差异有统计学意义,P<0.05,但同 NAFLD比较无明显统计学差异(P>0.05)。余指标无明显统计学差异。见表2。
2.3 尿微量白蛋白与NAFLD及MS各项指标相关性分析结果 根据上述分析结果,无论是NAFLD+MS组或是NAFLD组,尿微量白蛋白同OCWLD组比较均有显著性差异,故分析尿微量白蛋白与NAFLD及MS各项指标如BMI、WHtR、血压、糖脂代谢的spearman相关分析显示,尿微量白蛋白同BMI、WHtR、收缩压、甘油三脂、非高密度脂蛋白、餐后2 h血糖成正相关性,与高密度脂蛋白成负相关性,具有统计学意义,P <0.05;与 ALT、胆固醇、HOMA-IR 及WBISI无明显相关性。进一步根据上述分析结果对上述各项相关指标同尿微量白蛋白进行多元线性回归分析,将尿微量白蛋白身为因变量,逐步将BMI、WHtR、收缩压、舒张压、甘油三脂、HDL、非高密度脂蛋白、空腹血糖、餐后2 h血糖、HOMA-IR及WBISI纳入回归分析,排除变量 BMI、WHtR、舒张压、HDL、非高密度脂蛋白、空腹血糖、HOMA-IR及WBISI,最终表明尿微量白蛋白同收缩压、甘油三脂及餐后2 h血糖成显著正相关性。见表3及表4。
表2 年龄>10岁儿童NAFLD组、NAFLD+MS组和OCWLD组各项指标比较Table 2 Clinical and laboratory data of NAFLD+MS compared with NAFLD and OCWLD who are elder than 10 yaers()
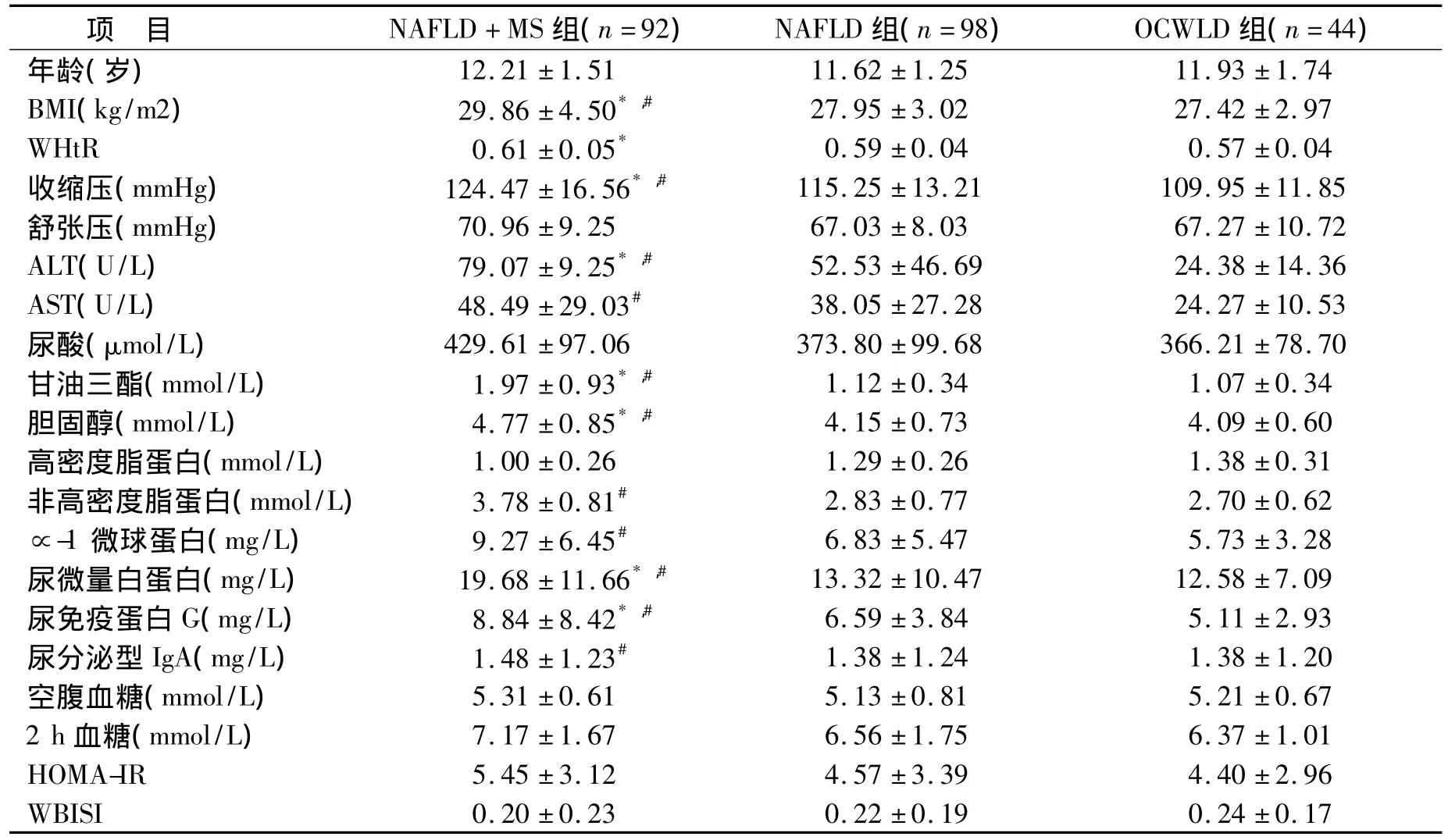
表2 年龄>10岁儿童NAFLD组、NAFLD+MS组和OCWLD组各项指标比较Table 2 Clinical and laboratory data of NAFLD+MS compared with NAFLD and OCWLD who are elder than 10 yaers()
NAFLD&MS组与 NAFLD 组比较,*:P<0.05;NAFLD&MS组与 OCWLD组对照,#:P<0.05.

表3 尿微量白蛋白与NAFLD及MS各项指标的spearman相关分析Table 3 Spearman correlation analysis between clinical and laboratory data of NAFLD+MS and microalbuminuria
3 讨论
NAFLD是一类除外酒精和其他明确的肝损因素所致的、以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征。它的范畴从单纯的脂肪变性到非酒精性脂肪性肝炎、肝纤维化和终末期肝病,是仅次于病毒性肝炎的常见肝病。其发病机制尚不清楚。最近提出的“多次打击学说”,把NAFLD归因于以甘油三酯沉积加胰岛素抵抗为基础的脂质过氧化、线粒体功能紊乱、氧化应激、炎症介质等多种因素打击的结果。也有认为NAFLD是儿童代谢综合征在肝脏的表现。随着儿童肥胖发病率的逐年增高,NAFLD的发病年龄也逐渐年轻化。流行病学调查发现,NAFLD在普通儿童中发病率约为3%左右,但在超重和肥胖儿童的患病率为12% ~80%[17],本研究中肥胖儿童 NAFLD的患病率高达57.4%,可见,NAFLD已成为严重威胁肥胖儿童身体健康的常见疾病。已有部分成人研究显示,NAFLD患者慢性肾病的发生率增加。Chang等[18]对8329个健康对象进行肝脏B超、生化指标检测及跟踪随访后发现,324人最终发展成了CKD,而这个过程同NAFLD密切相关。同样在NAFLD合并1型及2型糖尿病患者中,CKD的发生率也显著升高[6-7]。
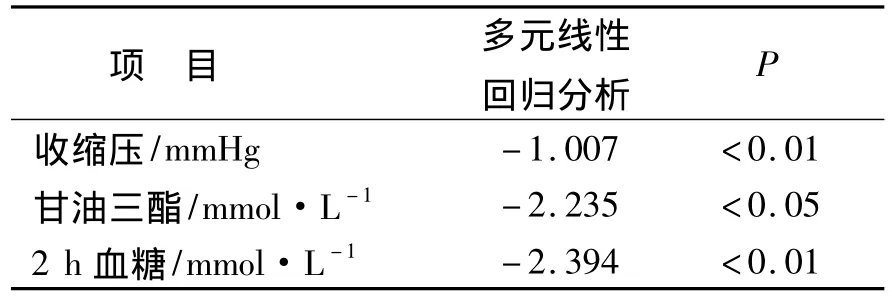
表4 尿微量白蛋白与NAFLD及MS各项指标的多元线性回归分析Table 4 Multiple linear regression analysis between clinical and laboratory data of NAFLD+MS and microalbuminuria
成人的研究均以肾小球滤过率(GFR)≤60 ml/min/1.73 m2定义慢性肾病,但肥胖儿童NAFLD肾脏损害常常处于早期,GFR未明显下降,故常用尿微量白蛋白来作为其早期肾功能损害的指标。本研究显示,NAFLD组年龄较单纯肥胖组∝-1微球蛋白、尿微量白蛋白、尿免疫蛋白、显著增高;且随着代谢异常的增加早期肾功能指标变化加剧。本研究还发现在10岁以上的肥胖儿童组,若NAFLD合并代谢综合征(MS),其尿微量白蛋白、尿免疫蛋白均显著高于NAFLD组及OCWLD组;与此同时,本研究通过spearman相关性分析及多元线性回归分析,得出尿微量白蛋白同收缩压、甘油三酯及餐后2h血糖成显著正相关,提示高血压、糖脂代谢异常等心血管危险因子既在NAFLD发生发展中起了关键作用,也是造成CKD的元凶。当肝脏脂肪大量堆积后,氧化应激反应增加,肝细胞能量代谢障碍,炎症细胞激活,炎症因子释放,激活NF-kB信号通路及JNK信号通路,引起全身炎症免疫紊乱,从而加重氧化应激,进而损伤肾脏。研究发现,一些炎症因子如IL-6、CRP、TNF-α、TGF-β、纤溶酶原激活物抑制物-1(PAI-1)、胎球蛋白-A(fetuin-A)、5-AMP 蛋白激酶(AMPK)等可能参与了这个过程[22-24]。部分动物实验也证实,慢性炎症反应、氧化应激增强及高凝状态在慢性肾病的发病过程中发挥重要作用[22-23,25],类似的结果得到 Melania Manco等[26]研究的证实。此外,也有研究发现,作为NAFLD发病基础的肝脏脂肪沉积、胰岛素抵抗在慢性肾病的发生发展过程中也同样发挥了重要作用[19-21]。本研究也发现,NAFLD组患儿较OCWLD组患儿具有较高的甘油三酯、胰岛素抵抗指数和更低胰岛素敏感指数。
因此,我们认为,脂质代谢异常引发胰岛素抵抗及慢性炎症反应、氧化应激是NAFLD引起早期肾功能损害的主要原因,但尚需大样本前瞻性随访研究进一步证实。综上分析,NAFLD与早期肾功能损害及慢性肾病之间有密切关系,肥胖儿童NAFLD的出现不仅仅是CKD发生的标志,甚至是CKD的早期预测指标。这提示儿科医师在当前儿童肥胖发生率不断攀高的严峻形势下,当患儿被诊断为NAFLD时,不仅应对其肝脏进行积极的治疗,更应该全面评估其发生CKD的危险性,以便更有效地预防患儿成年后CKD的发生。尿微量白蛋白检测相对简便、安全无创,可作为早期发现肾功能损害及慢性肾病的一个良好的预报方法。
[1]DE ALWIS NMW,DAY CP.Nonalcoholic fatty liver disease:the mist gradually Clears[J].J Hepatol,2008,48(Suppl 1):S104-S112.
[2]MARCHESINI G,MOSCATIELLO S,DI DOMIZIO S,et al.Obesity-associated liver disease[J].J Clin Endocrinol Metab,2008,93(Suppl 1):S74-S80.
[3]VUPPALANCHI R,CHALASANI N.Nonalcoholic fatty liver disease and nonalcoholic steatohepatitis:selected practical issues in their evaluation and management[J].Hepatology,2009,49:306-317.
[4]TARGHER G,DAY C P,BONORA E.Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease[J].N Engl J Med,2010,363:1341-1350.
[5]JAMES M T,HEMMELGARN B R,TONELLI M.Early recognition and prevention of chronic kidney disease[J].Lancet,2010,375:1296-1309.
[6]TARGHER G,BERTOLINI L,RODELLA S,et al.Nonalcoholic fatty liver disease is independently associated with an increased prevalence of chronic kidney disease and proliferative/laser-treated retinopathy in type 2 diabetic patients [J].Diabetologia,2008,51:444-450.
[7]TARGHER G,BERTOLINI L,CHONCHOL M,et al.Nonalcoholic fatty liver disease is independently associated with an increased prevalence of chronic kidney disease and retinopathy in type 1 diabetic patients[J].Diabetologia,2010,53:1341-1348.
[8]HWANG S T,CHO Y K,YUN J W,et al.Impact of NAFLD on microalbuminuria in patientswith prediabetes and diabetes[J].Intern Med J,2010,40:437-442.
[9]YILMAZ Y,ALAHDAB Y O,YONAL O,et al.Microalbuminuria in nondiabetic patients with nonalcoholic fatty liver disease:association with liver fibrosis[J].Metabolism,2010,59:1327-1330.
[10]MANCO M,CIAMPALINI P,DEVITO R,et al.Albuminuria and insulin resistance in children with biopsy proven non-alcoholic fatty liver disease[J].Pediatr Nephrol,2009,24:1211-1217.
[11]YASUIK,SUMIDA Y,MORIY,etal.Nonalcoholic steatohepatitis and increased risk of chronic kidney disease[J].Metabolism,2010,Sep 1 [Epub ahead of print].
[12]TARGHER G,CHONCHOL M,BERTOLINI L,et al.Relationship between kidney function and liver histology in subjects with nonalcoholic steatohepatitis[J].Clin J Am Soc Nephrol,2010,5:2166-2171.
[13]TARGHER G,CHONCHOL M,BERTOLINI L,et al.Increased risk of CKD among type 2 diabetics with nonalcoholic fatty liver disease[J].J Am Soc Nephrol,2008,19:1564-1570.
[14]THECHINESE STUDENTPHYSICALAND HEALTH RESEARCH GROUP(中国学生体质与健康研究组).Report on the physical fitness and health surveillance of chinese school students(2010)(2010年中国学生体质与健康调查报告)[M].Beijing:Higher Education Press,2012.(in Chinese)
[15]FATTY LIVER AND ALCOHOLIC LIVER DISEASE STUDY GROUP OF THE CHINESE LIVER DISEASE ASSOCIATION(中华医学会肝脏病学分会脂肪肝和酒精性肝病学组).Guidelines for diagnosis and treatment of nonalcoholic fatty liver diseases(2010)[J].Chinese Journal of Hepatology(中华肝脏病杂志),2010,18(3):163-166.(in Chinese)
[16]LIANG Li,FU Junfen,DU Junbao(梁 黎,傅君芬,杜军保).The explortion and significance of the definition of metabolic syndrome in chinese children and adolescents[J].Chinese Journal of Pediatrics(中华儿科杂志),2012,50(6):401-404.(in Chinese)
[17]C Ronny L H Cheung,et al.Non-alcoholic fatty liver disease in children [J].BMJ,2011,343:d4460 doi:10.1136/bmj.d4460.
[18]CHANGA Y,RYUB S,SUNGC E,etal.Nonalcoholic fatty liver disease predicts chronic kidney disease in nonhypertensive and nondiabetic Korean men [J].Metabolism Clinicaland Experimental,57(2008):569-576.
[19]WEINER D E,TIGHIOUART H,ELSAYED E F,et al.The relationship between nontraditional risk factors and outcomes in individuals with stage 3 to 4 CKD [J].Am J Kidney Dis,2008,51:212-223.
[20]KENDRICK J,CHONCHOL M B.Non-traditional risk factors for cardiovascular disease in patients with chronic kidney disease [J].Nat Clin Pract Nephrol Nephrol,2008,4:672-681.
[21]KRONENBERG F.Emergingriskfactorsand markers of chronic kidney disease progression[J].Nat Rev Nephrol,2009,5:677-689.
[22]MASSY Z A,STENVINKEL P,DRUEKE T B.The role of oxidative stress in chronic kidney disease[J].Semin Dial,2009,22:405-408.
[23]CARRERO J J,PARK S H,AXELSSON J,et al.Cytokines,atherogenesis,and hypercatabolism in chronic kidney disease:a dreadful triad [J].Semin Dial,2009,22:381-386.
[24]IX J H,SHARMA K.Mechanisms linking obesity,chronic kidney disease,and fatty liver disease:the roles of fetuin-A,adiponectin,and AMPK [J].J Am Soc Nephrol,2010,21:406-412.
[25]VLASSARA H,TORREGGIANI M,POST J B,et al.Role of oxidants/inflammation in declining renal function in chronic kidney disease and normal aging [J].Kidney Int,2009,114(Suppl):S3-S11.
[26]MANCO M,CIAMPALINI P,DEVITO R,et al.Albuminuria and insulin resistance in children with biopsy proven non-alcoholic fatty liver disease[J].Pediatr Nephrol,2009,24:1211-1217.

