燃烧法快速合成CuO/Cu2O及其光催化研究
李秀萍,赵荣祥,高肖汉
(辽宁石油化工大学 化学化工与环境学部,辽宁 抚顺 113001)
Cu2O是一种典型的金属缺位p型半导体,是少有的能被可见光激发的半导体材料,其禁带宽度约为2.0 eV.Cu2O无毒,制备成本低,可以直接利用太阳光将有机物降解,不产生二次污染物,理论利用效率较高,是一种极具开发前景的绿色环保催化剂之一.研究表明,目前铜的氧化物制备方法有浸渍法[1,2]、沉积法[3,4]和蒸发[5]等.有大量文献报道了氧化亚铜制备方法[6~9],也有文献报道通过负载和浸渍方法使铜的氧化物与其他载体进行复合作为催化剂[10~15],但 Cu2O/CuO复合氧化物催化剂还未见报道.实验采用抗坏血酸一种新型燃烧剂和还原剂,硝酸铜为氧化剂,低温燃烧法制备铜的氧化物和复合物,在加热过程中发生强烈的氧化还原反应,燃烧产生热量,可自我维持燃烧.这种方法合成路线简单、容易实现、合成时间短、无需煅烧和洗涤,即可制备出铜的不同氧化物.
1 实验部分
1.1 实验仪器及药品
1.1.1 实验仪器
紫外分光光度计(721型,天津精密仪器四厂),电磁搅拌器(D2004W,上海梅颖浦仪器仪表制造有限公司),可见灯(LZG2300-1000,飞利浦牌),XRD衍射仪(D/max-RB-12Kw转耙X射线衍射仪,日本理学),扫描电子显微镜(LEO型,德国LED公司),紫外扫描分光光度计(UV1100,上海天美科学仪器公司).
1.1.2 实验药品
Cu(NO3)2·3H2O(沈阳市试剂二厂),抗坏血酸C6H8O6(沈阳市试剂五厂),双氧水(沈阳化学试剂二厂),盐酸(济南市万隆化工有限公司),氢氧化钠(沈阳铭邦伟业化工有限公司),甲基蓝(天津金铂兰精细化工有限公司).
1.2 铜的氧化物制备
按照铜与抗坏血酸的摩尔比称取硝酸铜和抗坏血酸于烧杯中,加水溶解,溶液由蓝色变为浅黄色继而又变为黄绿色同时生成气泡,在电热套上加热,溶液变为深绿色.深绿色溶液中有红棕色的沉淀,待水分即将蒸发完毕,溶液变成黑色溶胶同时发泡,继续加热溶液发生燃烧伴有蓝色火焰和火星,最后得到黑色粉末状铜的氧化物.
1.3 铜的氧化物制备机理
根据实验现象可知反应过程为硝酸铜中二价铜离子被抗坏血酸还原为一价铜离子,一价铜离子部分被水中溶解的氧氧化为二价铜离子,二价铜的蓝色和一价铜的黄色混合为黄绿色,慢慢一价铜被氧化成二价铜的越来越多,溶液由黄绿色转变为深绿色.一价铜不稳定生成氧化亚铜红棕色沉淀,二价铜与剩余的抗坏血酸燃烧生成氧化铜,所以最后生成的氧化亚铜和氧化铜的复合物.剩余抗坏血酸的量决定铜的氧化物为氧化亚铜还是氧化铜.抗坏血酸的量少,被其还原的一价铜离子被水中氧全部氧化成二价铜离子,生成氧化铜;抗坏血酸的量增加被还原的铜一部分被水中的氧氧化成二价铜离子,生成氧化铜和氧化亚铜的复合物,若抗坏血酸足够,铜离子只有一价铜的形式,一价铜离子与抗坏血酸燃烧生成氧化亚铜.

1.4 铜的氧化物光催化实验
称取一定质量上述制备的铜的氧化物于烧杯中,用量筒量取甲基蓝溶液100 mL置于烧杯中.将配制好的溶液放在磁搅拌器上搅拌30 min,在可见光照射一定时间后,用离心机分离,测量吸光值,根据公式(4)计算甲基蓝的降解率.
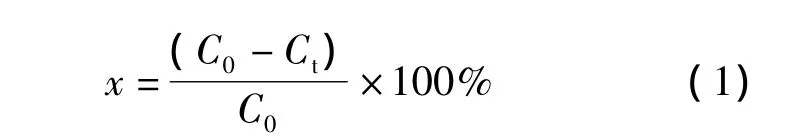
式中:C0和Ct分别为甲基蓝溶液的初始浓度和t时刻的浓度;

式中:A0与C0成正比;A0为浓度为C0的甲基蓝溶液的紫外吸光度;

式中:At与Ct成正比;At为浓度为Ct的甲基蓝溶液的紫外吸光度;
将方程式(2)、(3)代入方程式(1)经整理有方程式(4):

由方程(4)可知,降解率随着吸光值A的减小而增大,吸光值A越小降解率越高,所以本实验条件考察时就看条件发生改变时吸光值A如何变化,如果条件发生改变,吸光值A增大代表降解率降低,吸光值A减小代表降解率增大.实验条件考察时就是找最小的吸光值为最佳降解效果.本实验研究光照时间、催化剂用量、pH、H2O2使用对光催化效果的影响.
2 结果与讨论
2.1 铜的氧化物XRD 表征

图1 燃烧剂用量对复合物考察Fig.1 Effect of fuel agent on the composites*—氧化铜;Δ—氧化亚铜
图1为燃烧剂(抗坏血酸)用量考察,由图1可知铜与抗坏血酸的摩尔比在0.25、0.5时,其XRD图峰数较少,产物为氧化铜.摩尔比在1以上出现2θ角为42.4(°)新的峰值,1∶2以上出现2θ 为29.6(°),65.8(°)新的衍射峰,根据文献[1]的查阅与(JCPDS No.05-0667)可知新出现的峰属于立方晶系的氧化亚铜,随着燃烧剂用量的增大氧化亚铜的(111)、(200)、(220)晶面的峰增高.说明通过改变燃烧剂的用量可制备出不同含量的氧化亚铜和氧化铜的复合物.在燃烧剂与硝酸铜摩尔比为0.5∶1和0.25∶1时制备的是氧化铜,1∶1以上为氧化铜和氧化亚铜的复合物.这是由于燃烧剂抗坏血酸又是还原剂,当增加抗坏血酸的量,二价的铜被还原为一价的铜,所以产物为氧化亚铜和氧化铜的复合物.当抗坏血酸的量足够,可制备出氧化亚铜单体.
2.2 铜的氧化物的扫描电镜表征
由图2a可以看出当硝酸铜与抗坏血酸之比为1∶5时所生成氧化铜和氧化亚铜的复合物,其形貌为小的颗粒状,颗粒相互连接构成网状结构,颗粒比较分散.图2b硝酸铜与燃烧剂之比为1∶0.25时生成的是氧化铜,是粒径较大的块状结构.说明改变燃烧剂用量能制备出形貌不同、铜的不同氧化物.图2c是粒径较大的块状的氧化铜和氧化亚铜复合氧化物.图2d为粒径较小的氧化亚铜颗粒.
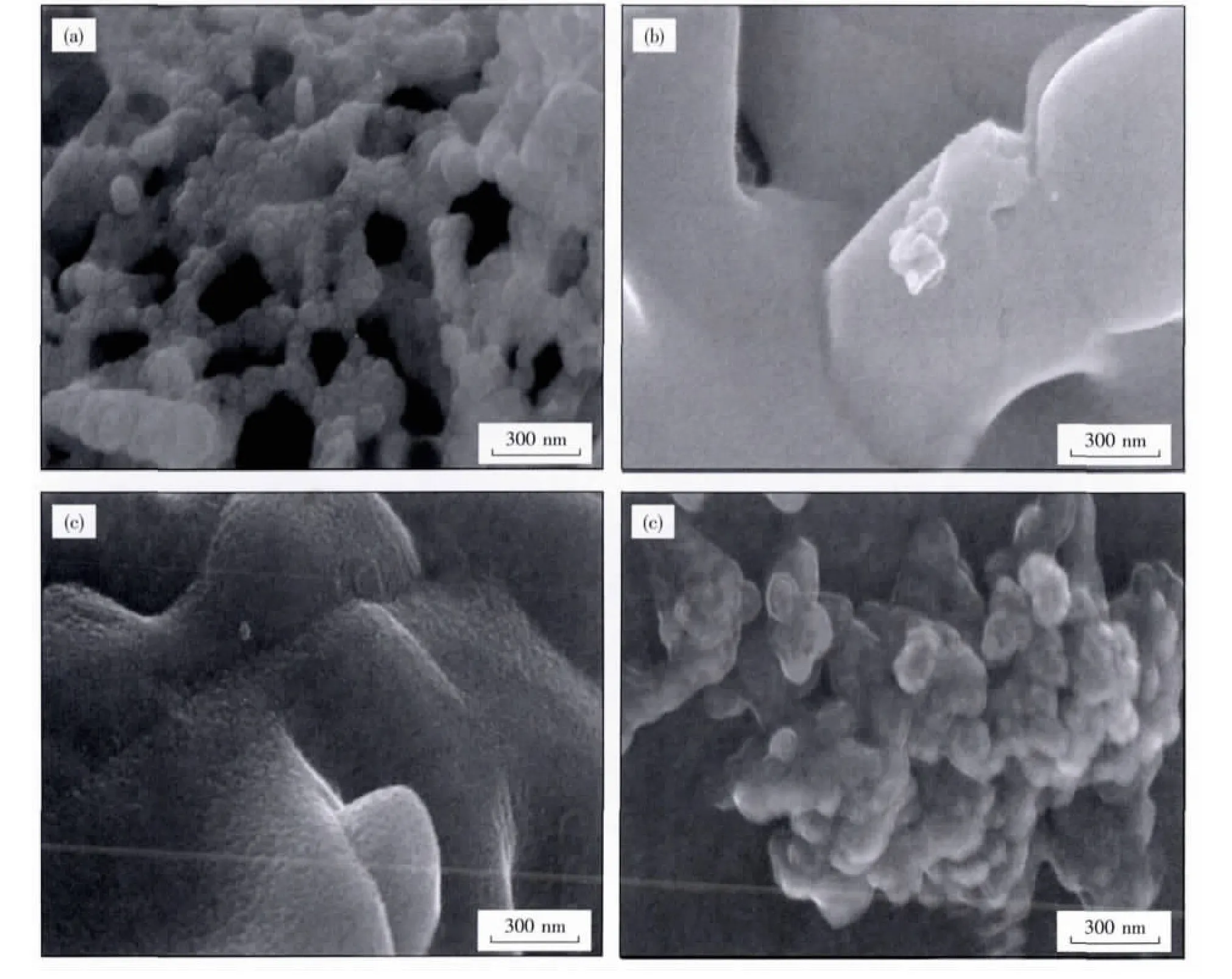
图2 Cu2O/CuO复合氧化物的扫描电镜Fig.2 SEM images of Cu2O/CuO Composites Oxide
2.3 铜的光催化研究
2.3.1 不同催化剂的考察
选择硝酸铜与抗坏血酸的摩尔比为1∶0.25,1∶1,1∶5,1∶10 四种催化剂按照实验方法 1.4 进行光催化实验,其结果见图3.由图3可以看出硝酸铜与抗坏血酸摩尔比为1∶10的样品光催化效果最佳,这可能是由实验选择的可见光造成的,而硝酸铜与抗坏血酸摩尔比为1∶10的样品为氧化亚铜,且此样品的氧化亚铜的(111)峰最强,有文献[16]报道氧化亚铜的(111)晶面是可见光催化效果最好的晶面.半导体基异质结界面和缺陷,可以促进光生电子和空穴,这些电子和空穴可有效提高光的催化反应.硝酸铜与抗坏血酸摩尔比为1∶5的样品为氧化亚铜和氧化铜的复合物.硝酸铜与抗坏血酸摩尔比为1∶0.25时为氧化铜,几乎没有光催化效果,本实验考虑到催化剂的分离、回收以及重复使用情况,选择硝酸铜与抗坏血酸摩尔比为1∶5的样品为氧化亚铜和氧化铜的复合物为光催化剂.

图3 不同催化剂对光催化效果的影响Fig.3 Effects of catalysts on the photo-catalysis
2.3.2 催化剂用量考察
图4是催化剂用量(即在100 mL甲基蓝溶液中加入催化剂的质量,mg)对光催化影响,由图可知,60 mg/100 mL甲基蓝溶液时,光催化80 min溶液的降解率最高,继续多加催化剂,催化效果不但没有改善,反而由于催化剂的量太大自身的颜色影响催化效果.
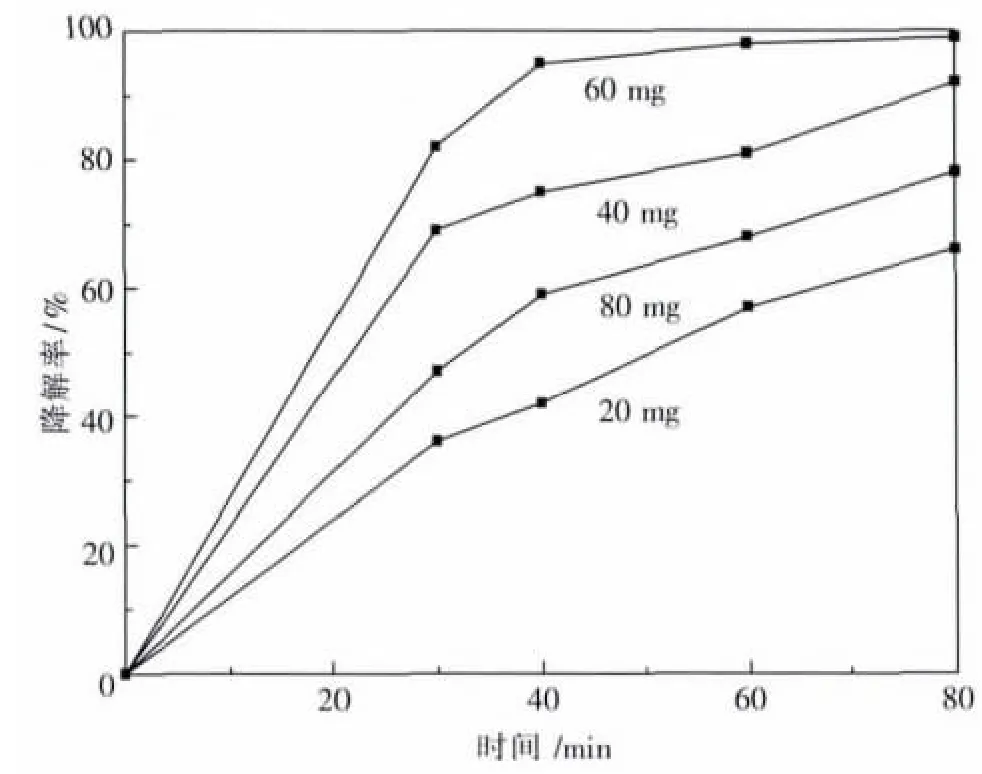
图4 催化剂用量对光催化影响Fig.4 Effects of amount of catalyst on the photo-catalysis
2.3.3 双氧水用量考察
图5双氧水用量对光催化性能的影响,由图5可以看出,加入光催化剂的质量均为60 mg的情况下,光催化100 mL甲基蓝溶液,加入双氧水和没加入双氧水的催化效果没有太大改变,说明双氧水对本实验的光催化没有起到促进作用.这可能是由于Cu+→Cu2+可以使催化剂具有储存和释放氧的能力,无需双氧水的促进作用.所以本实验不用加入双氧水来促进光催化的进行.

图5 双氧水用量对光催化性能的影响Fig.5 Effect of the amount of H2O2 on the photo-catalysis
2.3.4 pH值的影响
催化剂用量为60 mg加入到100 mL甲基蓝溶液中,加入盐酸或氢氧化钠改变溶液的pH,在不同的pH值下测定溶液的吸光度,计算溶液的降解率如图6所示.由图6可以看出,当溶液的pH为7时,在120 min时溶液的降解率最高,溶液本身即为中性,所以本实验不用另加盐酸或者氢氧化钠改变溶液的酸碱度.
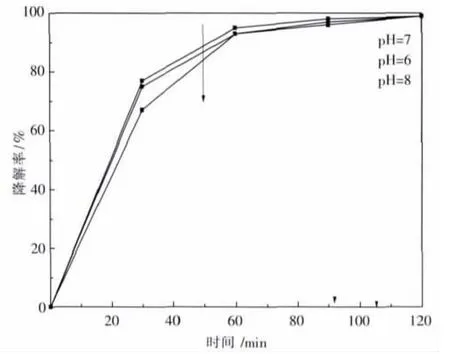
图6 pH值对光催化性能的影响Fig.6 Effect of pH value on the photo-catalysis
2.3.5 时间考察
按上述所得,在100 mL甲基蓝溶液中只加入60 mg的光催化剂,在不同的时间段用紫外扫描分光光度计进行扫描,其结果见图7,由图可知,氧化铜与氧化亚铜复合氧化物催化甲基蓝完全褪色的时间为90 min.

图7 时间对光催化的影响Fig.7 Effect of time on the photo-catalysis

图8 催化剂重复使用对光催化影响Fig.8 Effects of catalyst recycling times on the photo-catalysis
2.3.6 催化剂重复使用
在100 mL甲基蓝溶液中只加入60 mg的氧化亚铜或氧化铜和氧化亚铜复合氧化物为催化剂,进行催化剂重复使用考察,由图8可见氧化亚铜的光催化效果随着催化剂重复使用次数的增加,催化效果逐渐下降,而以氧化铜与氧化亚铜为催化剂的光催化效果稍有改变,且以氧化铜与氧化亚铜为催化剂回收效果好,几乎没有损失.而氧化亚铜粉末颗粒过于细小难于回收,这也是氧化亚铜光催化效果急剧降低的主要原因.
3 结论
(1)抗坏血酸既为燃烧剂又为还原剂,改变其用量可制备出铜的不同氧化物:氧化铜,氧化铜与氧化亚铜的复合物、氧化亚铜.
(2)不同的氧化物对光催化效果不同,氧化亚铜在可见光下催化效果较好.但氧化亚铜难于回收重复使用,氧化铜与氧化亚铜复合氧化物单次光催化效果不如氧化亚铜,两次以后光催化效果好于氧化亚铜.所以从回收和环保效果看氧化铜与氧化亚铜复合氧化物效果更好,氧化铜与氧化亚铜复合氧化物90 min可使溶液褪为无色,光催化完毕.
(3)以氧化铜和氧化亚铜为催化剂进行光催化无需加入任何试剂,只需加入催化剂即可,更加环保,无二次污染,且催化剂可回收、多次重复使用.
[1] Zhou Bo,Liu Zhiguo,Wang Hongxia.Visible photocatalytic activity of flowerlike Cu2O/Cu nanocomposites[J].Chmical Journal of Chinese Universities,2010,31(1):141 -144.
[2] Ren Linlin,Zeng Yuping,Jiang Dongliang.Preparation,characterization and photocatalytic activities of Ag-deposited porous TiO2sheets[J].Catalysis Communications,2009,10(5):645-649.
[3]Li F B,Li X Z.Photocatalytic properties of gold/gold ionmodified titanium dioxide for wastewater treatment[J].Appl Catal A:Gen,2002,228(1-2):15-27.
[4] Li Dongme, Xia Xi. Preparation ofnano phaseCuO composite powder and its electro - chemical behavior[J].Journal of Inorganie Materials,2001,16(11):1208 -1210.
[5]Arabatzis I M ,Stergiopoulos T ,Andreeva,et al D.Characterization and photocatalytic activity of Au/TiO2thin films for azo - dye degradation [J].Journal of Catalysis,2003,220(15):127-135.
[6]梅光军,师伟,解科峰,等.纳米氧化亚铜的制备及其光催化性能研究[J].资源环境与工程,2007,21(3):335-338.
(Mei Guangjun,Shi Wei,Xie Kefeng,et al.Preparation and performance of photocatalytic degradation of nano-sized cuprous oxide[J].Resources Environment& Engineering,2007,21(3):335 -338.)
[7]朱红飞,陈乾旺,牛和林.在酸性条件下合成氧化亚铜纳米立方体[J].无机化学学报,2004,20(10):1172-1176.
(Zhu Hongfei,Chen Qianwang,Niu Helin.Growth of cuprite nanocubes under acidic conditions[J].Chinese Journal of Inorganic Chemistry,2004,20(10):1172 -1176.)
[8]陈善亮,朱耿臣,应鹏展.纳米氧化亚铜电化学法制备及光催化研究进展[J].环境化学,2011,30(5):976-981.
(Chen Shanliang, Zhu Gengchen, Ying Pengzhan.Development of electrochemical preparation and photocatalytic chacterization of nano -Cu2O[J].Environmental Chemistry,2011,30(5):976 -981.)
[9]宋继梅,张小霞,焦剑.立方状和球状氧化亚铜的制备及其光催化性质[J].应用化学,2010,27(11):1328-1332.
(SongJimei, ZhangXiaoxia, Jiao Jian. Synthesis and photocatalytic properties of Cu2O microcubes and nanospheres[J].Chinese Journal of Applied Chemistry,2010,27(11):1328 -1332.)
[10]赵江红,刘振宇.载体炭对CuO/AC(F)催化-吸附剂干法催化氧化苯酚的影响[J].新型碳材料,2005,20(2):115-120.
(Zhao Jianghong,Liu Zhenyu.Effect of carbon upporton CuO/AC(F)catalyst-sorbentsused for catalytic dryoxidation of phenol[J].New Carbon Materials,2005,20(2):115-120.)
[11]王哲,赵曦,万海勤.焙烧温度对CuO在γ-Al2O3载体上的分散和催化CO完全氧化性能的影响[J].无机材料学报,2008,23(3):454-458.
(Wang Zhe,Zhao Xi,Wan Haiqin,et al.Influence of calcination temperature on the dispersion behavior and CO oxidation properties of CuO/γ - Al2O3catalyst[J].Chinese Journal of Inorganic Chemistry,2008,23(3):454 -458.)
[12]周晓龙,曹建春,陈敬超.Ag/CuO复合材料反应合成热力学分析[J].稀有金属材料与工程,2009,38(12):2111-2115.
(Zhou Xiaolong, CaoJianchun, Chen Jingchao, et al.Thermodynamics analysis for Ag/CuO composites by reactive synthesis[J].Rare Metal Materials and Engineering,2009,38(12):2111 -2115.)
[13]邓凡政,祝爱侠,杨睿.CuO/Cu2(OH)3Cl的制备及其光催化降解染料光谱性能研究[J].光谱学与光谱分析,2006,26(2):299-301.
(Deng Fanzheng,Zhu Aixia,Yang Ru.Study on preparation of CuO/Cu2(OH)3Cl powder and its spectrum behavior for photo- degradation decoloration of dyes[J].Spectroscopy and Spectral Analysis,2006,26(2):299 -301.)
[14]衡秋丽,肖峰,骆建敏.纳米CuO:不同形貌的制备及对高氯酸铵热分解催化性能[J].无机化学学报 ,2005,29(2):359-363.
(Heng Qiuli,Xiao Feng,Luo Jianmin. Nano - CuO:Preparation with different morphologies and catalytic performance for thermal decomposition of ammonium perchlorate [J].Chinese Journal of Inorganic Chemistry,2005,29(2):359 -363.)
[15] Zhu L Y,Chen Y,Sun Y,et al.Phase - manipulable synthesis of Cu-based nanomaterials using ionic liquid 1-butyl-3 - methyl- imidazole tetrafluoroborate[J].Cryst Res Technol,2010,4(45):398 -404.
[16]周波,刘志国,王红霞,等.花状Cu2O/Cu复合材料的光催化性能[J].高等学校化学学报,2010,31(1):141-144.
(Zhou Bo, Liu Zhiguo, Wang Hongxia, et al. Visible photocatalytic activity offlowerlike Cu2O/Cu nano -composites[J].Chemical Journal of Chinese Universities,2010,31(1):141-144.)

