禽类多瘤病毒APV-1的cDNA病毒突变体构建
李 劲,高 奎,李可可,刘 浏,刘学群
(中南民族大学生命科学学院,武汉430074)
禽类多瘤病毒(APV),早期称鹦鹉幼雏病病毒(BFDV),能引起多种鹦鹉雏鸟死亡的急性病毒性传染病,主要感染出壳1~3周的鹦鹉,死亡率高达80%,并感染其他多种鸟禽[1-3].在禽流感向全世界蔓延不断有死亡报道和人传人的可能性不断增高的情况下,禽类的人禽共患病和病原学正得到广泛研究.
对APV-1的晚期基因编码的前导蛋白Agno-1(1a 和1b)和 Agno-2(2a 和2b)[4-7]的结构和功能的研究发现:Agno-1a是一种病毒外壳蛋白VP4[8-9]并与Agno-1b一起导致鸡胚成纤维细胞的凋亡,其全基因组线性图见图1[10].APV-1晚期基因多顺反子mRNA中下游VP3基因的翻译以“Leaky Scanning”模式进行,即40S核糖体亚基-翻译起始复合物忽视上游VP1的mRNA起始位点并滑到下游VP3的mRNA起始位点,继而进行VP3蛋白的翻译.
本文为研究APV-1晚期基因多顺反子mRNA下游VP1基因的翻译调控机制,设计含AUG起始码的编码7个氨基酸的具有最佳翻译起始信号的核苷酸插入到agno-1a mRNA的上游(见图2),以观察其对agno-1a mRNA下游VP1翻译的影响.
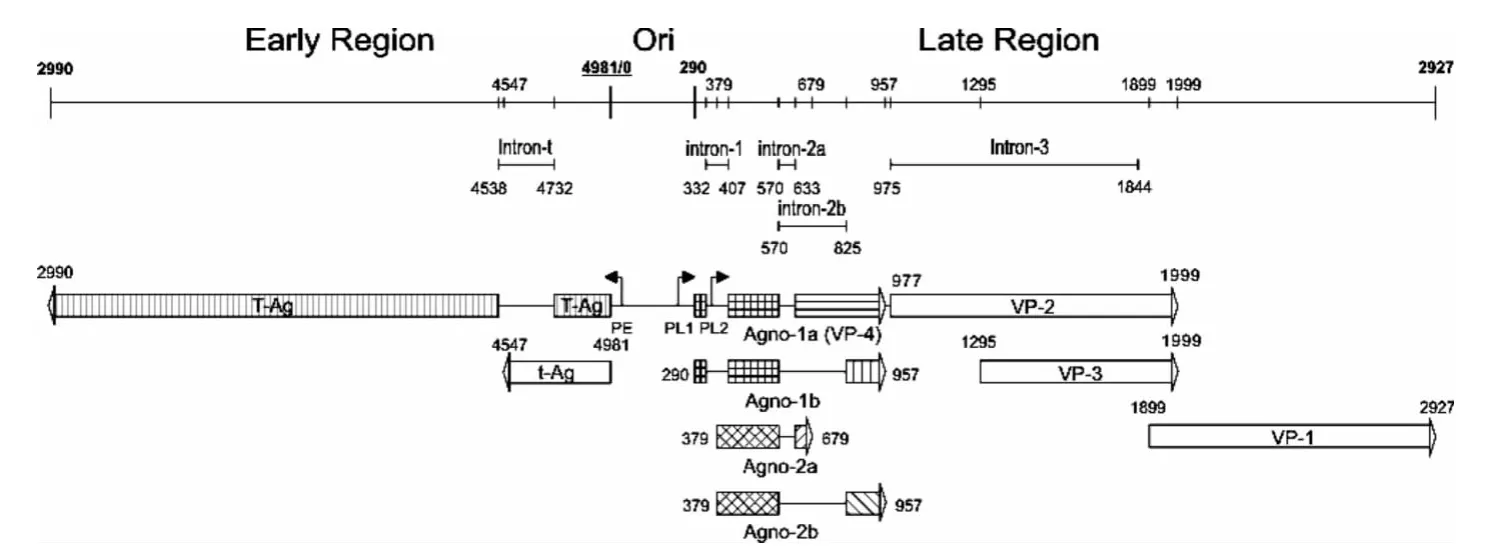
图1 禽类多瘤病毒全基因组线性图Fig.1 The genome map of Avian polyomavirus

图2 pHL1003 cDNA质粒插入APV-1 agno区片段示意图Fig.2 Schematic diagram of pHL1003 cDNA plasmid with inserts of APV-1 agno region
1 材料与方法
1.1 材料和试剂
pHL1003,APV-1的 cDNA质粒(见图3,ango区域只含agno-1a,除去intron-4而缺失小t基因,德国Giessen大学Gerd Hobom教授提供),大肠杆菌DH10b(武
汉大学生命科学学院),DNA Marker、ATP、Tag-DNA聚合酶、限制性内切酶 Acc I、Bam HI、T4-DNA连接酶(Takara公司),凝胶回收试剂盒(Axygen公司),其他试剂均为进口或国产分析纯.PCR引物(见图2,上海桑尼生物科技有限公司合成):99-sense(TCCAAATAAGGGAATGCG),359-Antisense(CGGAGTGCTAAACGGGCTAA);插入片段引物 41(CTACTCCAGCCCGGGATTCCACTATGG),42(GATGAGGTCGGGCCCTAAGGTGATACC).DNA测序(上海桑尼生物科技有限公司).
1.2 方法
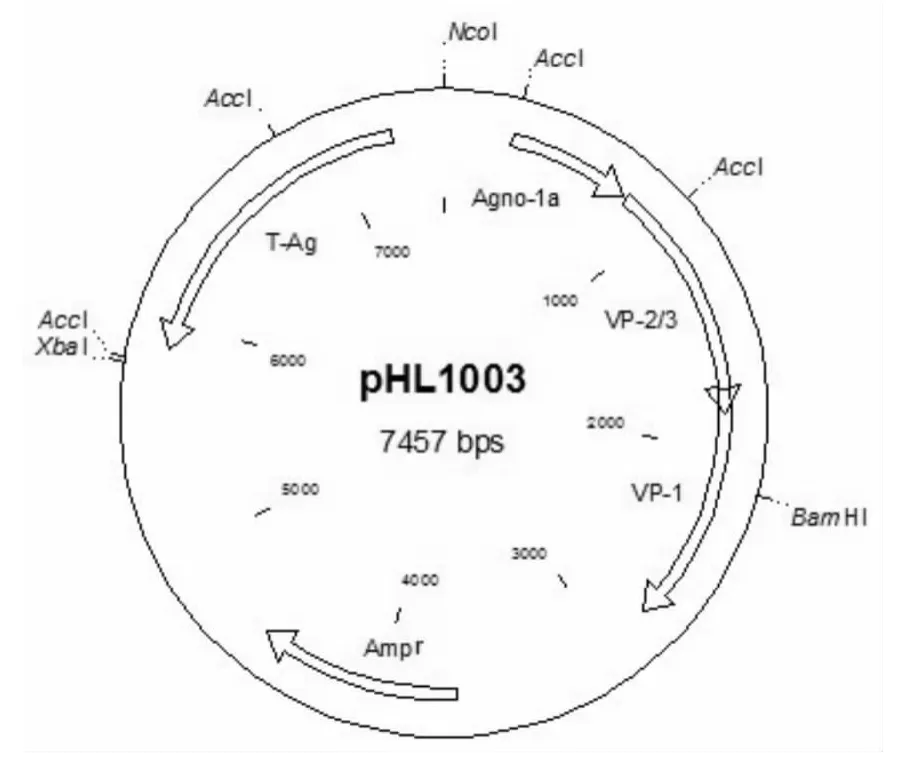
图3 pHL1003 cDNA质粒图谱Fig.3 The plasmid map of pHL1003 cDNA
1.2.1 pHL1003 的中量制备
[11],挑取-80℃超低温冰箱保存的菌液接种于1mL含amp的LB液体培养基中,在37℃,220r/min条件下培养12 h,将新鲜培养的1 mL菌液接种于200 mL含Amp的LB液体培养基中在37℃,220r/min条件下培养12 h,采取改进的碱裂解法提取DNA,将提取的DNA用1%琼脂糖凝胶电泳检测,保存于-20℃冰箱.
1.2.2 酶切质粒pHL1003获取目的片段
冰上操作,用AccⅠ部分酶切,按下列体系加样:10 × M buffer 20 μL,Acc I 0.5μL,pHL1003 DNA 100μL,ddH2O 79.5 μL,37℃ 酶切 50min.
1.2.3 插入片段41,42 DNA的退火形成和磷酸化处理
将等摩尔浓度的合成引物41,42溶液1︰1混合后加温至95℃,维持5min后缓慢降至室温.DNA的磷酸化体系如下:T4 Polynucleotide Kinase 2μL,AIP 2 μL,41,42 DNA 30 μL,10 × T4 polynucleotide kinase buffer 5μL,ddH2O 11μL,37℃水浴12 h,插入片段 41,42 DNA磷酸化后用 3M的 CH3COOK沉淀.
1.2.4 禽类多瘤病毒克隆的构建
用T4 DNA连接酶(16℃过夜)连接Acc I酶切回收后的pHL1003大片段和经磷酸化处理后的目的插入片段,热休克法(42℃)转化CaCl2制备的感受态E.coli DH10b,37℃ LB液体培养基震荡培养1 h后涂布于含Amp的LB平板进行筛选,选择阳性重组菌落进行质粒小量制备.
1.2.5 PCR和PAGE筛选重组质粒
以小量制备的重组DNA为模板经PCR扩增,检测是否有片段插入.PCR体系总体积50 μL,含无菌水40.5μL,10 × buffer 5μL,10 μmol/L 正反向引物各 0.25 μL,1 mmol/L dNTP 1.5 μL,0.25 U/μL Tag 聚合酶 1.5 μL,重组 DNA 模板 1 μL.PCR程序:94℃ 5min;94℃ 1min,49℃ 1min,72℃ 1min,30个循环;72℃ 10min.8%的 PAGE凝胶检测,EB染色,凝胶成像仪拍照.对含有插入片段的目的克隆进行DNA测序.
2 结果与分析
pHL1003 DNA的1%琼脂糖凝胶电泳,Acc I部分酶切和阳性克隆的PCR结果分别见图4~5.采取碱裂解法中量制备质粒DNA,由图4电泳检测可见在7.5kb处有2条明显的条带,说明提取的DNA效果较好.以此用Acc I部分酶切(见图5)在约7.5kb处有2条带,上面的是所需要的目的条带,下面的是Acc I的2个临近酶切位点的双酶切产物.将目的片段回收后与磷酸化处理后的插入片段连接并转化,挑取阳性克隆,碱裂解法小量制备后,PCR扩增插入片段两侧260 bp的DNA片段,经8%PAGE检测(见图6),挑选含有插入片段的克隆[12]并测序.

图4 pHL1003 DNA的1%琼脂糖凝胶电泳结果Fig.4 1%Agarose gelelectrophoresis results of pHL1003 DNA

图5 pHL1003 DNA的Acc I部分酶切结果Fig.5 The result of pHL1003 DNA partially digested by Acc I

图6 阳性克隆的PCR结果Fig.6 The PCR result of the positive clones
3 测序结果
APV-1 cDNA克隆及其突变体的agno-1a基因编码起始区测序结果见图7.由图7可见,Agno-1a(0)为正常APV-1 cDNA克隆pHL1003,Agno-1a(+1)和Agno-1a(+2)分别为含有1个和2个插入片段的克隆.另外,意外得到Agno-1a(+1')、Agno-1a(+2')、Agno-1a(+2')、Agno1a(+3')、Agno1a(+4')这5个突变克隆,分别含有1个,2个,2个(不同于前者),3个,4个插入片段的克隆.
4 讨论
蛋白质翻译的过程是基因表达的第二阶段,其翻译起始(特别是多顺反子的翻译起始)调控机制较为复杂.目前已知的主要有2种多顺反子翻译起始调控方式:①扫描机制(leaky scanning)依赖于帽子结构的mRNA以CCRCCAUGG作为最佳的翻译起始密码子序列.40S核糖体亚基起始复合物结合至mRNA帽子结构区并沿mRNA向下游扫描搜索,借助CCRCCAUGG序列搜寻具较强信号的起始密码子,以此序列的-3和+4位(斜体带下划线字母)决定起始的强度和翻译效率的高低;②内部核糖体进入位点序列 (internal ribosome entry site,IRES)[13],在小RNA病毒家族中发现,mRNA无帽子结构,GC含量较高,5'UTR较长,可能存在复杂的二级结构,编码多种蛋白质,存在多个起始密码子,这些特点令40S核糖体亚基起始复合物难以通过leaky scanning方式起始翻译,而以40S核糖体起始复合物直接结合于mRNA-AUG区域的方式起始翻译.

图7 APV-1 cDNA克隆及其突变体的agno-1a基因编码起始区序列Fig.7 Agno-1a gene coding sequences with ATG of APV-1 cDNA clone and its mutants
禽类多瘤病毒APV-1与其他多瘤病毒基因组的组成和结构类似,分为早期区、晚期区及非编码调控区.晚期编码区可转录出多种多顺反子mRNA,分别翻译出 Agno-1a、Agno-1b、Agno-2a、Agno-2b、VP1、VP2、VP3.
对APV的晚期基因编码的前导蛋白Agno-1(1a和1b)和Agno-2(2a和2b)的结构和功能的深入研究发现这些Agno蛋白与禽类多瘤病毒的复制和晚期蛋白的表达有关[14].本研究通过在agno-1a基因编码区的翻译起始点插入含AUG起始码的编码7个氨基酸的具有最佳翻译起始信号的核苷酸,成功构建了不同的APV-1 cDNA克隆突变体,为在细胞内观察其对agno-1a mRNA下游VP1翻译的影响,进一步研究禽类多瘤病毒晚期基因的翻译调控分子机制打下了良好的基础.
参考文献
[1]夏 苇,冯 锋,李天宪,等.我国一株鹦鹉病毒的鉴定及其生化特性[J].中国病毒学,1999,3(14):265-272.
[2]冯 锋,夏 苇,赵 林,等.我国一种鹦鹉新病毒的分离[J].中国病毒学,1996,11(4):384-386.
[3]Johne R,Jungmann A,Müller H.Agnoprotein 1a and agroprotein 1b ofavian polyomavirusare apoptotic inducer[J].J Gen Virol,2000,81(Pt 5):1183-1190.
[4]Johne R,Müller H.Avian polyomavirus agnoprotein 1a is incorporated into the virus particle as a fourth structural protein,VP4[J].J Gen Virol,2001,82(Pt 4):909-918.
[5]Johne R,Müller H.Nuclear localization of avian polyomavirus structural protein VP1 is a prerequisite for the formation of virus-like particles[J].J Virol,2004,78(2):930-937.
[6]Ramis A.虎皮鹦鹉同时暴发喙羽病病毒和多瘤病毒感染[J].国外畜牧科技,1999,26(3):37-40.
[7]蒋文明,庄青叶,马青霞,等.青岛即墨鹦鹉幼雏病的诊断及病毒VP1基因序列分析[J].中国动物检疫,2008,25(12):47-48.
[8]Li J.Molecular analysis of late gene expression and characterization in BFDV (budgerigarfledglingdisease virus)[D].Giessen:Justus-liebig-Universitat Giessen,1996.
[9]Shen P S,Enderlein D,Nelson C D,et al.The structure of avian polyomavirus reveals variably sized capsids,nonconserved inter-capsomere interactions,and a possible location of the minor capsid protein VP4[J].Virology,2011,411(1):142-152.
[10]Li J,Liu Q,Müller H,et al.Avian polyomavirus expression patterns of bicistronic late mRNAs[J].Virology,2009,388(1):42-48.
[11]奥斯伯,金斯顿,塞德尔,等.精编分子生物学实验指南[M].4版.北京:科学出版社,2005.
[12]侯云德.分子病毒学[M].北京:学苑出版社,1990.
[13]李 彤,王恩多.真核生物蛋白质翻译的内部起始机制[J].生物化学与生物物理进展,1995,22(6):494-498.
[14]Liu Q.Molecular analysis of late gene expression and characterization of agnoproteins of avian polyomavirus BFDV[D].Giessen:Justus-liebig-Universitat Giessen,1997.

