烟碱降解菌DAB2菌株的筛选、鉴定和降解特性
李晓华,杨晓潼,翟贵发,郭 利,王晓丽
(1中南民族大学生命科学学院,生物技术国家民委重点实验室,武汉430074;2湖北省襄阳市烟草专卖局,襄阳441003)
烟碱(Nicotine)是烟草生物碱中的主要成分,也是影响卷烟品质的重要因素之一[1].目前,我国烤烟烟碱含量普遍偏高,尤其是上部烟叶,偏高的烟碱含量影响了烟叶质量和烟叶的工业可用性.故有效降低烟叶中烟碱含量成为烟草行业急需解决的问题.
目前国内多使用过滤嘴过滤、打孔稀释和烟草薄片等物理措施来降低烟碱含量,但会造成烟、香、气的损失.国外烟叶企业很早就已开始利用微生物发酵降解烟叶中的烟碱,既可降低烟碱含量又能改进卷烟品质,并满足消费群体对低烟碱卷烟的需求[2-7].本研究从长期种植烟草的湖北襄阳土壤中分离烟碱降解菌,研究其降解性能,为微生物在烟草工业和环境保护的应用奠定基础.
1 材料与方法
1.1 材料
土壤采自湖北省襄阳烟叶种植地,Nicotine(纯度≥98%)购自洛阳天科生物工程有限公司.烟碱培养基:13.3 g K2HPO4,4.0 g KH2PO4,0.1 g(NH4)2SO4,1.0 g 酵母粉,10.0 mL 微量元素(1.0 g MgSO4·7H2O,0.4 g MnSO4·H2O,0.2 g CaCl2·2H2O,0.2 g CuCl2·2H2O,0.02 gFeSO4·7H2O,用0.1 mol/L HCl溶解到100 mL),加蒸馏水到1000 mL,自然 pH.培养基121℃高压蒸汽灭菌20 min后,加入一定量烟碱(用0.22 μm 滤膜过滤).烟碱分离培养基:在烟碱培养基中添加1.8%琼脂.种子培养基:10.0 g 胰化蛋白胨,5.0 g 酵母提取物,10.0 g NaCl,溶于900 mL去离子水,用2 mol/L的NaOH调pH值至7.0,用去离子水定容至1000 mL.引物合成和测序由北京三博远志生物技术有限公司完成.
1.2 烟碱降解菌的筛选
取2.0 g土壤样品于20 mL烟碱培养基,30℃、180 r/min摇床培养.用0.9%生理盐水梯度稀释,涂布于烟碱分离培养基,于30℃培养,挑取菌株划线分离纯化.分别将纯化的菌株接入烟碱培养基中,于30℃、180 r/min摇床培养,测定发酵液中烟碱含量.
1.3 烟碱含量的测定
将分离纯化的菌株接入烟碱培养基中(烟碱质量浓度为1.0 g/L),于30℃、180 r/min摇床培养,以未接菌的烟碱培养基为空白对照.发酵液于10000 r/min离心10 min,上清液用0.05 mol/L HCl溶液稀释至合适的吸光度范围.以0.05 mol/L HCl溶液为参比,测定发酵液在259 nm处的吸光值,计算烟碱降解率:烟碱降解率=(原培养液中烟碱含量–发酵液中烟碱含量)/原培养液中烟碱含量×100%.
1.4 菌种鉴定
参照文献[8]进行形态结构观察和生理生化特性鉴定.参照文献[9]提取细菌总DNA,测定16S rDNA序列.用于16S rDNA的PCR反应的引物为一对通 用 引 物,正 向 引 物 F1:5'-AGAGTTTGATCCTGGCTCAG-3'和反向引物 F2:5'-AAGGAG-GTGATCCAGCC-3'.PCR 反 应 体 系(20μL):10×PCR 缓冲液 2μL,dNTP 1μL,F1 和 F2各1μL,模板 DNA 1μL,Taq 酶 0.25μL,超纯水 13.75μL.PCR 反应条件:94℃预变性5 min,94℃变性1 min,55℃退火1 min,72℃延伸1.5 min,循环30 次;最后72℃延伸10 min.用 Blast在GenBank基因库中对测序结果进行同源性比较和鉴定.1.5 菌体生长量的测定
菌株以5%体积比的接种量接种至烟碱培养基中,在30℃、180 r/min条件下摇床培养,定时取样测定菌体的生长量和烟碱降解率,以分光光度法OD600表示.
2 结果与分析
2.1 烟碱降解菌的分离
测定分离所得到菌株摇瓶培养24 h后降解烟碱的能力,DAB2菌株烟碱降解结果见图1.如图1所示,烟碱培养基(CK)在259nm处有吸收峰,而经摇瓶培养24 h后的发酵上清液在259nm处吸收峰消失,表明DAB2菌株具有降解烟碱的能力.

图1 DAB2菌株发酵液和烟碱培养基紫外吸收图谱Fig.1 UV absorption spectrum of fermentation liquid by DAB2 strain and nicotine medium
2.2 DAB2菌株的鉴定
DAB2菌株显微观察和生理生化试验结果为:在烟碱固体培养基上菌落呈乳白色、圆形、光滑凸起、边缘整齐、不产色素,平板仍是淡黄色;在液体烟碱培养基中,发酵液颜色从原始澄清透明淡黄色逐渐变成深褐色.革兰氏染色阴性,伏-普试验、甲基红试验、吲哚试验呈阴性,硫化氢试验呈阳性.
图2为DAB2菌株系统发育进化树可以看出:DAB2菌株与中间苍白杆菌属(O.intermedium)分支较近(bootstrap值大于97%).结合生理生化特性,初步确定 DAB2菌株为中间苍白杆菌(O.intermedium).
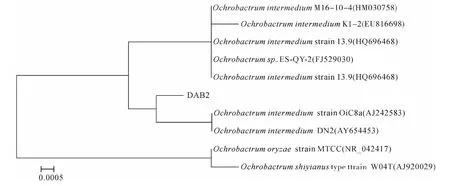
图2 DAB2菌株系统发育树Fig.2 Phylogenetic tree of strain DAB2
2.3 DAB2菌株的烟碱降解特性
DAB2菌株烟碱降解率与生长量的关系结果见图3.如图3所示,随着DAB2菌株的生长烟碱不断被降解,16 h时DAB2菌株生长量达到最大,此时烟碱的降解率达87.41%,这说明烟碱降解率和菌体生长量呈正相关.

图3 DAB2菌株的生长与烟碱降解Fig.3 The growth and degradation curve of strain DAB2
DAB2菌株以体积比5%的接种量分别接种到不同质量浓度的烟碱培养基中,30℃、180 r/min摇床培养,24 h取样测定菌株生长量和烟碱降解率,结果见表1.当培养基中烟碱质量浓度为1.0 g/L时,烟碱降解率为88.42%,生长旺盛;当培养基中烟碱质量浓度为3.0 g/L时,烟碱降解率为52.46%,生长受到一定程度抑制;当培养基中烟碱浓度高于6.0 g/L时,DAB2菌株生长和烟碱降解均呈下降趋势,烟碱降解率低于10.36%.
DAB2菌株以体积比5%的接种量接种到烟碱质量浓度为1 g/L的烟碱培养基中,于30℃、180 r/min摇床培养,每隔4 h取发酵液,在波长为200~400 nm条件进行紫外光扫描,结果见图4.如图4所示,0 h时培养基中存在大量烟碱,故259 nm有最大吸收峰,随着培养时间增加,259nm的特征吸收峰逐渐降低,即烟碱逐渐被DAB2菌株降解.当培养到8 h时,除 259 nm的特征吸收峰外,还在230nm、290nm处出现了2个新峰,推测是DAB2菌株代谢烟碱的中间产物.

表1 不同烟碱质量浓度对DAB2菌株烟碱降解率和生长量的影响Tab.1 Effect of nicotine concentration on growth and degradation of strain DAB2
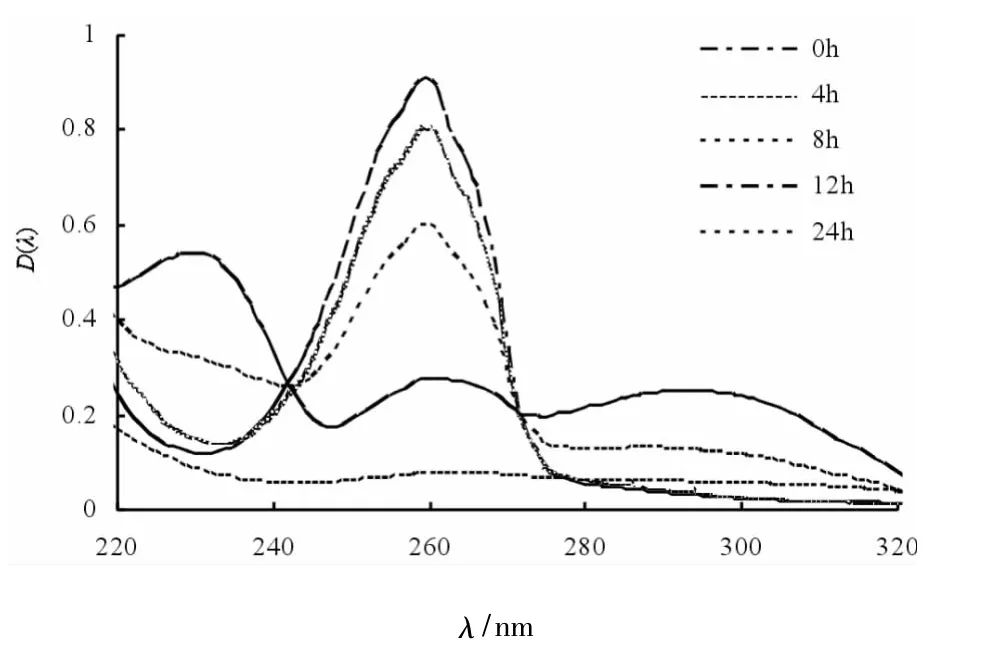
图4 DAB2菌株不同时间发酵液紫外扫描图谱Fig.4 UV absorption spectrum of nicotine degradation by strain DAB2 at different time
3 结语
本研究从湖北省襄阳烟草种植地中分离得到一株烟碱降解菌,经形态观察、生理生化实验和16S rDNA序列同源性分析,初步鉴定该菌株为中间苍白杆菌(O.intermedium).当烟碱质量浓度为1.0 g/L时,烟碱降解率为88.33%,生长旺盛;当烟碱质量浓度达到3.0 g/L时,烟碱降解率为52.46%,生长受到一定程度抑制;当培养基中烟碱浓度高于6.0 g/L时,DAB2菌株生长和烟碱降解均呈下降趋势,烟碱降解率低于10.36%.烟碱的耐受浓度在无机盐培养基中可达到6 g/L,比国内早期报道的中间苍白杆菌DN2[7]耐受能力更高.
在1 g/L烟碱浓度下,DAB2菌株的发酵上清液紫外扫描图谱显示:8 h时259 nm处波峰较4 h降低,并在230 nm和290 nm处出现了新峰,说明中间产物出现,12 h时新峰峰值达到最大,随后又逐渐降低,直到24 h所有峰值趋平.其降解途径和中间物还需进一步研究.
[1]Campain J A.Nicotine:potentially a multifunctional carcinogen[J].Toxicol Sci,2004,79(1):1-3.
[2]Wang S N,Liu Z,Xu P.Biodegradation of nicotine by a newly isolated Agrobacterium sp.strain S33[J].J Appl Microbiol,2009,107(3):838-847.
[3]Treiber N,Schulz G E.Structure of 2,6-dihydroxypyridine 3-hydroxylase from a nicotine-degrading pathway[J].J Mol Biol,2008,379(1):94-104.
[4]Wang H H,Yin B,Peng X X,et al.Biodegradation of nicotine by newly isolated Pseudomonas sp.CS3 and its metabolites[J].J Appl Microbiol,2012,112(2):258-68.
[5]Wang M,Yang G,Min H,et al.A novel nicotine catabolic plasmid pMH1 in Pseudomonas sp.strain HF-1[J].Can J Microbiol,2009,55(3):228-233.
[6]Wang SN,Liu Z,Tang H Z,et al.Characterization of environmentally friendly nicotine degradation by Pseudomonas putida biotype A strain S16[J].Microbiology,2007,153(Pt 5):1556-1565.
[7]孔 雯,先 锋,李长影,等.1株烟碱降解菌的筛选、鉴定及其降解性能的初步研究[J].华中农业大学学报:自然科学版,2011(01):30-33.
[8]沈 萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007:111-120.
[9]Kieser T,Bibb M J,Chater K F,et al.Practical streptomyces genetics:a laboratory manual[M].Norwich:John Innes Foundation,2000.

