Ag/SBA-15的制备及其催化CO选择性氧化反应性能
王树国,高 杨,李 琳
(中南民族大学化学与材料科学学院,催化材料科学湖北省暨国家民委-教育部共建重点实验室,武汉430074)
近年来,燃料电池,特别是质子交换膜燃料电池(PEMFC)因其诸多优点引起了人们的广泛关注[1],然而通常燃料是由烃等原料通过蒸汽重整和水汽变换得来的[2,3],含有少量 CO,电极的 CO 敏感性问题[4]会严重影响电池的工作效率,故解决电极的CO中毒问题是影响质子交换膜燃料电池广泛应用的一大课题.而CO的选择性催化氧化法是消除燃料气中 CO 最简单、廉价、直接和有效的方法[5-7].
目前用于CO选择性催化氧化较多的是负载型贵金属催化剂[8,9],负载型金催化剂[10]被认为是最为有效的 CO 低温氧化催化剂之一.Haruta等[11,12]报道Au/MnOx催化剂在0℃以下就有CO氧化活性,其中金锰比为1︰50的催化剂表现出了最好的活性,在50℃~80℃之间,CO的转化率达到了95%.但贵金属成本普遍较高,储量有限,银元素与金同属于 IB族,但价格低廉,储量较高.曲振平等[13]用浸渍法制备的Ag/SiO2催化剂经高温氧气处理后对于CO选择性氧化活性和选择性均好.Chun-Wan Yen 等[14]将载体 MCM-41 功能化改性,再采用浸渍法将金、银负载在MCM-41上,获得了限域于MCM-41孔道内的Au-Ag双金属催化剂,并探讨了其在CO选择性氧化的性能,得到了较好的反应结果.
本文以硝酸银为银源,SBA-15为载体,采用双溶剂法[15]制备得到了Ag/SBA-15催化剂,并通过X射线粉末衍射(XRD),透射电子显微镜(TEM)和电感耦合等离子体发射光谱(ICP-AES)等手段对样品进行了表征,考察了其对CO选择性氧化的催化性能.
1 实验部分
1.1 试剂和仪器
聚乙氧基聚丙氧基聚乙氧基三嵌段共聚物(EO20PO70EO20,P123,分析纯,美国 Aldrich 公司),正硅酸四乙酯(TEOS,分析纯,上海国药集团),盐酸(分析纯,开封东大化工有限公司试剂厂),正己烷(分析纯,国药集团化学试剂有限公司),硝酸银(分析纯,上海展云化工有限公司).
Bruker D8型X-射线粉末衍射仪(德国布鲁克斯公司),Tecnai G220型透射电子显微镜(荷兰FEI公司),电感耦合等离子体原子发射光谱仪(Optima 4300DV型,美国PE公司).
1.2 实验过程
1.2.1 载体 SBA-15 的制备
40℃下,将20g P123溶于400 mL 2 mol/L盐酸溶液中,待完全溶解后,在剧烈搅拌下逐滴加入45 mL TEOS,继续剧烈搅拌24 h,将溶液转移到带有聚四氟乙烯内衬的不锈钢反应釜中,100℃下晶化48 h,所得沉淀用去离子水反复抽滤洗涤至中性,晾干,得白色粉末,记为 SBA-15-syn.将 SBA-15-syn 于程序控温马弗炉中以2℃/min由室温升至550℃,保持6 h,在炉中冷至室温后取出,得到白色粉末,记为 SBA-15.
1.2.2 Ag/SBA-15 的制备
将SBA-15于140℃烘箱中干燥12 h以脱除吸附在 SBA-15上的水分,称取1.4 g SBA-15 分散在140 mL正己烷中,搅拌30 min,使正己烷完全润湿SBA-15,再缓慢滴加 2.1 mL 0.2 mol/L AgNO3溶液,继续搅拌4 h,滤掉正己烷,得到淡黄色固体,干燥,然后于程序控温马弗炉中以2℃/min由室温升至350℃,保持2 h,在炉中冷至室温后取出,得黑色粉末,为质量分数为3.67%的 Ag/SBA-15.同法通过调整AgNO3浓度为0.33 mol/L,0.47 mol/L 分别制得质量分数为5.76%,7.37%的Ag/SBA-15(Ag含量通过ICP-AES确定).
1.2.3 催化剂性能评价
催化剂对CO选择性氧化的活性评价在常压微型固定床反应器中进行.催化剂装样量为1.0 g,反应气组成为V(CO)︰V(O2)︰V(H2)︰V(He)=1︰1︰48︰50,总流速 50 mL/min,空速 3 L·h-1·g-1cat.反应开始前先通入空气(50 mL/min)在500℃常压条件下对催化剂进行预处理2 h,冷至室温后通入纯氢(≥99.995%)(50 mL/min)于300℃常压还原2 h,冷至室温后,再通入反应气,体系由程序控温炉升温加热,原料气和尾气的组成由在线Agilent Micro GC 3000A气相色谱分析,采用分子筛色谱柱进行分离气体,He为载气,TCD检测,工作站控制采样过程并进行数据处理.
2 结果与讨论
2.1 银负载量的测定
为精确测得银的负载量,取少量催化剂依次用10%的HF,稀硝酸完全溶解,用ICP-AES分别测得3个催化剂中银含量由低到高分别为3.67%,5.76%,7.37% .
2.2 XRD 分析
载体SBA-15和3种不同银负载量催化剂的小角和广角XRD谱见图1.图1(a)为载体及催化剂的小角XRD谱,在0~2°出现了一个尖峰和2个小峰,分别归属于载体的(100)、(110)、(200)晶面,(100)面的尖峰的出现反映出材料存在介孔,(110)和(200)晶面的2个小峰反映出该材料具有二维六方(p6mm)结构[16],证实了载体为介孔分子筛SBA-15.图1a(2)、a(3)、a(4)分别为 3 个不同负载量银的催化剂的小角XRD谱,3个催化剂仍然保持很好的二维六方结构,说明银引入后分子筛的结构仍然保持良好,3个催化剂的(100)面峰强度减弱,相比于SBA-15向大角度偏移,说明在浸渍和焙烧催化剂的过程中,分子筛结构少量坍塌,骨架结构轻微收缩,透射电镜的表征结果进一步证实了这一点.
3个催化剂的广角XRD谱见图1(b).图1(b)中,3个催化剂的峰型相似,峰位置也一致,只是峰强不同,在23°附近的一个宽化峰归属于无定形二氧化硅特征峰,而在 38.0°、44.3°、64.5°和 77.3°的峰分别归属于立方结构银的(111)、(200)、(220)和(311)晶面的特征衍射峰(PDF NO.00-004-0783).结合载体SBA-15和催化剂的小角XRD发生的变化,说明银粒子成功负载到了载体SBA-15上.

图1 载体及催化剂的XRD谱Fig.1 XRD patterns of support and catalysts
2.3 TEM分析
3种不同负载量催化剂在(110)方向上的透射电镜照片见图2.由图2可见,3个催化剂均在(110)方向上呈一维直孔道排列,SBA-15的结构保持较好,说明银的负载未对载体造成较大影响,与XRD表征相吻合.图2(a)中负载的银颗粒大部分分布在载体的孔道内,载体外的较少,且分布较均匀,分散较好,无严重的团聚现象;随着负载量的提高,图2(b)、(c)中,银颗粒部分团聚堆积至载体表面,分散变差,载体结构部分也发生了坍塌,说明高负载量银的引入不利于催化剂结构的稳定和银颗粒的分散.

图2 3种不同负载量催化剂的透射电镜照片Fig.2 TEM images of the catalysts with different loading amounts
2.4 催化性能测试
不同负载量Ag/SBA-15对CO选择性氧化的催化活性见图3.由图3(a)可见,在室温至80℃时,随着反应温度的升高,CO转化率升高,55~60℃转化率最高,继续升温转化率开始下降,其中负载量为5.76%的Ag/SBA-15显示出了较好的催化性能,最高转化率达到75.6%,负载量为5.76%的样品的活性组分含量较3.67%的样品要高,故反应活性更高;但随着负载量的提升,团聚现象变严重,虽然活性组分含量提高了,但活性中心数目并没有增多,有效接触反应面积反而减小,故7.37%的样品反应活性反而不如5.76%的样品.另外2个催化剂最高转化率也能分别达到61.4%、69.1%.图3(b)是 CO的选择性与反应温度的关系,随着反应温度的升高CO的选择性逐渐下降,由于CO氧化是一个放热反应,根据热力学原理,高温不利于CO氧化的进行,却有利于H2与O2的反应,因此在这一对竞争反应中,低温有利于CO的选择性,高温有利于H2的选择性.说明反应温度越低,CO的选择性越好;高温时,O2更倾向于与H2反应,室温时最高的选择性约为55%~70%.综上所述,双溶剂法制备的纳米银催化剂低温时CO催化性能良好,其中负载量为5.76%的样品催化活性最好,催化反应温度越低CO选择性越高.
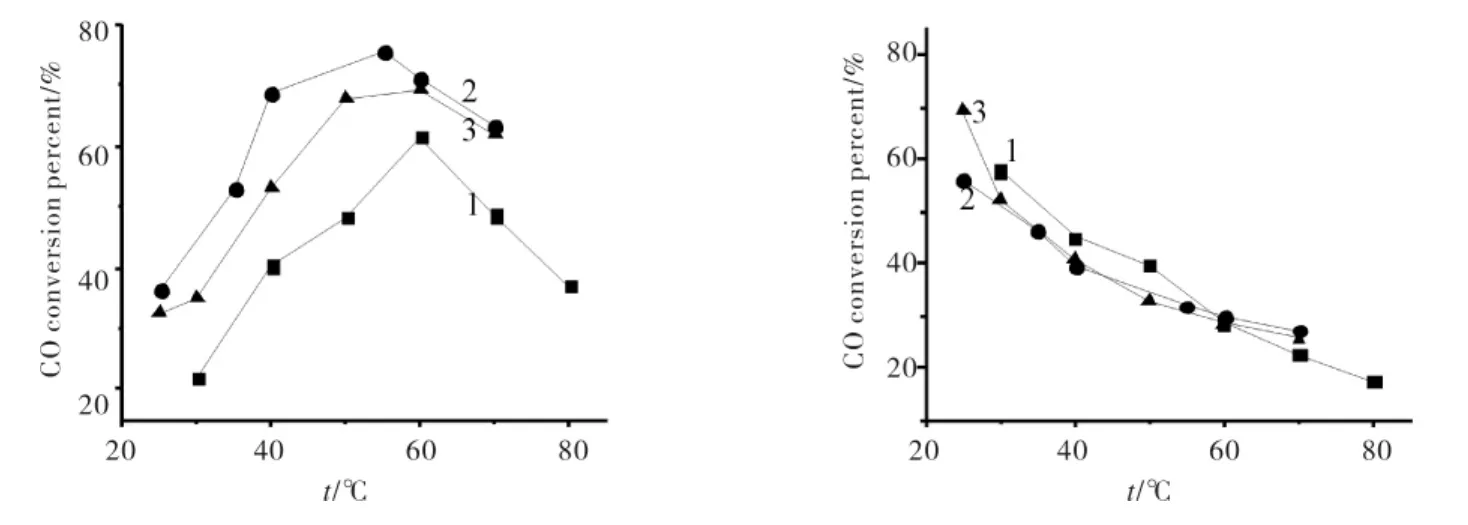
图3 不同负载量Ag/SBA-15催化性能Fig.3 Catalytic performance over Ag/SBA-15 with different loading amounts
3 结语
以硝酸银为银源,通过双溶剂法制备了结构规整、高度分散的纳米银催化剂,并研究了不同负载量的银催化剂对CO选择性氧化的性能,结果表明:负载的银催化剂催化性能良好,其中5.76%Ag/SBA-15催化剂催化活性最高,银催化剂相比贵金属催化剂,具有潜在的发展前景.
[1]Park E D,Lee D,Lee H C.Recent progress in selective CO removal in a H2-rich stream[J].Catalysis Today,2009,139(4):280-290.
[2]Trimm D L.Minimisation of carbon monoxide in a hydrogen stream for fuel cell application[J].Appl Catal-Gen,2005,296(1):1-11.
[3]Ladebeck J R,Wagner J P.Handbook of fuel cells:fundamentals technology and applications.Vol 2[M].Chichester:John Wiley & Sons Ltd,2003:190.
[4]曲振平.银催化剂上一氧化碳选择性氧化反应的研究[D].大连:中国科学院大连化学物理研究所,2003.
[5]Li Q F,He R H,Gao J A,et al.The CO poisoning effect in PEMFCs operational at temperatures up to 200℃[J].JElectrochem Soc,2003,150(12):A1599-A1605.
[6]Emonts B,Hansen J B,Jørgensen S L,et al.Compact methanol reformer test for fuel-cell powered light-duty vehicles[J].J Power Sources,1998,71(1/2):288-293.
[7]Kahlich M J,Gasteiger H A,Behm R J.Kinetics of the Selective CO Oxidation in H2-Rich Gas on Pt/Al2O3[J].J Catal,1997,171(1):93-105.
[8]Bethke G K,Kung H H.Selective CO oxidation in a hydrogen-rich stream over Au/γ-Al2O3catalysts[J].ApplCatal-Gen,2000,194/195:43-53.
[9]Korotkikh O,Farrauto R.Selective catalytic oxidation of CO in H2:fuel cell applications[J].Catal Today,2000,62(2/3):249-254.
[10]Schubert M M,Plzak V,Garche J,et al.Activity,selectivity,and long-term stability of different metal oxide supported gold catalysts for the preferential CO oxidation in H2-Rich gas[J].Catal Lett,2001,76(3/4):143-150.
[11]Torres Sanchez R M,Ueda A,Tanaka K,et al.Selective oxidation of CO in hydrogen over gold supported on manganese oxides[J].J Catal,1997,168(1):125-127.
[12]Haruta M,Ueda A,Tsubota S,et al.Low-temperature catalytic combustion of methanol and its decomposed derivatives over supported gold catalysts[J].Catal Today,1996,29(1/4):443-447.
[13]Qu Z P,Cheng M J,Huang W X,et al.Formation of subsurface oxygen species and its high activity toward CO oxidation over silver catalysts[J].J Catal,2005,229(2):446-458.
[14]Yen C W,Lin M L,Wang A Q,et al.CO oxidation catalyzed by Au-Ag bimetallic nanoparticles supported in mesoporous silica[J].J PhysChem C,2009,113(41):17831-17839.
[15]Huang X B,Dong W J,Wang G,et al.Synthesis of confined Ag nanowires within mesoporous silica via double solvent technique and their catalytic properties[J].J Colloid Interface Sci,2011,359(1):40-46.
[16]Zhao D Y,Feng J L,Huo Q S,et al.Triblock copolymer syntheses of mesoporous silica with periodic 50 to 300 angstrom pores[J].Science,1998,279(5350):548-552.

