重组Nkx2.5 腺病毒的构建及心肌细胞感染实验*
张 勤,应湾湾,葛丹婷,房跃群,李 涛
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
转录因子Nkx2.5 是关键的心肌发育调控因子.Nkx2.5 具有调控心肌基因表达、诱导发育分化、抗凋亡等重要作用.Nkx2.5 在心肌开始分化前即开始表达,是所有脊椎动物心脏发育中最早表达的转录因子之一[1],并参与房室结构、流出道和传导系统的形成.Nkx2.5 突变小鼠死于胚胎发育9~10 d,检测发现其心室壁结构薄弱、房室间隔缺损、心脏环化障碍[2].在非洲爪蟾的胚胎中发现,过表达Nkx2.5 会扩增心肌细胞数目而导致心脏肥大[3].把Nkx2.5 注射到斑马鱼胚胎中也会促使其心脏肥大性发育,甚至导致心肌基因的异位表达[4].此外,研究发现Nkx2.5 及其相关的GATA4 转录因子均具有保护心肌细胞、拮抗氧化损伤的作用[5-6].心肌特异性过表达Nkx2.5 的转基因小鼠的心脏对阿霉素引发的凋亡相对不敏感.
目前,干细胞研究中的一大热点是:诱导骨髓间充质及其他成体干细胞成为心肌细胞,并修复心肌梗死的缺陷区域及功能[7].Nkx2.5 及GATA4 具有诱导心肌分化及抗凋亡的双重作用,是基因修饰干细胞治疗的理想候选分子.本研究通过构建Nkx2.5 过表达的重组腺病毒,以期为进一步研究Nkx2.5 的功能及潜在的医学应用价值奠定基础.
1 材料和方法
1.1 材料
含Nkx2.5 cDNA 全长序列的pFLAG-Nkx2.5质粒由Harvey R P 教授(Victor Chang Cardiac Research Institute,Sydney,Australia)惠赠.腺病毒穿梭质粒pAdTrackcmv,骨架质粒pAdEasy-1,JM109菌、BJ5183 菌、Hela 细胞和H9c2 细胞均为本实验室保存.限制性内切酶Pme Ⅰ(NEB),Pac Ⅰ(NEB),Lipofectamine 2000(Invitrogen),质粒提取试剂盒(威格拉斯).蛋白酶K 购自Merck 公司;MMLV 反转录酶购自Promega 公司;Taq DNA 聚合酶、限制性内切酶均购自New England Biolabs公司;DNA marker 购自北京TIANGEN 公司;H2O2,噻唑蓝(MTT)及Hoechst33342 购自Sigma公司.抗Nkx2.5 抗体购自Santa Cruz 公司.DNA序列合成由北京奥科公司完成.
1.2 Ad-Nkx2.5 腺病毒质粒的构建及包装
腺病毒包装方法见文献[8].将pFLAGNkx2.5 和腺病毒穿梭质粒pAdtrackcmv 用BglⅡ和SalⅠ进行大量双酶切.酶切DNA 片段回收,建立Nkx2.5 和pAdtrackcmv 定向连接反应体系,构建pAdtractcmv-Nkx2.5 质粒.经PmeⅠ线性化的pAdtrackcmv-Nkx2.5 质粒热休克转化事先转入腺病毒骨架质粒pAdEasy-1 的BJ5183 感受态菌,培养过夜后挑选克隆较小的菌落,小提质粒后,PacⅠ酶切鉴定正确的pAd-Nkx2.5 重组腺病毒质粒.pAd-Nkx2.5 质粒转化JM109 菌大提质粒用于细胞转染.pAd-Nkx2.5 质粒经PacⅠ酶切线性化后,用Lipofectamine 2000 脂质体转染293A 细胞,于转染后持续观察细胞形态和病毒噬斑的变化.于转后14 d 左右,待所有细胞感染病毒、变圆漂浮后,收集细胞,磷酸盐缓冲液漂洗后液氮反复冻融细胞3 次,1 000 r/min 离心10 min 后收集上清液冻存.倍比稀释后感染293A 细胞,24 h 后荧光显微镜观察,按公式

计算病毒滴度.对照空病毒为既往保存.
1.3 重组Ad-Nkx2.5 腺病毒的PCR 鉴定
取5 μL 病毒液,加入10 μL 聚合酶链式反应(PCR)级蛋白酶K,于55 ℃作用1 h 后沸水浴5 min,取1 μL 做模板,PCR 扩增Nkx2.5 以鉴定目的基因重组于病毒中.PCR 引物:正向引物为5′-GACAAAGCCGAGACGGAT-3′,反向引物为5′-GAAGCTCCAGAGTCTGGT-3′.产物长度为240 bp,退火温度为62 ℃,PCR 循环数为30.
1.4 Nkx2.5 蛋白表达的Western blot 检测
Hela 细胞接种于6 孔板上,培养过夜后分别加入感染复数(multiplicity of infection,MOI)为100 的病毒液.提取蛋白,二辛可酸(BCA)法蛋白定量.30 μg 蛋白煮沸后,12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳转膜,5%脱脂奶粉封闭1 h 后加入抗Nkx2.5 一抗杂交,辣根过氧化物酶标记二抗孵育后化学发光法显色.
1.5 乳鼠心肌细胞的培养及病毒感染
出生1~3 d 的大鼠,无菌操作下取出心脏,剪除心房,将心室放于含1 g/L 胰蛋白酶和0.5 g/L 胶原酶Ⅰ的消化液中,剪碎后置于4 ℃连续消化,收集悬液,离心,取细胞沉淀,加入含5%胎牛血清的DMEM 高糖培养基铺板,以差速贴壁法去除成纤维细胞,调整细胞密度,接种于12 孔板中,在37 ℃及5%CO2培养箱中继续培养,至24 h后感染腺病毒,48 h 后荧光显微镜观察细胞绿色荧光表达效率和细胞形态.
1.6 逆转录PCR 检测
参照文献[8]提取RNA 进行逆转录PCR(RT-PCR).PCR 引物及扩增条件:GAPDH 基因,正向引物为5′-GTCAGTGGTGGACCTGACCT-3′,反向引物为5′-AGGGGAGATTCAGTGTGGTG-3,扩增条件为58 ℃退火,共25 个循环,产物大小为413 bp;ANF 基因,正向引物为5′-GGCTCCTTCTCCTCACCAA-3′,反向引物为5′-CTCTGAGACGGGTTGACTTCC-3′,扩增条件为60 ℃退火,共30 个循环,产物大小为269 bp;β-MHC 基因,正向引物为5′-GAGTGGACGTTTATTGACTTCGG-3′,反向引 物 为5′-GCCTTTCTTTGCTTTGCCTTT-3′,扩增条件为61 ℃退火,共27 个循环,产物大小为405 bp.
1.7 H9c2 细胞存活率的噻唑蓝法检测
参照文献[9].活细胞代谢将噻唑蓝(MTT)转化为结晶紫,反映活细胞的相对数目.将感染病毒的H9c2 细胞以1 ×105/孔接种至96 孔板,以含100 mL/L 胎牛血清、100 U/mL 氨苄青霉素和100 μg/mL 链霉素的改良DMEM 培养基培养.改良DMEM 培养基偏酸性,每升含15.6 g 培养基粉末、1.5 g NaHCO3.24 h 后加入H2O2至终浓度为200 μmol/L 诱导细胞,于作用后指定时间点加入10% 5 mg/mL MTT 溶液,37 ℃孵育4 h 后终止培养.每孔加入150 μL 二甲基亚砜,混匀10 min 使结晶紫充分溶解.在酶标仪490 nm 波长下测量吸光度,按公式
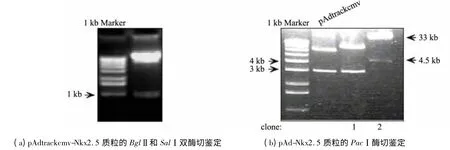
图1 pAd-Nkx2.5 质粒的构建及鉴定
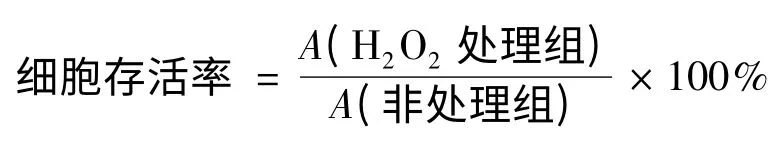
计算细胞存活率.每组设4 个复孔,实验重复3 次.H2O2处理组与对照组相比,用配对t 检验法进行统计检验.
1.8 Hoechst33342 染色及荧光观察
H9c2 细胞加入终质量浓度为1 μg/mL 的Hoechst33342 避光染色30 min,磷酸盐缓冲液漂洗后继续培养.200 μmol/L H2O2处理6 h 后于倒置荧光显微镜(奥林巴斯)下观察细胞形态及核形态变化,随机采取10 个视野拍照.
1.9 统计方法
数据以均值±标准差表示,采用SPSS13.0 统计软件进行t 检验和单因素方差分析.P <0.05表示有显著性差异,P <0.01 表示有非常显著性差异.
2 结果
2.1 pAd-Nkx2.5 质粒的构建
pFLAG-Nkx2.5 质粒经BglⅡ和SalⅠ双酶切后释放约1.1 kb 的Nkx2.5 基因片段.将该片段连接入pAdtrackcmv 骨架质粒中,重组成功后再经双酶切鉴定,结果如图1(a)所示.将经PmeⅠ线性化的pAdtrackcmv-Nkx2.5 转入含pAdEasy-1腺病毒骨架质粒的BJ5183 菌,进行同源重组,经卡那霉素筛选,提取克隆形态较小的菌落进一步PacⅠ酶切鉴定.正确重组的腺病毒质粒约33 kb,可因重组位点不同由PacⅠ酶切切出一个3.0 或4.5 kb 的小片段,结果如图1(b)所示.可以发现:经筛选的重组体clone 1 无法切出大片段,经鉴定为未重组的pAdtrackcmv-Nkx2.5质粒;而clone 2可以切出一大片段及一个4.5 kb 的小片段,鉴定为pAd-Nkx2.5质粒.
2.2 Ad-Nkx2.5 腺病毒的包装及鉴定
构建成功的pAd-Nkx2.5 质粒经PacⅠ酶切线性化后,转染293A 细胞进行包装.Ad-Easy 系统自带EGFP 基因,可通过荧光显微镜观察表达EGFP 的病毒噬斑快速判断病毒包装进度.转染后逐日观察,2 d 起出现噬斑,7 d 后逐步增多,14 d左右可见大量表达绿色荧光蛋白的病毒噬斑(见图2(a)),同时细胞形态变圆、贴壁不牢.收获裂解细胞,取上清液继续感染细胞以扩增病毒,最后收获大量的病毒悬液,经倍比稀释法测得重组Ad-Nkx2.5 病毒滴度为5 ×1011efu/mL.由于重组Ad-Easy 腺病毒可能存在回复突变而导致插入基因片段丢失,为了进一步确认Ad-Nkx2.5 病毒是否含有正确的插入片段,因而提取病毒上清液进行PCR 鉴定,结果如图2(b)所示.pFLAGNkx2.5 质粒及Ad-Nkx2.5 病毒上清液均能扩增出Nkx2.5 目的片段,而对照组Ad-EGFP 病毒未携带Nkx2.5 基因片段,故无扩增片段.按感染复数(MOI)为100 感染HeLa 细胞(Hela 细胞为子宫颈癌细胞,无Nkx2.5 表达),裂解细胞通过Western blot 检测到约37 kD 的Nkx2.5 蛋白表达,而Ad-EGFP 病毒组未检测到Nkx2.5 表达(见图2(c)).上述实验表明,过表达Nkx2.5 基因的Ad-Nkx2.5 重组腺病毒已成功包装.

图2 重组Nkx2.5 腺病毒的包装及鉴定
2.3 Ad-Nkx2.5 腺病毒的乳鼠心肌细胞感染
胰酶/胶原酶消化法分离乳鼠心肌细胞,细胞形态呈短杆分支状.原代乳鼠心肌细胞生长24 h后,按MOI 为100 的病毒量感染乳鼠心肌细胞.倒置荧光显微镜观察发现,80%以上的细胞表达绿色荧光蛋白,细胞形态清晰.Ad-Nkx2.5 感染组细胞贴壁更为牢固,形态铺展,表面积增加,似肥大状表型(见图3(a)).提取RNA 进行RT-PCR检测Nkx2.5 下游基因ANF 及β-MHC 的表达,以GAPDH 作为内参,结果显示:Ad-Nkx2.5 感染后乳鼠心肌细胞的ANF 及β-MHC 表达明显增强(见图3(b)).这些结果表明Ad-Nkx2.5 腺病毒能够表达功能性Nkx2.5 蛋白,调控乳鼠心肌细胞对Nkx2.5 下游基因的表达.从而证明了功能性的Ad-Nkx2.5 腺病毒构建成功.
2.4 Ad-Nkx2.5 腺病毒感染对H2O2介导H9c2细胞凋亡的拮抗
Nkx2.5是维持心肌内环境稳态的重要转录因子.H9c2 大鼠心肌细胞系在H2O2等外源刺激下可呈现典型的凋亡形态和生化改变.H9c2 细胞感染Ad-Nkx2.5 及Ad-EGFP 腺 病 毒(MOI 为100),200 μmol/L H2O2处理细胞后,通过MTT 法检测细胞活力,结果如图4 所示.Ad-Nkx2.5 病毒感染后,显著提高了H9c2 细胞的存活率.其中:
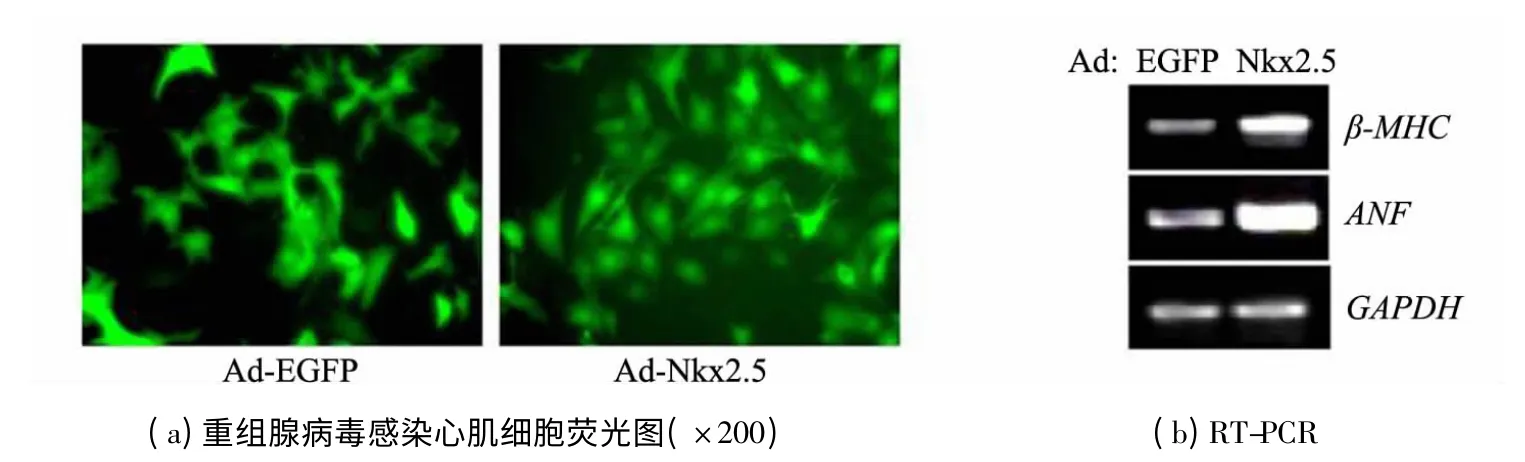
图3 Ad-Nkx2.5 重组腺病毒感染乳鼠心肌细胞

图4 Ad-Nkx2.5 腺病毒感染后对H9c2 细胞抗氧化损伤能力的影响
H2O2诱导4 h 后,Ad-Nkx2.5 组细胞存活率为(87.5 ±1.9)%,Ad-EGFP 组为(43.3 ±2.5)%(P <0.01,n=4);H2O2诱导8 h 后,Ad-Nkx2.5组细胞存活率为(82.5 ±2.3)%,Ad-EGFP 组为(27.8 ±3.7)%(P <0.01,n=4);H2O2诱导12 h后,Ad-Nkx2.5 组细胞存活率为(75.4 ±1.8)%,Ad-EGFP 组为(22.1 ±1.9)%(P <0.01,n=4).
Ad-Easy 腺病毒感染细胞后表达绿色荧光蛋白,显示细胞形态结构;同时,采用亲核染料Hoechest33342 对细胞核进行荧光染色,即可对H9c2细胞凋亡的形态改变进行观测,结果如图5 所示.H9c2 细胞感染Ad-EGFP 病毒,200 μmol/L H2O2处理6 h 后,即出现典型的凋亡表现:细胞皱缩,细胞间连接消失,部分细胞发生脱落飘浮,胞膜有小泡状形成,细胞核固缩,密度增加,部分核碎裂,部分细胞绿色荧光消失,细胞崩解.而Ad-Nkx2.5感染组发生细胞皱缩和核固缩的细胞数目明显少于Ad-EGFP 组,说明重组腺病毒介导的Nkx2.5过表达可抑制H2O2诱导的H9c2 细胞凋亡.
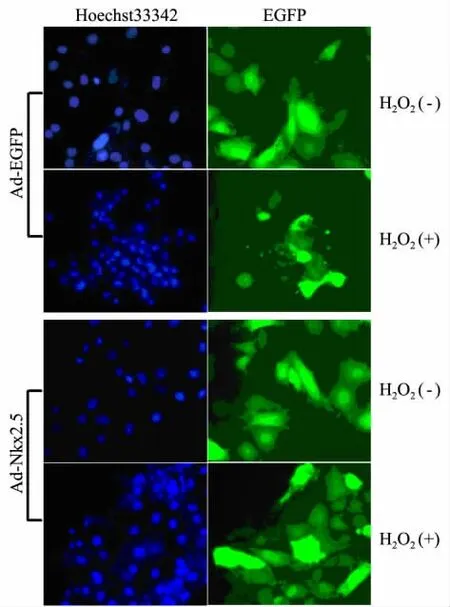
图5 Ad-Nkx2.5 腺病毒感染抑制H9c2细胞凋亡的形态学变化(×200)
3 讨论
心肌细胞作为终末分化细胞,一旦坏死或凋亡基本无再生能力,只能进行瘢痕修复,造成心肌收缩和传导功能不可逆性的损失.近年来,应用骨髓间充质干细胞及其他成体干细胞修复病损心肌组织成为研究的热点.尽管成体干细胞存在取材方便、无移植排斥、无伦理问题等优势,但其横向分化为心肌样细胞受诱导分化微环境的调控,分化效率有限.如何提高诱导分化效率从而更好地改善心功能,仍然是一个有待深入研究的科学问题.目前,人们通过药物诱导、微环境模拟、电场刺激、转基因等方式,对成体干细胞进行心肌诱导分化的尝试[7].通过转基因定向诱导干细胞向心肌分化,Nkx2.5 是一个重要的候选基因.
Nkx2.5 是果蝇tinman 的同源基因,均为控制体节发育的同源异型盒基因家族成员.果蝇的tinman 基因是第一个被证实在果蝇心脏形成和分化中起关键作用的转录因子,tinman 基因突变可以使果蝇心脏缺失或异常.Nkx2.5 则是调控哺乳动物心脏发育和功能执行的关键转录因子.原位标记技术显示,在小鼠胚胎发育7.5 d 时Nkx2.5即开始在生心板表达[1].
Nkx2.5 通过调控心肌基因表达从而广泛地参与了心脏发育及其功能维持,如心肌分化、房室结构组建、流出道形成、传导系统发育和功能维持.目前已知Nkx2.5 的下游基因涉及到心肌泵功能相关蛋白、分泌性蛋白、缝隙链接和电传导相关蛋白、细胞外基质相关蛋白、钙调控相关蛋白和心肌转录因子[10-12]等.因此,Nkx2.5 纯合子突变会导致胚胎发育中断而死亡;其杂合子突变会导致各种先天性心脏病,最常见的是房间隔缺损和房室传导阻滞[10].Jay 等[13]发现,在Nkx2.5 缺失时,心脏传导系统的细胞减少、传导和电生理异常,其机理可能与Nkx2.5 调控传导细胞缝隙连接Connexin40 相关.Pashmforoush 等[14]在小鼠出生后于心室组织特异性地敲除Nkx2.5 表达,发现心小梁形成、腔室扩大进而表现为渐进性心衰;同时,特定肌细胞来源的房室结细胞逐渐被疤痕组织所取代,导致心脏电传导缺失.从而证实出生后心脏泵系统和传导系统的功能维持同样依赖于Nkx2.5 的正常表达.此外,Nkx2.5 是首个被溯源发现的法乐氏四联症致病基因,目前已经建立了Nkx2.5 基因突变与多个人类先天性心脏病的病理关联[15].Nkx2.5 突变的患者常表现为各种心脏发育异常和传导阻滞.
基于Nkx2.5 的功能多样性和重要性,目前已在多种细胞中验证了其诱导干细胞心肌特异分化的能力.例如:在P19 畸胎瘤干细胞中发现,过表达Nkx2.5 可以让细胞摆脱对外源诱导剂的依赖,仅需形成拟胚体即可分化为跳动的心肌细胞[16];Nkx2.5 过表达的胚胎干细胞向心室肌优势分化,同时削弱了向血管系统分化的能力[17].研究亦表明,Nkx2.5 单一过表达或GATA4 协同过表达的骨髓干细胞均能增强心肌诱导分化能力,从而改善心肌梗死区域的功能[18-19].此外,筛选Nkx2.5 表达阳性的心肌前体细胞或心肌干细胞加以扩增和诱导分化,也在研究之中[20-21].另外,Nkx2.5 能够保护心肌细胞,拮抗外源刺激造成的损伤和凋亡,但具体机制尚不明了[5-6].因此,Nkx2.5 阳性细胞不但可以增强心肌特异分化能力,还有助于细胞在缺血、缺氧、炎症细胞侵润、压力超负荷、氧化应激、感染等凋亡诱导条件下的存活.
本研究成功包装重组了Nkx2.5 过表达腺病毒,感染原代乳鼠心肌细胞及传代H9c2 细胞,并验证了其调控心肌基因表达及拮抗氧化损伤的能力,为进一步研究Nkx2.5 的功能及潜在的临床应用价值奠定了基础.重组Nkx2.5 病毒可应用于多个研究领域,如干细胞心肌诱导分化、心梗后的心肌凋亡与修复、心肌内稳态维护、心肌传导阻滞的转基因治疗等.
[1]Lints T J,Parsons L M,Hartley L,et al.Nkx-2.5:a novel murine homeobox gene expressed in early heart progenitor cells and their myogenic descendants[J].Development,1993,119(2):419-431.
[2]Lyons I,Parsons L M,Hartley L,et al.Myogenic and morphogenetic defects in the heart tubes of murine embryos lacking the homeo box gene Nkx2-5[J].Genes Dev,1995,9(13):1654-1666.
[3]Cleaver O B,Patterson K D,Krieg P A.Overexpression of the tinman-related genes XNkx-2.5 and XNkx-2.3 in Xenopus embryos results in myocardial hyperplasia[J].Development,1996,122(11):3549-3556.
[4]Chen J N,Fishman M C.Zebrafish tinman homolog demarcates the heart field and initiates myocardial differentiation[J].Development,1996,122(12):3809-3816.
[5]Toko H,Zhu Weidong,Takimoto E,et al.Csx/Nkx2-5 is required for homeostasis and survival of cardiac myocytes in the adult heart[J].J Biol Chem,2002,277(27):24735-24743.
[6]Monzen K,Zhu Weidong,Kasai H,et al.Dual effects of the homeobox transcription factor Csx/Nkx2-5 on cardiomyocytes[J].Biochem Biophys Res Commun,2002,298(4):493-500.
[7]Williams A R,Hare J M.Mesenchymal stem cells:biology,pathophysiology,translational findings,and therapeutic implications for cardiac disease[J].Circ Res,2011,109(8):923-940.
[8]李涛,胡晓青,姜科声,等.重组GATA4 腺病毒的构建及心肌细胞感染[J].浙江师范大学学报:自然科学版,2011,34(2):191-196.
[9]Wang Zuoyan,Cui Ming,Sun Lijie,et al.Angiopoietin-1 protects H9c2 cells from H2O2-induced apoptosis through AKT signaling[J].Biochem Biophys Res Commun,2007,359(3):685-690.
[10]Akazawa H,Komuro I.Cardiac transcription factor Csx/Nkx2-5:Its role in cardiac development and diseases[J].Pharmacol Ther,2005,107(2):252-268.
[11]Nakashima Y,Ono K,Yoshida Y,et al.The search for Nkx2-5-regulated genes using purified embryonic stem cell-derived cardiomyocytes with Nkx2-5 gene targeting[J].Biochem Biophys Res Commun,2009,390(3):821-826.
[12]Sabirzhanova I,Sabirzhanov B,Bjordahl J,et al.Activation of Tolloid-like 1 gene expression by the cardiac specific homeobox gene Nkx2-5[J].Dev Growth Differ,2009,51(4):403-410.
[13]Jay P Y,Harris B S,Maguire C T,et al.Nkx2-5 mutation causes anatomic hypoplasia of the cardiac conduction system[J].J Clin Invest,2004,113(8):1130-1137.
[14]Pashmforoush M,Lu J T,Chen Hanying,et al.Nkx2-5 pathways and congenital heart disease:loss of ventricular myocyte lineage specification leads to progressive cardiomyopathy and complete heart block[J].Cell,2004,117(3):373-386.
[15]Reamon-Buettner S M,Borlak J.NKX2-5:an update on this hypermutable homeodomain protein and its role in human congenital heart disease(CHD)[J].Hum Mutat,2010,31(11):1185-1194.
[16]Jamali M,Rogerson P J,Wilton S,et al.Nkx2-5 activity is essential for cardiomyogenesis[J].J Biol Chem,2001,276(45):42252-42258.
[17]David R,Stieber J,Fischer E,et al.Forward programming of pluripotent stem cells towards distinct cardiovascular cell types[J].Cardiovasc Res,2009,84(2):263-272.
[18]Gao X R,Tan Y Z,Wang H J.Overexpression of Csx/Nkx2.5 and GATA-4 enhances the efficacy of mesenchymal stem cell transplantation after myocardial infarction[J].Circ J,2011,75(11):2683-2691.
[19]Yamada Y,Sakurada K,Takeda Y,et al.Single-cell-derived mesenchymal stem cells overexpressing Csx/Nkx2.5 and GATA4 undergo the stochastic cardiomyogenic fate and behave like transient amplifying cells[J].Exp Cell Res,2007,313(4):698-706.
[20]Zhang Xi,Zhang Chuansen,Liu Yanchun,et al.Isolation,culture and characterization of cardiac progenitor cells derived from human embryonic heart tubes[J].Cells Tissues Organs,2009,190(4):194-208.
[21]Kim J H,Oh A Y,Choi Y M,et al.Isoflurane decreases death of human embryonic stem cell-derived,transcriptional marker Nkx2.5(+)cardiac progenitor cells[J].Acta Anaesthesiol Scand,2011,55(9):1124-1131.

