生理生化指标证实8 ℃为白银豆幼苗的临界生长低温*
王长春,张玉梅,杨 玲,胡海涛
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
温州白银豆,学名利马豆(Phaseolus lunatus L.),豆科棉豆属,起源于热带美洲,属喜温类蔬菜,对低温胁迫敏感[1].白银豆主产于浙江省温州瑞安市,因其籽粒营养丰富,富含蛋白质、脂肪、必需氨基酸,同时含有多种矿物质和维生素,而广受欢迎[2],已成为当地的一大支柱产业.浙江属于亚热带季风气候,春季天气回暖过程中常因冷空气的侵入使气温下降到8 ℃甚至5 ℃左右,这种倒春寒天气会导致白银豆遭受冷害,轻则产量受到严重影响,重则受害致死,严重制约了白银豆产业的发展.
确定植物的临界生长低温是深入研究植物抗冷性机理及改进植物抗冷性的基础.笔者借助电导率法并基于Arrhenius 图预估白银豆幼苗生长的临界低温是8 ℃[3].本文根据叶绿素含量、光合特性、保护酶活性与膜脂过氧化的动态变化,进一步证实8 ℃低温胁迫作为白银豆幼苗的临界低温是合理的.
1 材料与方法
1.1 材料培养及低温处理
温州白银豆(Phaseolus lunatus L)购自浙江省温州瑞安市荆谷白银豆合作社.饱满白银豆种子经20 g/L 次氯酸钠溶液消毒15 min,自来水流水浸泡4 h.种子分批播种至砂钵中,在光照培养箱中培养,28 ℃光照14 h(06:00 -20:00),光照强度为40 μmol·m-2·s-1,待第一真叶出现时,用1/2 的Hoagland 营养液(pH 5.8)进行水培.选取长势基本一致的白银豆幼苗,洗净根部沙子,一株一孔移栽,每隔2 d 更换28 ℃下温育的营养液.生长约2 周的白银豆幼苗,第1 片三出复叶展开时进行8 ℃低温处理,以28 ℃生长的幼苗为对照,分别于处理1,3,6,12 和24 h 时取其第1 片三出复叶的末端小叶,测定各项指标.
1.2 叶绿素含量测定
采用分光光度法[4].
1.3 荧光参数测定
用LI-6400 和荧光叶室6400-40(美国Li-Cor公司)测定第1 片三出复叶末端小叶的光系统Ⅱ(PSⅡ)最大光能转化效率(Fv/Fm)和电子传递效率(ETR).
1.4 超氧化物歧化酶(SOD)活性测定
称取0.5 g 叶片样品,在预冷的4 mL pH 7.8(0.05 mol·L-1)磷酸缓冲溶液中冰浴研磨,于4 ℃下8 000 r/min 离心15 min,取上清液采用氮蓝四唑(NBT)光还原法测定[5].用UV-1601 型分光光度计测定560 nm 波长下的吸光度,以抑制氮蓝四唑光还原的50%作为1 个酶活性单位.
1.5 过氧化物酶(POD)活性测定
愈创木酚法[5]测定POD 活性.测定系统含20 μL 酶提取液和3 mL 反应液(8 μL 愈创木酚、19 μL 30% H2O2溶液),用0.1 mol·L-1磷酸缓冲溶液(pH 6.0)定容至50 mL,在470 nm 波长进行比色,计算其单位时间内吸光度的变化,以1 min内A470减少1 的酶量为1 个活性单位.
1.6 丙二醛(MDA)含量测定
硫代巴比妥酸比色法[5]测定MDA 含量.
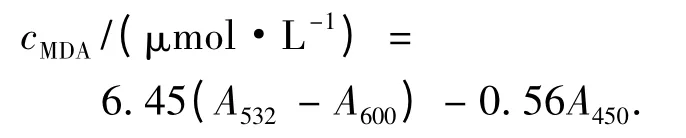
其中,A450,A532和A600分别代表450,532 和600 nm波长下的吸光度.
2 结果与分析
2.1 8 ℃低温胁迫对光合特性的影响
2.1.1 低温胁迫下叶绿素含量的动态变化
白银豆幼苗叶绿素含量在8 ℃低温处理1 h后大幅上升,3 h 时达最高;6 h 时略有下降,但与3 h 时相比无显著性差异(P <0.05);随后,含量迅速下降,24 h 与0 h 时含量无明显差异(见图1).8 ℃处理1 d 的叶片总叶绿素含量并不低于0 h 时,可能是因为叶片在低温光照下大量失水,含水量降低速度高于叶绿素分解速度的缘故.
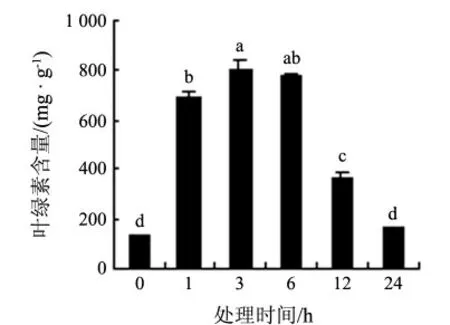
图1 8 ℃低温处理下白银豆幼苗叶绿素含量的变化
2.1.2 低温胁迫对光化学效率的影响
光系统Ⅱ(PSⅡ)对环境胁迫非常敏感.叶绿素荧光动力学参数可以很好地反映PSⅡ的结构和功能变化.最大光化学效率(Fv/Fm,可变荧光与最大荧光的比值)和电子传递速率(ETR)的大小体现了光系统光合能力的大小,是研究植物对逆境响应的重要的生理生态参数.8 ℃低温处理下,随时间的延长,白银豆幼苗叶片的最大光化学效率逐渐降低,但是在12 h 时有所回升,24 h 后降低到最低值(见图2);电子传递速率持续下降(见图3).低温胁迫使白银豆叶片PSⅡ原初光能转换效率下降,潜在活性中心受损,光合作用的原初反应受到抑制,导致光抑制产生.低温胁迫下电子传递的受抑,一方面可以将过剩的光能转化成Mehler 反应的激发能,导致活性氧的产生;另一方面,以分子态氧为受体的光合电子传递支路反应的增强也提高了活性氧的积累量.这些活性氧若不及时清除,必然造成氧化胁迫,引起膜脂过氧化,导致膜系统破坏.
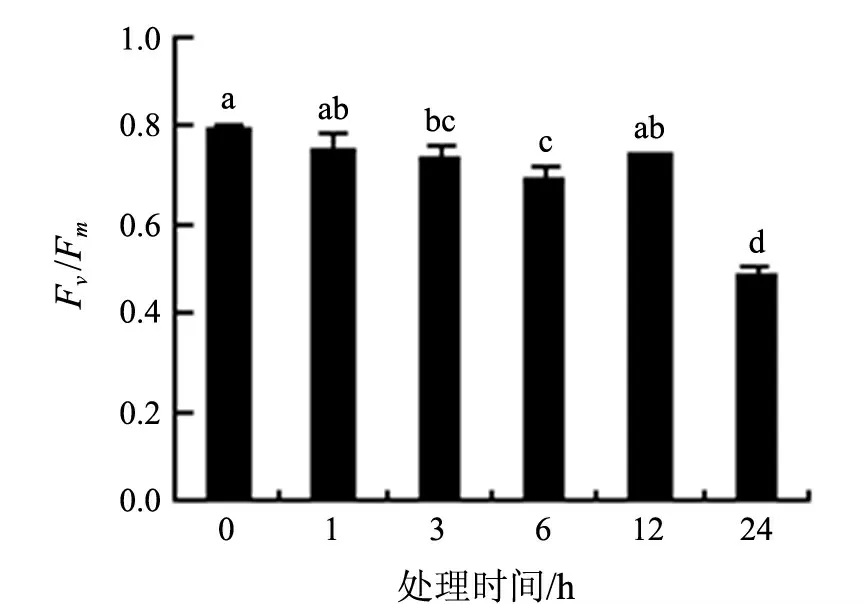
图2 8 ℃低温处理下白银豆幼苗最大光化学效率的变化
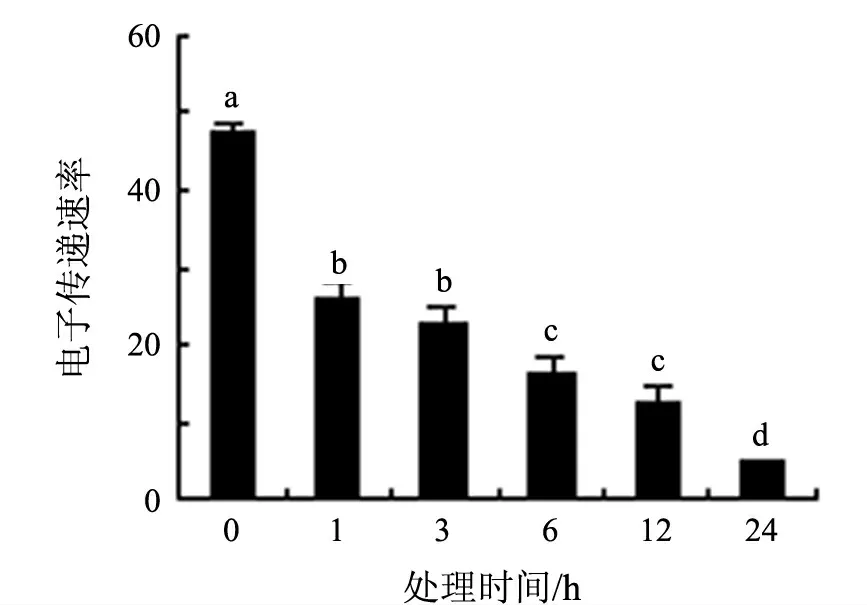
图3 8 ℃低温处理下白银豆幼苗电子传递速率的变化
2.2 8 ℃低温胁迫对白银豆抗氧化系统的影响
2.2.1 不同胁迫时间下SOD 活性的变化
超氧化物歧化酶(SOD)是生物体内普遍存在的参与氧代谢的一种含金属酶.由于该酶的活性大小与植物的衰老及抗逆性密切相关,是植物体内重要的保护酶之一[6].如图4 所示,8 ℃低温胁迫下,白银豆叶片的SOD 活性逐渐上升,6 h 达最大值,后逐渐下降,但都高于0 h 时.SOD 活性的升高,说明白银豆在8 ℃低温处理过程中具有维持体内活性氧分子产生与清除之间的动态平衡能力,保护植物体不受氧化胁迫.
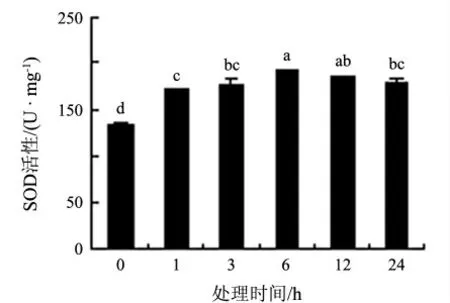
图4 8 ℃低温处理下白银豆幼苗SOD 活性的变化
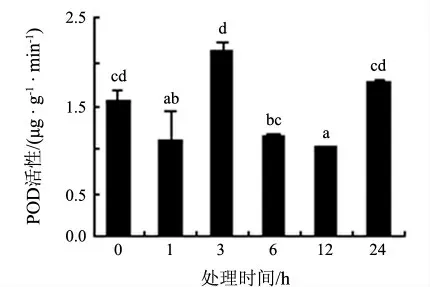
图5 8 ℃低温处理下白银豆幼苗POD 活性的变化
2.2.2 不同胁迫时间下POD 活性的变化
过氧化物酶(POD)能够清除逆境条件下由于膜脂过氧化而产生的活性氧自由基,保护生物膜不受损伤.POD 是植物在逆境条件下酶促防御系统的关键酶之一,它与SOD 和过氧化氢酶相互协调配合,清除过剩的自由基,使机体内的自由基维持在正常的动态水平,以提高植物的抗逆性[7].8 ℃低温胁迫下,白银豆叶片中POD 活性先下降、后上升,在3 h 时达到最大值,随后有所下降,处理24 h 时又上升达显著差异(见图5).
2.2.3 低温胁迫下MDA 含量的变化
植物器官衰老或在逆境下遭受伤害时,往往发生膜脂过氧化作用[8].常以丙二醛(MDA)含量来反映植物膜脂过氧化的水平和对细胞膜的伤害程度.从图6 可以看出,白银豆叶片MDA 含量于8 ℃低温处理后先上升,在3 h 时达最大值,然后逐渐下降,24 h 与0 h 时相比无明显差异.
2.3 8 ℃处理后白银豆叶片冷害症状的恢复
表型观察结果(见图7)显示:白银豆叶片在8 ℃低温处理24 h 后失水萎蔫,恢复正常温度培养后症状大大缓解,基本恢复正常;在6 ℃处理24 h 后失水更为严重,叶片皱缩、边缘卷缩,置正常温度培养24 h 后不恢复.

图6 8 ℃低温处理下白银豆幼苗MDA 含量的变化

图7 8 ℃,6 ℃低温处理前后及恢复正常温度培养后白银豆叶片的表型观察
3 讨论
细胞膜是细胞与环境发生物质交换的主要通道,是细胞感受环境胁迫最敏感的部位[9].低温冷害首先损伤细胞膜半透性,导致电解质渗漏率增加.Arrhenius 图折点对应的温度反映膜脂的相变温度[10],指示在此温度下膜结合酶活性的骤变及膜半透性的丧失.已有较多学者采用该法研究植物的抗冷性[10-12].笔者利用该法确定了白银豆叶片相对电导率的Arrhenius 图在8 ℃有一折点,因而视8 ℃为白银豆幼苗生长的临界低温[3].
单一指标不能正确反映植物的抗冷性实质,只有综合评价并采用多种方法印证,才能得出正确的结论.多数研究[12-13]表明:低温使膜系统的流动性降低,细胞内溶质外渗,水分散失[14];光合作用减弱,荧光增强;活性氧的产生和清除平衡体系被破坏,自由基(O2-,H2O2等)的增加进一步造成生物膜中脂质的过氧化或脱脂化[15-16];植物体为了自我保护,诱导SOD 等酶的活性增加,以清除活性氧自由基.
白银豆在8 ℃低温胁迫初期,SOD 和POD 活性上升,分别于胁迫3 h 和6 h 达到最大值,与对照相比差异显著.而MDA 含量在3 h 时上升到最高后逐渐下降,表明8 ℃处理3 h 时植物膜脂过氧化的水平最高,细胞膜的伤害程度最大,在光合作用方面表现出光合能力的下降,但是在活性氧清除系统的保护下,活性氧水平逐步下降,MDA含量在24 h 后下降到对照水平,植株抵御了低温的伤害.此外,白银豆在8 ℃处理后冷害症状可消失,恢复至处理前状态,说明白银豆在该温度下具有自我修复的能力,也印证了生理生化指标的准确性,说明8 ℃作为白银豆的临界低温是合理的.
[1]施宝女.温州白银豆[J].上海蔬菜,2001(3):10.
[2]徐少波,叶礼水,郑志兰.大粒利马豆高产栽培技术探讨[J].温州农业科技,1999(2):14-16.
[3]Zhang Y M,Wang C C,Hu H T,et al.Cloning and expression of three fatty acid desaturase genes from cold-sensitive lima bean (Phaseolus lunatus L.)[J].Biotechnol Lett,2011,33(2):395-401.
[4]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2004:134-136.
[5]于超.温度胁迫下番茄内质网ω-3 脂肪酸去饱和酶基因的表达和功能研究[D].泰安:山东农业大学生命科学学院,2009.
[6]王静,孙磊,张成军,等.杂交稻幼苗期对低温胁迫的生理反应[J].作物学报,2006,32(7):1049-1056.
[7]Frachebound Y,Haldimann P,Leipner J,et al.Chlorophyll fluorescence as a selection tool for cold tolerance of photosynthesis in maize (Zea mays L.)[J].Journal of Experimental Botany,1999,50(338):1533-1540.
[8]Dat J,Vandenabeele S,Vranová E,et al.Dual action of the active oxygen species during plant stress responses[J].Cell Mol Life Sci,2000,57(5):779-795.
[9]Gimalov F R,Baymiev A K,Matniyazov R T,et al.Initial stages of low-temperature induction of cabbage cold shock protein gene csp5[J].Biochemistry,2004,69(5):575-579.
[10]杨福愉,邢菁如,陈文雯,等.低温对耐寒与不耐寒玉米线粒体膜的影响[J].生物化学与生物物理学报,1982,14(5):521-524.
[11]杨玲,苏维埃.磷脂酰甘油的热致相变与水稻抗冷性[J].科学通报,1994,39(16):1522-1525.
[12]Raison J K,Chapman E A.Membrane phase changes in chilling-sensitive Vigna radiata and their significance to growth[J].Australian Journal of Plant Physiology,1976,3(3):291-299.
[13]Dolstra O,Haalstra S R,van der Putten P E L,et al.Genetic variation for resistance to low-temperature photoinhibition of photosynthesis in maize (Zea mays L.)[J].Euphytica,1994,80(1/2):85-93.
[14]Upchurch R G.Fatty acid unsaturation,mobilization,and regulation in the response of plants to stress[J].Biotechnology Letters,2008,30(6):967-977.
[15]Jiao Hongjun,Wang S Y.Correlation of antioxidant capacities to oxygen radical scavenging enzyme activities in blackberry[J].J Agric Food Chem,2000,48(11):5672-5676.
[16]Ali M B,Hahn E J,Paek K Y.Effect of temperature on oxidative stress defense systems,lipid peroxidation and lipoxygenase activity in Phalaenopsis[J].Plant Physiol Biochem,2005,43(3):213-223.

