牛传染性鼻气管炎的分离鉴定和灭活条件的优化
梁宏儒,高佳滨,李安,陈为宏,乔波,尹辉,胡旭,赵达,姜东君,朱战波
(黑龙江八一农垦大学动物科技学院,大庆 163319)
牛传染性鼻气管炎是由牛传染性鼻气管炎病毒(Infectious bovine rhinotracheitis virus,IBRV)引起的牛的一种急性、热性、接触性传染病,以高热、呼吸困难、鼻炎、鼻窦炎和上呼吸道炎症为主要特征,还能引起母牛流产和产死胎、成年牛肠炎和犊牛脑炎,有时引起结膜炎和角膜炎,继发性的细菌感染能导致更严重的呼吸道疾病[1-2],世界动物卫生组织将本病列为B 类疾病,也是我国进境动物的必检疾病之一。牛传染性鼻气管炎病毒也称牛疱疹病毒I 型(BHV-1),系球形有囊膜的双股DNA 病毒,直径约130~80 nm,对乙醚、氯仿、丙酮敏感。病毒在pH 6.9~9.0 时稳定,在pH 4.5~5.0 下可被灭活。病毒在4 ℃可保存1 个月,-60 ℃可保存9 个月,37 ℃存活10 d 左右,对冻干、冻融也很稳定,但在63 ℃以上数秒内可被灭活。目前通过基因分析和抗原鉴定一共发现3 种基因型:1、1.2 a、1.2 b。1 型病毒通常从侵染的鼻气管中分离,并能够从呼吸道和流产的胎儿中分离,该病毒主要流行于欧洲、北美和南美;1.2 a 型病毒能引起许多临床疾病,如呼吸道疾病、阴道炎、流产和龟头炎,目前多流行于巴西;1.2 b 型病毒与呼吸道疾病和阴道炎以及龟头炎有关,但是不会导致流产[3],致病力最弱。聚合酶链式反应(PCR)方法具有很高的灵敏度而能够在检测牛血清中微量的IBRV 的优点。特别是对IBRV 的潜伏感染的确诊,其特异性强。疫苗接种是最重要的预防和控制措施,其中灭活疫苗因在使用过程中具有较好的安全性,在种公牛、母牛和经济价值高的奶牛群中得到广泛应用[4]。
1 材料和方法
1.1 临床症状
2012年12 月黑龙江某牛场奶牛突然发病,病牛主要表现为体温升高、达41.5 ℃,精神萎顿,食欲减退近废绝,产乳量急剧下降,呼吸加快,伴有咳嗽、流泪、大量黏脓性鼻汁,鼻黏膜发炎,鼻唇镜高度充血呈红色,依据临床症状初步诊断为牛传染性鼻气管炎病毒感染。
1.2 病料的采集与处理
用无菌棉签采集发病牛鼻腔分泌物,将牛鼻腔棉拭子放入装有病毒分离运输培养基的灭菌离心管中带回实验室。在超净台内将采集的牛鼻腔棉拭子用少量运输培养基充分洗涤后,离心取上清液经0.22 μm 微孔滤膜过滤除菌,得到待分离病毒样品,放入-70 ℃保存备用。
1.3 细胞
MDBK 细胞由本实验室保存。
1.4 主要试剂
ExTaq 和dNTP 为TaKaRa 公 司 产 品;DNA Marker 为康为世纪科技(北京)有限公司产品;病毒基因组DNA 提取试剂盒为天根生化科技(北京)有限公司;胰蛋白酶、DMEM 为Gibco 公司产品;新生犊牛血清购自杭州四季青公司;甲醛为沈阳市华东试剂厂出品。
1.5 PCR 检测
根据参考文献[4]设计IBRV gB 基因序列引物,由上海生工生物技术有限公司合成。扩增片段大小为362 bp。引物序列为GH-1:GGCTCTACCGCACGGG CACCTCT,GH-2:GCGGCTCTCGTCTCGCAGCATTT。
按照天根生化科技(北京)有限公司病毒基因组DNA 提取试剂盒的操作步骤说明书提取病毒DNA模板。PCR 反应程序为:94 ℃预变性5 min,94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸1 min,共30 个循环,最后72 ℃延伸10 min。PCR 扩增产物在EB 浓度为0.5 μL·mL-1的1%琼脂糖凝胶电泳检测。
1.6 病毒分离
PCR 检测阳性的样品按照每孔100 μL 接种到长满单层MDBK 细胞的6 孔板上,37 ℃吸附1 h,倾去液体,加入维持液(含青霉素200 U·mL-1、链霉素200 μg·mL-1和20 mL·L-1血清的MEM 培养液),同时设置未接种的正常细胞做对照。在37℃、5%的CO2培养箱培养,每天早、中、晚3 次观察细胞病变(CPE),待70%细胞出现CPE 时收毒,于-20 ℃反复冻融3 次,收毒后再传代3 次使病毒增殖稳定,于-70 ℃保存。如果细胞不出现CPE 时,盲传3 代,观察细胞病变。
1.7 分离病毒株组织细胞半数感染量(TCID50)的测定
取增殖性质稳定的第4 代分离株病毒液100 μL用无血清的DMEM 培养液,在灭菌离心管中10 倍系列稀释到10-8。在96 孔细胞培养板中四周各空一行,每个滴度6 个孔,每孔100 μL 稀释的病毒液,设置一列仅加入维持液为阴性对照,然后每孔加入消化分散的MDBK 细胞悬浮100 μL,四周空白孔添加200 μL 无菌PBS,混匀后置于37 ℃CO2培养箱观察5 d,记录细胞病变的孔数,按照Reed-Muench 法计算TCID50。
1.8 病毒灭活条件的优化
1.8.1 毒液灭活浓度和时间的筛选
每瓶病毒液中分别加入不同浓度的甲醛溶液,先用PBS 溶液(平衡液)将40%的甲醛溶液稀释为10%的甲醛溶液。然后根据要求向病毒液中缓慢加入10%的甲醛稀释液,混合液甲醛溶液的终浓度(V/V)分别为0.1%、0.2%、0.3%、0.4%,充分振荡混匀后放置37 ℃恒温箱中进行灭活。不同甲醛浓度的病毒液分别在37 ℃灭活12、24、36、48 h 后进行灭活效果检验。在灭活过程中,振摇病毒液数次。然后,进行无菌检验,确定甲醛溶液灭活的最佳浓度和时间。
1.8.2 灭活效果的检验
灭活后,取病毒悬液接种于单层的MDBK 细胞,加入含2%新生犊牛血清的维持液并观察4 d。4 d 后如未观察到细胞病变(CPE),以相同方法进行第2 代盲传,继续观察4 d,如仍未见CPE 表明病毒液灭活完全。
2 结果
2.1 PCR 检测结果
样品细胞培养液的PCR 扩增产物经1.0%琼脂糖凝胶电泳,在362 bp 处出现明显条带,片段大小与预期相符,说明该细胞培养液IBR 阳性。如图1 所示:
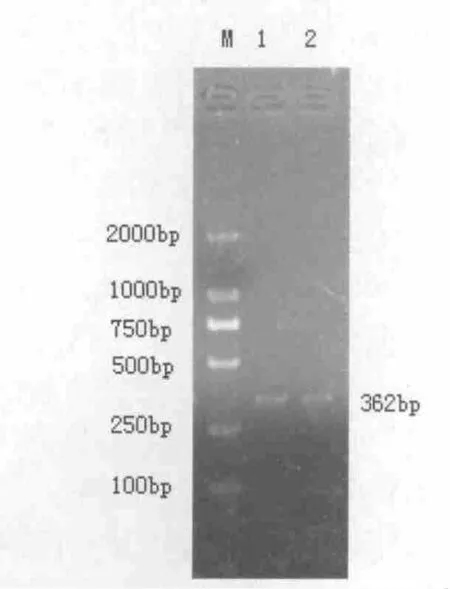
图1 IBRV gB 基因序列PCR 扩增Fig.1 The glycoproteinB(gB)gene of the infectious bovine rhinotracheitis virus
2.2 病毒分离和增殖结果
病毒株盲传一代18 h 后就出现细胞病变(CPE)现象,即细胞变圆和中间空洞的蜘蛛网状。有些呈聚集成葡萄串样,有些呈散在排列,有些卷缩成块飘落在培养液中。
病毒接种24 h 后,细胞出现圆缩,32 h 出现明显CPE,48 h 超过70%的细胞出现CPE(图2),说明MDBK 细胞对于IBRV 较为敏感,可以用于病毒增殖相关试验研究。
2.3 TCID50 检测结果
采用Reed-Muench 法测定该分离株病毒的TCID50 为10-5.5·0.1 mL-1。

图2 IBRV 病毒在MDBK 细胞Fig.2 IBRV virus in MDBK cells
2.4 灭活效果检验结果
灭活后病毒样品接种96 孔板MDBK 细胞,分别于12、24、36、48 h 观察细胞病变情况。结果显示:终浓度为0.1%的甲醛溶液灭活48 h 后未灭活完全,终浓度为0.2%的甲醛灭活36 h 后灭活完全,终浓度为0.3%的甲醛灭活24 h 后灭活完全,终浓度为0.4%的甲醛灭活18 h 后灭活完全。结合TCID50 的测定结果,选择用0.2%甲醛灭活的病毒接种未发生病变的MDBK 细胞以相同方法进行第2 代盲传,继续观察4 d,仍未见CPE,效果较好。
3 讨论
从20 世纪50 年代初发现本病至今,各大洲都有发生的报道,IBR 在全球范围内广泛存在。病畜及带毒畜为主要传染源。牛感染该病后,在自然条件下可不定期排毒,这对该病的传播流行起着重要的作用[5]。IBRV 在致病性方面最大的特点是其组织嗜性宽广,除侵害呼吸系统外,还能侵袭多种器官和组织,引起多种临床症状[6],给养牛业造成较大的经济损失,是进口牛和精液时经常关注的一种疫病。
根据临床症状,病理变化和流行病学可作出初步诊断,但是若要确诊IBRV 感染,尤其在新发生地区,必须依靠实验室诊断方法。常用的实验室诊断方法有:病原分离鉴定、包涵体检查、病毒鉴定与检测、特异性抗体的检测(血清中和试验、酶联免疫吸附试验、琼脂扩散试验、间接血凝试验、变态反应)。检测IBRV 抗原和抗体的方法很多,但存在不同程度的缺陷。或检测灵敏度不够,或费时费力,或有假阳性出现。随着分子生物学技术的发展,特别是以PCR 为基础的各种检测方法提高了检测的敏感度和准确度,缩短了检测时间,弥补了原有的血清学检查方法的众多缺陷[7]。常用的分子生物学诊断方法有:聚合酶链式反应、核酸探针法、限制性核酸内切酶分析。
牛肾细胞对酸性环境的耐受性小,在pH 6.6~6.8的营养液或维持液中培养,易于衰老死亡,尤其初代培养细胞对酸性环境更为敏感,培养过程中应注意pH 值的调节。细胞在有营养液或维持液保护的环境中,对低温和高温的耐受力均强,在无营养液保护时,对温度特别是对低温十分敏感,尤其是低温溶液直接作用于细胞,可迅速引起圆缩,拉网,甚至完全脱落死亡[8]。
实验中发现IBRV 接种于细胞单层后,前几代往往不到24 h 就都脱落了,但随着传代次数的增加,病变和脱落的时间会相对稳定在24~48 h,这是因为前几代时病毒还不适应细胞。等适应后会逐渐稳定下来,实验中接毒后病毒在细胞上吸附的时间也很重要,吸附时间短,病毒和细胞没有充分的结合,因而得到的病毒含量也会降低。通过实验我们认为接毒后吸附1.5 h,病毒才能充分与细胞相结合,这样获得的病毒液的病毒含量较高。
灭活方法的研究首先需确定考察指标,然后据此选择合理的灭活剂种类及其浓度及灭活的时间。甲醛和β-丙内酯均常用于灭活疫苗的生产。甲醛灭活病毒的原理是甲醛的醛基作用于微生物的氨基产生经甲基氨,作用于梭基形成亚甲基二醇单醋,作用于经基生成经基甲酚,作用于硫基形成亚甲基二醇,在这种情况下经甲基代替敏感的氢原子破坏生命的基本结构导致微生物死亡,但不明显影响其免疫原性[9]。灭活病毒可用质量分数为0.05%~0.4%,常用质量分数为0.1%~0.3%,处理条件为37~39 ℃24 h 以上[10]。而β-丙内酯(BPL)在国外已广泛用于各种疫苗的灭活,对病毒具有很强的灭活作用。直接作用于病毒核酸,保持免疫原性,强灭活效果;极易水解,无残留,并且水解产物无毒无害。灭活时间短,缩短了疫苗的生产周期,提高了经济效益。但与甲醛相比,如用β-丙内酯应使用98%以上浓度的新试剂,β-丙内酯保存时间过长引起自身聚合,影响灭活效果且β-丙内酯价格明显昂贵,不适用于发展中国家或经济落后国家。
病毒灭活后验证其灭活效果应同时考虑灭活效果和灭活方法及参数对产品质量的影响两方面的验证,应采用最敏感的检测方法来验证无活病毒。可直接采用动物法,观察接种动物的存活情况,也可采用敏感细胞盲传2 代,对每代细胞进行检测,同时还要验证灭活条件对疫苗抗原含量、效价等的影响。
4 结论
PCR 检测方法特异快速的检测出样品为阳性,即样品中存在牛传染性鼻气管炎病毒。对增殖后的牛传染性鼻气管炎病毒分别用0.1%、0.2%、0.3%、0.4%的甲醛灭活后于12、24、36、48 h 接种于MDBK细胞观察细胞病变情况,比较后的研究结果表明,浓度为0.2%的甲醛在37 ℃灭活36 h 对牛传染性鼻气管炎病毒的灭活效果最好。
[1] 殷震,刘景华.动物病毒学[M].2 版.北京:科学出版社,1997.
[2] Nandi S,Kumar M,Manohar M,et al.Bovine herpes virus infections in cattle[J]. Anim Health Res Rev,2009,10(1):85-98.
[3] Gibbs E P J,Rweye M M.Bovine herpesvirus[J].Vet Bull,1977,47:317-343.
[4] Yates W D G.A review of infectious bovine rhinotracheitis,shipping fever pneumonia and viral bacterial synergism inrespiratory disease of cattle[J]. Can J Comp,1982,46:225-263.
[5] 陈婷. 牛传染性鼻气管炎病毒gD 基因原核表达及间接ELISA 检测方法的建立[D].杨凌:西北农林科技大学,2012.
[6] 李玉恒,赵明慧,赵紫阳,等.利用梯度PCR 和降落PCR扩增CIRP 基因的比较[J].黑龙江八一农垦大学学报,2011,23(5):43-46.
[7] 王冰. 针对gG 基因的牛传染性鼻气管炎病毒新型检测方法建立和应用[D].武汉:华中农业大学,2011.
[8] 王延涛. 牛传染性鼻气管炎病毒分离鉴定及其单克隆抗体制备[D]. 大庆:黑龙江八一农垦大学,2008.
[9] 张穗.福尔马林沉淀的简易解聚法[J].中国消毒学杂志,1990,7(1):30.
[10] 韩友圻.甲醛对细菌和病毒的杀灭作用研究进展[J].中国消毒学杂志,1990,7(1):31-36.

