干扰DNA-PK和CHK1表达对卵巢癌细胞辐射凋亡影响的研究
廖 琪,崔满华
(1.大庆龙南医院,黑龙江 大庆163453;2.吉林大学第二医院 妇产科,吉林 长春130041)
卵巢癌是威胁女性健康最常见的恶性肿瘤之一[1],由于发病隐匿,早期症状不明显而致诊断困难,发现时多已有广泛的盆腹腔转移。其病死率最高,且发病率呈逐年上升的趋势。本研究以shRNA干扰DNA-PK和CHK1在卵巢癌Skov3细胞中的表达,观察给予辐射后细胞凋亡变化情况,探讨相关辐射损伤机制。
1 材料与方法
1.1 细胞培养
Skov3细胞用含10%小牛血清的DMEM培养基培养,青霉素100U/ml,链霉素100μg/ml,置于5%CO2培养箱中。转染前一天,以3×105个细胞/孔接种于6孔培养板。
1.2 载体构建和筛选
根据DNA-PK和CHK1基因构建4个shRNA载体,并以无关序列 GTTCTCCGAACGTGTCACGT构建对照载体shNC。经限制性内切酶和测序鉴定,转染Skov3细胞筛选出有效shRNA载体,其靶向序列分别是GGAATAGTACTTACTGCAATG、GCATTGGAATTATCTCAAAGC。将有效的shRNA载体以脂质体Lipofectimines 2000介导转染细胞,质粒、脂质体的比例为2μg∶5μl。
1.3 照射条件及流式检测
转染shRNA后20h,Skov3细胞接受X-射线照射。照射采用飞利浦深部X-线治疗机,电压200 kV,电流10mA,过滤器铜0.5mm,铝1.0mm;剂量率0.287Gy/min,总量为2Gy。X-射线照射前用PBS洗细胞,加2ml PBS后进行照射;照射后,立即更换新鲜的完全培养基,即转染后24h或48h收集细胞,PBS洗3次,每次离心800rpm,5min。加AnnexinV/PI染色10min,PBS洗3次。应用BD FACSCalibur流式细胞仪检测、分析细胞凋亡,应用Modifit软件进行统计。
1.4 统计学方法
应用SPSS14软件进行统计分析,平均值±标准差(±s)的比较采用t检验,以P<0.05为有统计学意义。
2 结果
X 射线照射后4hr,转染 DNA-PK shRNA-5297和CHK1shRNA-617的Skov3细胞凋亡百分数为24.80%±3.20%,显著高于单纯转染DNAPK shRNA-5297 + CHK1shRNA-617 组 (t=4.7365,P=0.0008),显著高于转染shNC+radiation组(t=5.9663,P=0.0001),显著高于 Control组、shNC组、radiation组(t=18.6358,t=9.6229,t=16.9786,P<0.001)。X射线照射后28hr时,转染 DNA-PK shRNA-5297和CHK1shRNA-617的Skov3细胞凋亡百分数为18.91%±2.81%,显著高于单纯转染 DNA-PK shRNA-5297 +CHK1shRNA-617组(t=4.1306,P=0.0020),明显高于转染shNC+radiation组(t=6.0371,P=0.0001),显著高于 Control组、shNC 组、radiation组(t=15.9068,t=9.7317,t=15.5251,P<0.001)。见表1。
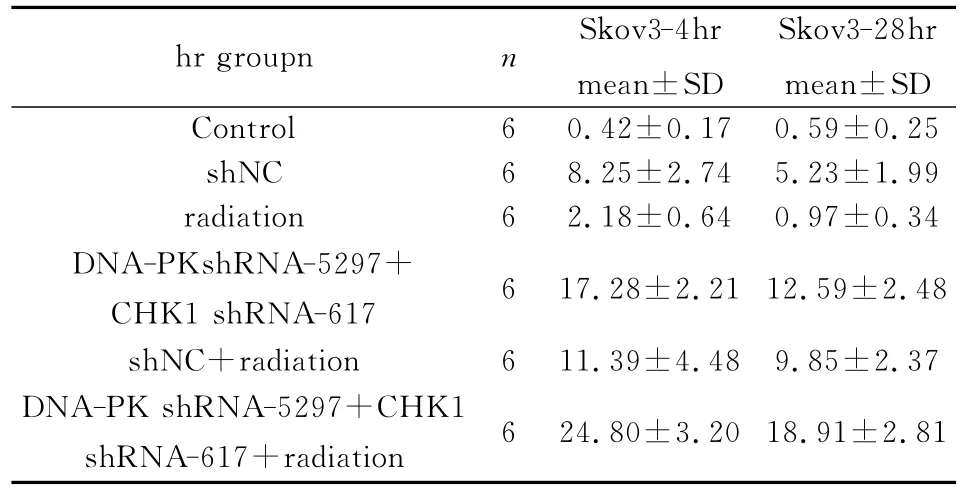
表1 X射线照射对转染DNA-PK shRNA-5297和CHK1 shRNA-617的Skov3细胞凋亡影响
3 讨论
DNA损伤应答(DNA damage response,DDR)是一个异常复杂的调控系统,是细胞内一种非常保守的抵御外界及内在因素诱导的DNA损伤的机制,对肿瘤的发生、发展及治疗具有重要的作用。
DNA 依赖的蛋白激酶(DNA-dependent protein kinase,DNA-PK)是完成非同源末端连接DNA双链断裂修复途径的关键酶,同时参与DNA复制的调控、作为转录因子调节基因的表达、维持染色体端粒结构的稳定、参与细胞的凋亡等诸多作用。DNA-PK由两个调节亚基 Ku70、Ku80和一个DNA依赖的蛋白激酶催化亚单位(DNA-dependent protein kinase catalytic subunit,DNA-PKcs)组成。当发生DNA双链断裂后,DNK-PKcs在Ser2056和Thr2609残基自磷酸化后,离开Ku而与γH2AX和53BP1共同结合在DNA双链断裂处[2]。Ku70和Ku80识别并结合于每一条DNA链断端,Ku蛋白本身具有的解螺旋酶活性使两个断端局部发生解链,并可以保护游离的DNA末端避免被核酸酶分解,形成的Ku-DNA复合物吸引DNA-PKcs等到损伤部位完成结合并被激活,将两个DNA断端直接连接,完成修复后DNA-PK即发生自身磷酸化,DNA-PK复合体从DNA链上解离[3]。对于不能修复的DNA损伤或者端粒变短,DNA-PK可诱导细胞进入凋亡程序[4]。
检查点激酶1(checkpoint kinase,CHK1)是一种高度保守的丝氨酸/苏氨酸蛋白质激酶,是非常重要的细胞周期检查点激酶。CHK1基因位于染色体11q24,其cDNA全长1891bp,编码由476个氨基酸组成的蛋白,分子量54kD,其蛋白在多种组织均有表达,在胞浆和胞核均有表达,但主要在细胞核内发挥作用。CHK1的活性结构域包括两个亚结构域:含有88个氨基酸残基以β折叠构成N端结构域和210个氨基酸残基以α螺旋结构组成C端结构域。活性位点位于这两个亚结构域的连接区上[5]。DNA受损后活化CHK1,致使细胞阻滞在S期、G2/M期检查点,使受损的DNA得以修复,从而维持基因组的完整性;若损伤广泛而无法修复时则会诱导凋亡。CHK1还参与染色质和纺锤体装配。有研究提示,多种肿瘤组织及细胞系中CHK1高表达,与肿瘤的耐药及不良预后有关。
本研究提示DNA-PK和CHK1参与DNA损伤修复过程,包括识别DNA损伤位点,启动修复程序,调控转录和凋亡。因此,应用shRNA技术沉默Skov3细胞中DNA-PK和CHK1的表达,可以明显提高卵巢癌细胞对辐射的敏感性,不仅对相关辐射损伤机制进行了初步探讨还为卵巢癌的治疗提供了新方向。
[1]Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277.
[2]Yang J,Yu Y,Hamrick HE,Duerksen-Hughes PJ.ATM,ATR and DNA-PK:initiators of the cellular genotoxic stress responses[J].Carcinogenesis,2003,24(10):1571.
[3]Collis SJ,DeWeeseTL,JeggoPA,etal.The life and death ofDNAPK[J].Oncogene,2005,24(6):949.
[4]Mi J,Dziegielewski J,Bolesta E,etal.Activation ofDNA-PK by ionizing radiation Is mediated by protein phosphatase 6[J].Plos One,2009,4(2):4395.
[5]Zhao B,Bower MJ,McDevitt PJ,et al.Structural basis for Chkl inhibition by UCN-01.J Biol Chem,2002,277(48):46609-46615.

