猪CCKAR基因两SNP位点的遗传多态性分析
彭 兴,谭岳华,黄生强*
(1. 湖南农业大学 动物科学技术学院,湖南 长沙 410128;2. 畜禽遗传改良湖南省重点实验室,湖南 长沙 410128;3. 广西扬翔农牧有限责任公司,广西 贵港 537100)
随着人们生活水平的不断攀升,消费者对猪肉的品质要求越来越高。20世纪70 年代以来,由于人们在分子数量遗传学、分子生物学技术方面的不断发展和完善人们发现尽管基因的编码区是相对保守的序列。但在漫长的生物进化过程中,由于环境和机体的相互作用, 不可避免地产生了基因编码区和调控区种属间的差异和种属内的变异,构成了基因的多态性。基因组DNA 中单个碱基的颠换或转换产生了单核苷酸多态性 (single nucleotide polymorphism,简称SNP),从而致使基因多态性的出现。基因的多态性又决定了其蛋白的多态性,进而影响基因的功能。伴着基因组学和SNP 检测技术[1]的发展,使得现在对SNP 位点的研究达到了一个新的高度。
猪缩胆囊素受体基因[2],定位于猪八号染色体上[3],与人类的同源性达到90%以上[4]。大量实验证明胆囊收缩素A 受体基因(cholecystokinin type-A r eceptor,简称 CCKAR)与动物的日采食量和平均日增重有明显的关联[5-9]1555,Takiguchi 通过研究还发现CCKAR 基因能维持动物体内的血糖浓度[10]。本研究以杜洛克、大白、长白3 个外来品种及其杂交得到的品系杜长大(DLY),湖南省4 个地方品种:宁乡猪、大围子猪、沙子岭猪、桃源黑猪和海南地方猪五指山猪共9 个品种/群体为研究对象,采用PCR-RFLP 方法分析了CCKAR 基因+179A/G 位点和+471C/G 位点的遗传多态性及基因频率和基因型频率以及该基因多态性以揭示我省不同猪群的基因多样性。此试验研究目的重点在于利用分子遗传学和数量遗传学知识作为技术手段,以CCKAR 基因为目的研究基因,探讨CCKAR 基因不同SNP 位点的遗传多态性,为进一步研究CCKAR 基因与猪肉质性状和生长性状的关联分析提供理论基础。
1 材料与方法
1.1 材料
本研究中的试验猪为益阳农科所种猪场和正虹种猪场提供,共计9 个品种/群体687 头猪。其中地方品种包括宁乡猪22 头、桃源黑猪133 头、大围子猪72 头、沙子岭猪69 头,海南五指山猪65 头;外来品种含杜洛克猪94 头、大白猪104 头、长白猪69 头、杜长大杂交猪59 头。采取供试猪耳组织并提取DNA。
1.2 方法
1.2.1 CCKAR 基 因+179A/G位点和+471C/G 位点基因PCRRFLP
根据GenBank DQ496228 序列设计CCKAR 基 因+179A/G 位 点和+471C/G 位点PCR,以猪基因组DNA 为模板进行扩增。


+179A/G 位点引物F 和R 序列:
上游引物F:
CTTGGGAGACTCTGCAGTCC
下游引物R:
GGGCTGATCCAAACAGAAAA
+471C/G 位点引物F'和R'序列:
上游引物F':
TGAATGGGAGCAACATCACT
下游引物R':
CATCCTCTTGTTTCGAATCAGC
取扩增产物进行电泳验证,对CCKAR 基因+179A/G 位点和+471C/G 位点扩增的目的片段进行回收纯化。然后分别利用限制性内切酶 Hpy8I 和SatI 进行酶切,并将酶切产物进行聚丙烯酰胺凝胶电泳以进行基因型的判定。
1.2.2 CCKAR 基 因+179A/G 位点和+471C/G 位点基因统计学分析
统计CCKAR 基因+179A/G 位点及+471C/G 位点2 个不同SNP 位点基因型检出个体数,计算群体遗传纯合度、遗传杂合度、有效等位基因数和多态信息含量以及Hpy8I 和SatI 酶切位点的基因型频率和基因频率,并进行卡方(χ2)检验。
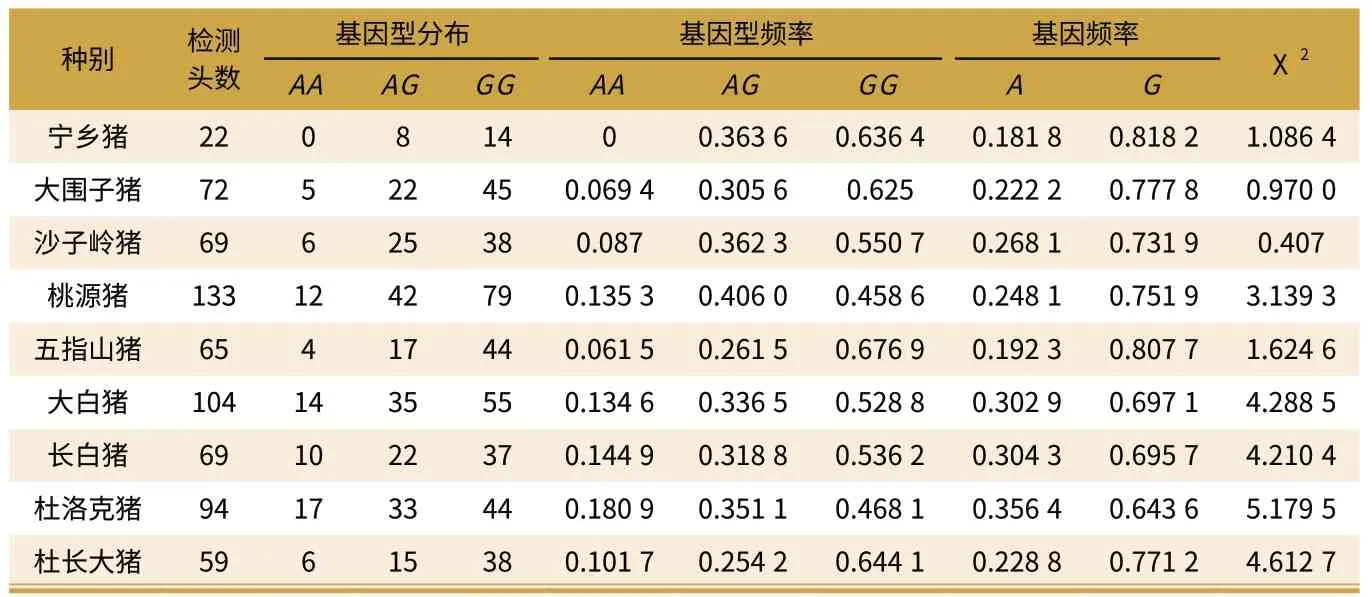
表1 不同品种CCKAR 基因+179A/G 位点的Hardy-Weinberg 平衡检验

表2 不同品种CCKAR 基因+179A/G位点多态性
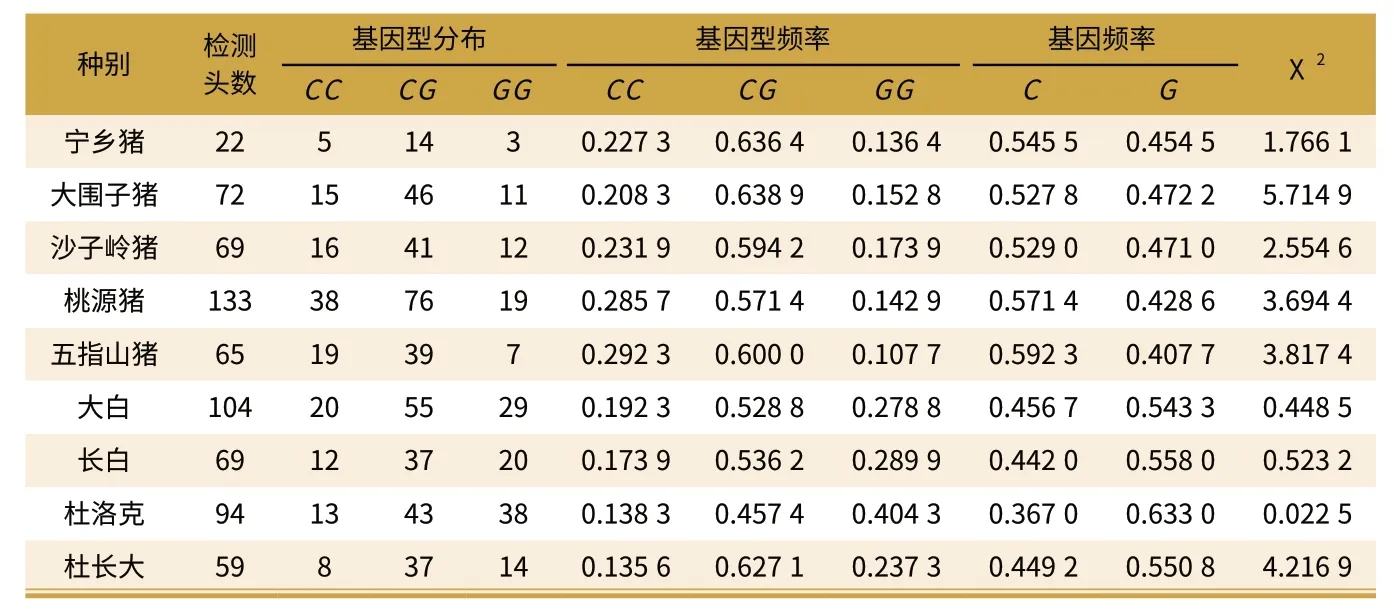
表3 不同品种 CCKAR 基因+471C/G 位点的Hardy-Weinberg 平衡检验
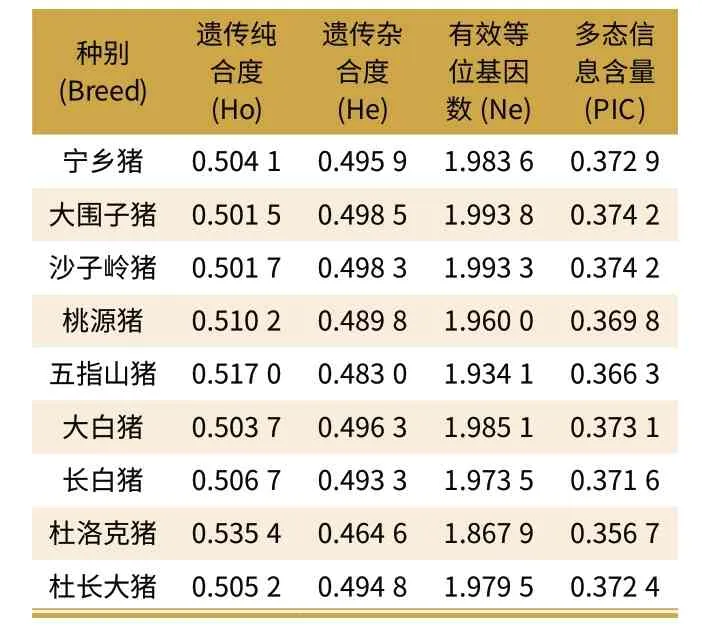
表4 不同品种CCKAR 基因+471C/G位点多态性
2 结果与分析
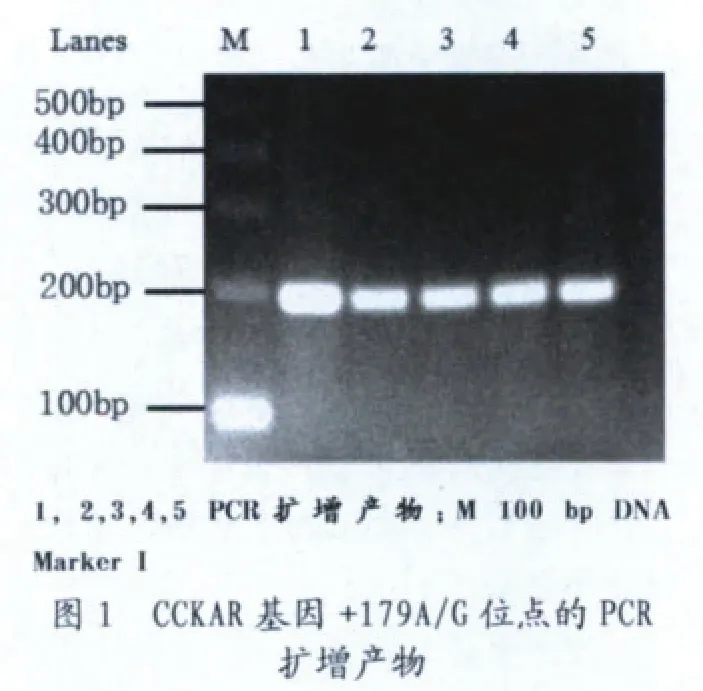
2.1 CCKAR 基 因+179A/G 和+471C/G 两 位 点 的PCR 扩 增 及RFLP 结果
2.1.1 CCKAR 基 因+179A/G 和+471C/G 两位点PCR 扩增产物的检测
利用PCR 技术,从猪基因组DNA扩增得到包含CCKAR 基因+179A/G位点和+471C/G 位点2 个片段的长度分别为200 bp 和900 bp。这2 个片段经电泳检测与预期结果一致(见图1 和图2)。并对产物进行纯化回收准备用于下游实验。
2.1.2 CCKAR 基 因+179A/G 和+471C/G 两位点的RFLP 结果
对CCKAR 基 因+179A/G 位 点扩增产物用限制性内切酶Hpy8I 酶切,再通过聚丙烯酰胺凝胶电泳对酶切产物进行检测,结果显示:在CCKAR 基因+179A/G 位点上存在3 种基因型 AA基因型(110 bp、90 bp)、AG 基因型(110 bp、90 bp、55 bp、55 bp)和GG基因型(90 bp、55 bp、55 bp)(见图3)。
对CCKAR 基因+471C/G 位点扩增产物用限制性内切酶SatI 酶切,再通过1.5%琼脂糖凝胶电泳对酶切产物进行检测,结果显示:在CCKAR 基因+471C/G 位点上存在3 种基因型:CC基 因 型(500 bp、300 bp、100 bp)、CG基因型(500 bp、300 bp、100 bp、280 bp、220 bp)和GG基因型(300 bp、280 bp、220 bp、100bp)(见图4)。
2.2 猪CCKAR 基因不同位点的遗传结构分析
2.2.1 CCKAR 基 因+179A/G 位点的Hardy-Weinberg 平衡检验和位点多态性
按 照 公 式p=D+H/2 与q=R+H/2,分别计算CCKAR 基因+179A/G 位点 (Hpy8I 酶切位点)在各品种中等位基因A 和等位基因G 的频率,并对9 个猪品种/品系样本Hpy8I 酶切位点的基因型分布进行卡方检验(见表1)。
由表1 可以看出,5 个地方品种(宁乡猪、大围子猪、沙子岭猪、桃源猪、五指山猪)的等位基因G 的频率均高于3 个外来品种(杜洛克猪、长白猪、大白猪)且宁乡猪等位基因G 的频率最高达到了0.818 2。从基因型的分布看,GG 型在地方品种、外来品种和杜长大杂交种中均为主要基因型,其中五指山猪GG 基因型频率最高(0.707 7);AA基因型在各品种中的都比较少,其中宁乡猪中没有检测到AA 基因型,这有可能是由于样本含量太小所致。
由表2 可以看出,CCKAR 基因+179A/G 位点上所有品种的遗传纯合度均高于0.5,其中宁乡猪的遗传纯合度最高(0.702 5),杜洛克猪的遗传纯合度最低(0.541 3),遗传杂合度正好相反。从有效等位基因数上看,3 个外来品种的有效等位基因数均高于地方品种,其中杜洛克猪的最高(1.847 6)宁乡猪的最低(1.423 5);从多态信息含量上看,各个品种多态信息含量都处于0.25 到0.50 之间,说明在该位点上各品种具有遗传多态性,且遗传变异较大。
2.2.2 CCKAR 基 因+471C/G 位点的Hardy-Weinberg 平衡检验和位点多态性
按照上述方法计算CCKAR 基因+471C/G 位点 SatI 酶切位点上的各品种等位基因C 和等位基因G 的频率,并对9 个猪品种/品系样本SatI 酶切位点的基因型分布进行卡方检验(见表3)。
由表3 可以看出,在5 个地方品种中,CC 基因型频率均高于GG 型基因频率;而在外来品种和杜长大杂交群当中正好相反。在实验所检测的9 个猪品种中大围子猪CG 基因型频率最高(0.638 9),杜洛克猪CG 基因型频率最低(0.457 4)。从等位基因分布频率来看,在5 个地方品种中五指山猪等位基因C 基因频率最高(0.592 3);在3 个外来品种中杜洛克猪G 基因频率最高(0.633 0);在杜长大杂交猪中,等位基因G 基因频率为0.550 8。
从表4 不难发现,在CCKAR 基因+471C/G 位点上所有品种的遗传纯合度相差不大且均略高于0.5。其中杜洛克猪的遗传纯合度最高(0.535 4),大围子猪的遗传纯合度最低(0.501 5);从有效等位基因数上看,所有品种的有效等位基因数都比较高,其中大围子猪的有效等位基因数最高(1.993 8),杜洛克猪的有效等位基因数最低(1.867 9);从多态信息含量上看,各个品种多态信息含量都处于0.25 到0.50 之间。
3 讨论与结论
随着这些年传统表型选育持续进行,分子育种技术也在不断地进步,在育种中的应用也逐渐增加[11]。猪CCKAR 基因能够控制动物的进食量、饱感以及肥胖,被认为是猪生产性能的候选基因[5]。本试验还对2 个SNP 位点进行了Hardy-Weinberg 平衡检验,发现所有品种都处于Hardy-Weinberg平衡状态,说明了所采样本来自一个孟德尔群体,采样具有代表性。
从猪CCKAR 基因+179A/G 位点的遗传分析结果可以看出:不论是在地方猪种、外来品种还是杂交品种中,等位基因G 都是优势基因。外来品种中G 等位基因频率都比地方品种中G 等位基因频率低,究其原因可能是由于地方品种相对于外来品种在进化过程当中保守程度不一所造成的,也有可能是由于地方品种和外来品种的不同选育方法和程度所造成。在所检测的9 个品种中,GG 型基因型为优势基因型,AA基因型在各品种中分布较少,其中宁乡猪中没有检测到AA 基因型,这可能是由于样本采集过于集中或者含量太小所致。在除宁乡猪以外的8 个猪种群体中,CCKAR 基因+179A/G Hpy8 I 酶切位点均存在较丰富的遗传多态性,但多态分布程度有一定的差异,这可能与猪种的选育、猪品种在该位点遗传品质的纯合性、进化的保守性等有关。
CCKAR 基 因+471C/G 位 点 的遗传分析结果表明:在基因型分布上,CG 基因型分布占所有品种的比重为56%为优势基因型;所有品种在该位点上的C、G 等位基因频率相差不大。在地方猪种中,等位基因C 为优势基因;在外来品种和杂交品种中,等位基因G为优势基因。在地方品种中CC 基因型频率比GG 基因型频率高,而在外来品种中则出现了相反的现象。造成此现象的原因可能是因为外来品种和杂交品种是经长期人工选育而来,人为的选择增加了有利于提高生长速度的G 等位基因的频率,而地方品种中由于选育程度较低,所以G 等位基因频率相对要低。这也正符合Houston 等人的研究发现,+471C/G 位点与日采食量和平均日增重密切相关,且+471G 相对于+471C等位基因的猪具有更快的生长速度和更大的食欲[5]1561。所有品种多态信息含量都处于0.25 到0.50 之间,说明在该位点上各品种具有较丰富的遗传多态性,且遗传变异较大。该位点C、G 等位基因在所有地方品种和外来品种中都普遍存在,说明该位点的碱基取代应该发生在品种分化之前。
本实验研究了9 个品种,共计687头猪CCKAR 基因+179A/G Hpy8I酶切位点和+471C/G SatI 酶切位点的基因频率和基因型频率,为研究猪CCKAR 基因与猪肉质、胴体等经济性状的关联分析提供了很好的材料。
[1] Uimari P, Sironen A, Sevón-A i m o n e n M L, e t a l. W h o l egenome SNP association analysis of reproduction traits in the Finnish Landrace pig breed[J].Genetics Selection Evolution,2011, 43:42.
[2] Wank S A, Harkins R, et
al. Purification, molecular cloning , and functional expression of the cholecystokinin receptor from rat pancreas [J].Biochemistry,1992,89,3125-3129.
[3] Clutter A.C,Sasaki S,Pomp D.Rapid communication: the cholecystokinin type-A receptor (CCKAR) gene maps to porcine chromosome 8[J].J Anim Sci,1998,76:1983-1984.
[4] De Weerth A, Pisegna J R, et al. Molecular cloning,functional expression and chromosomal localizati on of the human cholecystokinin type a receptor[J].Biochem Biophys Res Commun,1993,194(2):811-818.
[5] Houston R D, Haley C S, Archibald A L, et al. A Polymorphism in the 5’-Untranslated Region of the Porcine Cholecystokinin Type A receptor gene affects feed Intake and growth[J]. Genetics Society of America, 2006(10):1555-1562.
[6] Gibbs J,Young R C, Smith G P,et al.Cholecystokinin decreases food intake in rats[J].Journal of Comparative and Physiological Psychology,1973, 84(3):488-495.
[7] Crawley J N,et al.Cholecystokinin dopamineinter actions[J].Trendsin Pharmacological Sciences,1991,12:232-236.
[8] AsinK E,Bed marzL,et al.A Selective CCK-A Receptor Agonist,Suppresses Food Intake in the Mouse,Dog and Monkey[J].Pharmacol Biochem Behav,1992,42,699-704.
[9] Moran TH,KatzL F,Plata-Salaman C R,et al.Disordered food intake and obesity in rats lacking cholecystokinin a receptors[J].American Journal of Physiol,1998,274: 618-625.
[10] Takiguchi S, Takata Y, Takahashi N, et al.A disrupted cholecystokinin A receptor gene induces diabetes in obese rats synergistically with ODB1 gene[J]. American Journal of Physiol, 1998,274: 265-270.
[11] Van der Steen H A M,Prall G F W,Plastow G S.Application of genomics to the pork industry[J].Anim Sci,2005,83: 1-8.

