猪传染性胸膜肺炎的诊断和防控
翁善钢
( 外高桥出入境检验检疫局,上海 200137)
猪传染性胸膜肺炎的病原为胸膜肺炎放线杆菌(Actinobacillus P1europeumoniae,APP)。因分离的年代和时间不同,曾被称为副溶血嗜血杆菌(H.parahaemolyticus) 和胸膜肺炎嗜血杆菌(H. pleuropneumoniae)。
APP 已有15 个公认的血清型,分别命名为APP-1 至APP-15,这15 种血清型的致病力大不相同。猪群内不同血清型的流行情况在不同的国家也大不相同。这也使得不同国家采取的检测以及诊断方法有所不同。有些国家主要检测几种毒力较强的血清型,还有些国家检测所有血清型的APP。
影响APP 毒力的因素有多种,其中最为重要的是ApxI,ApxII 和ApxIII 3 个基因。这些基因使细菌产生的毒素,抑制猪的中性粒细胞和巨噬细胞的产生,即抑制细胞的吞噬功能,损害急性感染猪机体的防御机制。某些血清型的APP 只含有一种Apx 基因,也有些血清型的APP 含有2 种Apx 基因,这使其具有更强的细胞毒性(见表1)。几乎所有血清型的APP 都存在ApxIV基因,该基因的致病潜力还没有被确定。但ApxIV 具有高度的种特异性,因此,近几年发展起来的多种诊断方法都基于该基因。
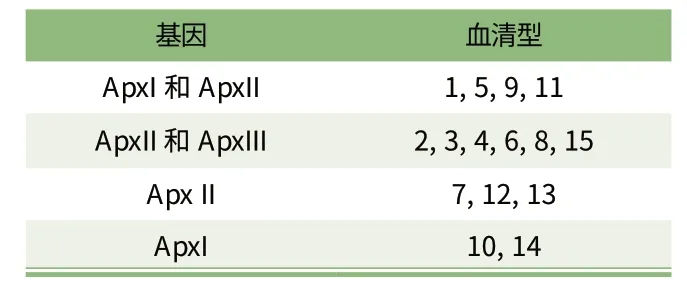
表1 不同血清型APP 所含有的毒力基因
已有多种实验室方法用于诊断APP感染。采用何种诊断方法要注意结合临床情况,同时也要考虑APP 的血清型以及毒力情况很复杂的实际情况。
1 检测方法
1.1 抗原检测
1)采集肺部以及扁桃体的病变组织作细菌培养,纯培养物进一步进行血清型分型。
2)PCR 方法可直接用于检测ApxIV 基因。病变的肺部组织,扁桃体拭子以及鼻拭子样品或者来源于这些样品的纯培养物都可以采用PCR 方法鉴定出不同的血清型。
3)对APP 的纯培养物采用PCR检测ApxI、ApxII 和ApxIII 基因有助于了解APP 的毒力。
4)也可以采集新鲜的病变肺组织制作成压片或者冰冻切片,利用免疫荧光实验检测肺组织中的APP 抗原。
1.2 抗体检测
1)现在已有检测针对ApxIV 基因抗体的ELISA 方法。
2)检测针对APP 的荚膜多糖的ELISA 方法,有助于鉴定出针对不同血清型的APP 的抗体。
3)检测针对不同血清型APP 抗体的ELISA 方法也有很多报道。
尽管上文介绍了不少检测抗原和抗体的方法,很多方法事实上并没有广泛应用,每个国家的APP 感染流行现状不同,科技水平也不同,这直接影响到具体检测方法的使用。
2 诊断方案
2.1 先前未出现过胸膜肺炎的猪群中疑似急性胸膜肺炎暴发
在这种情况下,关键因素是及时确认猪群是否存在APP 感染。最好的办法是将死猪和发病猪送实验室进行剖检。采集典型的急性胸膜肺炎病变的样本,采用恰当的方法进行细菌培养(见图1)。纯培养物可以进一步用于血清分型。样品保存好后也可以使用PCR,间接免疫荧光等方法进行检测。
病猪的扁桃体试子样品可以采用PCR 方法检测ApxIV 基因。

2.2 对猪呼吸道疾病综合征中出现的APP 感染进行诊断
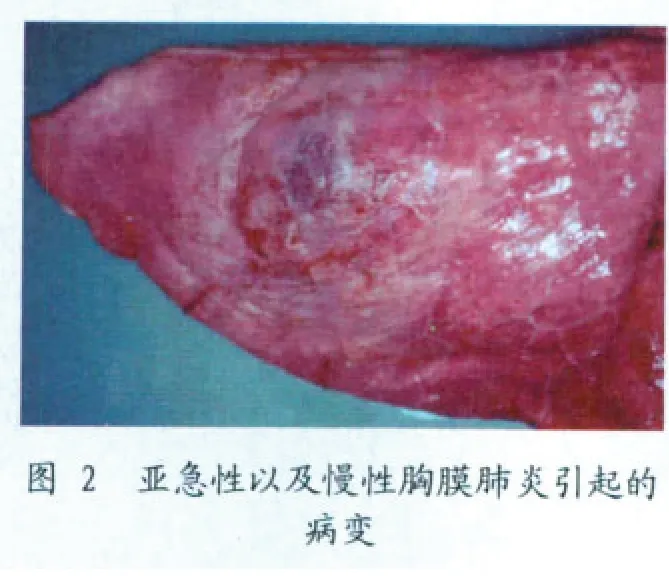
出现较为复杂的胸膜肺炎时很有可能存在多种病原共同感染。此时,需要采集新鲜的肺组织进行细菌学和病毒学检查,采用PCR 的方法检测是否还存在其他病原。在3 个不同的部位采集具有典型肺部病变的组织进行病理组织学观察有助于进一步了解肺部病变的性质。慢性病例中,APP 感染引起的病变逐渐皱缩,最终局限于斑点状的病变(见图2)。这种情况下,对肺组织进行PCR 检测,或者对处于恢复期的猪检测抗体有助于诊断。通常,APP 感染10~14 d 后就可以检测到抗体。
3 防控
3.1 免疫接种
疫苗是控制APP 感染的重要手段。目前市场上有亚单位苗和灭活苗出售,但各种疫苗都有其不足之处,不能抵抗所有血清型的攻击,不能消除患病动物的带菌状态。近来各国都在积极探索基因缺失弱毒苗对胸膜肺炎的保护效果,有望取代目前的灭活苗,因为基因缺失弱毒苗的交叉保护力更强,初步的动物实验表明可抵抗多数血清型的攻击。
3.2 药物预防
根据近来国内外的用药情况及相关报道显示,APP 对头孢噻夫、替米考星、氟甲砜霉素、先锋霉素、环丙沙星、单诺沙星、恩诺沙星、四环素、庆大霉素、卡那霉素等较敏感。金霉素与泰乐菌素的联合用药在临床上使用也较多。对有明显临床症状的发病猪,可用首选药物进行口服和注射同时给药,具有良好的效果。对未发病猪群在饲料或饮水中添加给药,先用治疗剂量给药数天后,改用预防量给药数周或数月可控制此病的发生。
各种细菌都会产生抗药性,且不同的菌株产生的耐药性也不相同。因此,在本病的防治过程中,对用于预防的药物应有计划地定期轮换使用,最好做药敏实验。
3.3 综合防治
很多猪场存在多种病原微生物的混合感染。伪狂犬病、猪瘟、PRRS、支原体肺炎、副猪嗜血杆菌感染等疾病或破坏猪的免疫系统,或破坏猪肺脏的防御功能,很容易使猪只对 APP 的易感性增加,因而一定要做好这些疾病的防控工作。猪舍及环境均定期消毒,减少病原微生物的生存。减少猪的应激,改善和加强饲养管理,采用全进全出的饲养方式。

