血清S-100B蛋白在胶质细胞瘤放射性脑损伤评价中的应用
郭立兵 宋维舒 石卫民 王 昂 黄志勇 李俊杰 张 智
(广东省第二人民医院肿瘤一科,广东 广州 510317)
脑胶质瘤以星形胶质细胞瘤为最多,是最常见的颅内神经上皮性肿瘤,治疗主要以手术切除为主,术后辅以放射治疗。脑组织为放射慢反应组织,放射治疗的治疗剂量与脑组织耐受量接近,容易发生放射性脑损伤。既往对该类放射性脑损伤患者的诊断主要依据临床表现和影像学检查结果,但多数患者至中晚期才出现明显的症状和体征。因此,寻找一种早期诊断放射性脑损伤的指标,及早诊治,对改善患者生活质量和预后十分重要。S-100B蛋白为酸性钙结合蛋白,以高浓度特异性地存在神经胶质细胞、星形细胞、少突胶质细胞中,作为一种脑特异性蛋白,在中枢神经系统损伤后的病理生理变化中起重要作用〔1〕,目前多应用于新生儿脑损伤、心脑复苏后脑损伤、急性脑梗死的脑损伤评价。现有关S-100B蛋白评价胶质细胞瘤放射性脑损伤的相关报道较少,为此本研究分析了血清S-100B蛋白与放射性脑损伤之间的关系。
1 资料与方法
1.1 一般资料 选取2008年10月至2010年3月在我院肿瘤科就诊的96例脑胶质细胞瘤患者,男57例,女39例,年龄35~58〔平均(41±16)〕岁;96例患者均行手术治疗;肿瘤病理Kernohan分级Ⅰ级8例,Ⅱ级16例,Ⅱ~Ⅲ级19例,Ⅲ级27例,Ⅲ~Ⅳ级19例,Ⅳ级7例;位于顶叶13例,额叶19例,颞叶47例,枕叶10例,其他7例;术后接受放射治疗总剂量5 000 cGy 24例,6 000 cGy 31例,7 000 cGy 41例。排除有明显的中枢神经系统损伤者,合并有其他中枢神经系统损伤的并发症者、曾进行经药物治疗和其他创伤性检查者。
1.2 方法
1.2.1 放疗方案 所有病人均接受放射治疗,在胶质细胞瘤切除术后1个月进行放射治疗,放射治疗前进行体格检查和影像学检查,包括脑电图、CT和MRI等,放疗采用6 MV-X线外照射,每次治疗剂量180~200 cGy,每周5次,照射共25~35次,疗程5~8 w,总剂量(DT)为5 000~7 000 cGy。
1.2.2 影像学检查 采用康泰公司KT88-2400AV脑电图仪行脑电图检查,美国Picker公司IQ.Premier xtra计算机断层扫描仪行CT检查,美国菲利浦公司Outlook 1.5T超导磁共振扫描仪行MRI检查。
1.2.3 S-100B蛋白水平的检测 采集患者放射治疗前、中期及疗程结束后的空腹静脉血3 ml,于4℃静置2~10 h,然后低速离心,分离血清,置-20℃冻存备用。采用瑞典康乃格诊断公司检测试剂盒检测血清S-100B蛋白水平,严格按试剂盒说明书操作。以正常人群95%的阴性预期值为S-100蛋白的参考值,超过100 ng/L定为阳性。
1.3 统计学方法 应用SPSS13.0统计软件进行分析,计量资料以s,采用配对资料t检验;计数资料采用χ2检验。
2 结果
2.1 96例胶质细胞瘤患者在放射治疗前、中期及疗程结束后的血清S-100B蛋白表达情况 96例胶质细胞瘤患者接受放射治疗前,血清S-100均为阴性;治疗中期阳性9例(9.4%);治疗结束后阳性19例(19.8%)。治疗不同时期血清S-100B蛋白阳性者比例比较差异均有统计学意义(P<0.05)。放射中期9例血清S-100B蛋白阳性患者中,仅1例出现轻微MRI改变,局灶性脑损伤表现为长T1与T2改变,伴有水肿;脑电图和CT检查均正常。疗程结束后19例血清S-100B蛋白阳性患者中,10例出现影像学改变:脑电图示病变部位出现δ波;CT示单侧或双侧脑出现低密度为主的混杂密度,边界不规则,无增强影像;MRI示局灶性脑坏死,表现长T1与T2改变,T1、T2弛豫时间延长,伴有水肿及环形强化,弥漫性脑损伤表现为脑萎缩和大脑半球白质T2高强度信号。
2.2 不同部位放射治疗后血清S-100B蛋白表达情况 发生在颅内不同部位的胶质细胞瘤患者接受不同剂量放射治疗后,各剂量组内不同肿瘤部位患者血清S-100B蛋白阳性者比例比较差异均无统计学意义(P>0.05)。见表1。
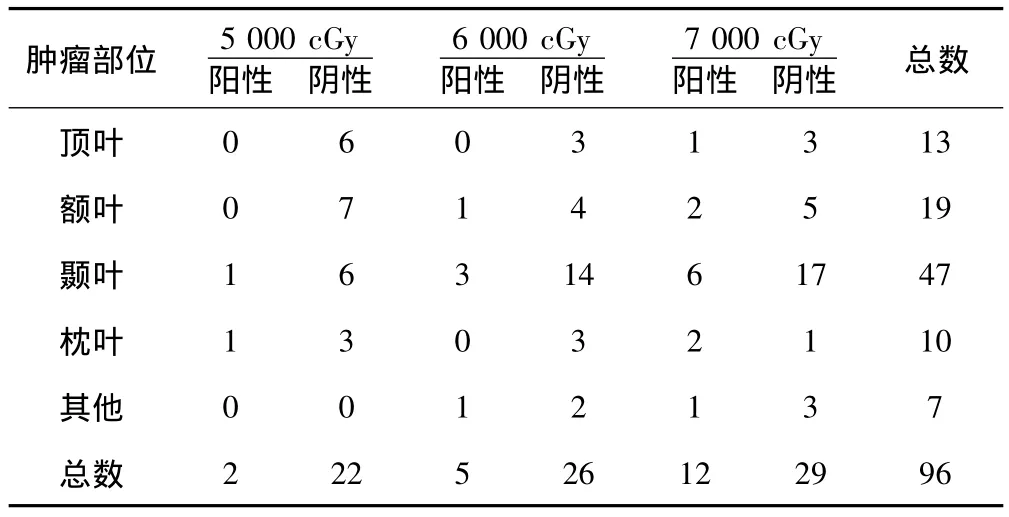
表1 肿瘤发生部位与血清S-100B蛋白表达的关系(n)
2.3 不同放射治疗剂量下血清S-100B蛋白表达情况 24例患者接受5 000 cGy放射治疗后,血清S-100B蛋白阳性2例(8.3%);31例接受6 000 cGy放射治疗后,血清S-100B蛋白阳性5例(16.1%);41例接受7 000 cGy放射治疗后,血清S-100B蛋白阳性12例(29.2%)。随放射治疗剂量的增加,血清S-100B蛋白阳性者比例逐渐升高,组间比较差异有统计学意义(P<0.05)。
3 讨论
S-100蛋白主要分为S-100A及S-100B。其中S-100A主要表达于横纹肌、心肌和肾脏中,而S-100B主要表达于中枢神经系统中,且大多数由胶质细胞合成、分泌。S-100B是特异性脑功能蛋白,是胶质细胞的有丝分裂原,也是胶质细胞与神经元相互作用的中间介质,可促进胶质细胞的增殖和神经元生长及损伤修复。S-100B可早于临床征象及影像学诊断,较早反映颅脑损伤后不同的病理生理改变〔2,3〕。近年研究发现,颅脑损伤6 h内血清S-100B蛋白已出现明显升高,并在7.5 h达到高峰〔4~6〕。血清 S-100B 蛋白水平主要受以下因素影响〔7〕:①颅脑损伤的严重程度及范围;②巨噬细胞和(或)蛋白酶引起的降解;③血脑屏障被破坏的程度。正常情况下S-100B蛋白分子不能通过血脑屏障,但在颅脑损伤后,由于脑细胞和血脑屏障的破坏,血清S-100B迅速渗入血液,如有继发性损伤,胶质细胞破坏引起S-100B蛋白进一步外溢,且外溢程度与损伤的程度密切相关,对脑损伤的临床治疗及疾病预后具有重要的指导意义。
对于脑胶质瘤患者,放射治疗是必不可少的一种治疗手段,因此,放射性脑损伤不可避免。放射性脑损伤的发病机制有以下几个方面〔8~10〕:①神经胶质细胞和神经元的直接损害;②供血血管损伤引起缺血性改变;③机体的自身免疫反应,以前两者为多。手术后肿瘤细胞残留复发和放射性脑损伤是影响胶质细胞瘤患者术后生存率的主要因素。本研究中,96例胶质细胞瘤患者术后患者血清S-100B蛋白阳性比例随放疗的进展而增加,放射中期9例血清S-100B蛋白阳性患者中,仅1例出现轻微MRI改变,脑电图和CT检查均正常;疗程结束后19例血清S-100B蛋白阳性患者中,10例出现影像学改变,说明血清S-100B蛋白表达变化早于影像学改变,可作为放射性脑损伤的早期诊断指标之一,与文献报道相符。一般情况下,胶质细胞瘤患者术后的放射治疗剂量为5 000~7 000 cGy。本研究结果说明血清S-100B蛋白表达与放射治疗的剂量密切相关。胶质细胞瘤在颅内多个部位发生,本研究显示,各剂量组内不同肿瘤部位血清S-100B蛋白阳性者比例比较差异均无统计学意义,表明血清S-100B蛋白表达与肿瘤发生部位无关〔11〕。
综上所述,胶质细胞瘤放射性脑损伤与血清S-100B蛋白表达有关,血清S-100B蛋白阳性可作为早期诊断胶质细胞瘤放射性脑损伤的指标之一。但由于研究样本量有限,观察时间较短,因此结果尚待进一步加大样本量的长期随访研究证实。
1 Moore BW.A soluble protein characteristic of the nervous system〔J〕.Biochem Biophys Res Commun,1965;19(6):739-44.
2 Herrmann M,Jost S,Kutz S,et al.Temporal profile release of neurobiochemical markers of brain damage after traumatic brain injury is associated with intracranial pathology as demonstrated in cranial computerized tomography〔J〕.J Neurotrauma,2000;17(2):113-22.
3 Gazzolo D,Di Iorio R,Marinoni E,et al.S-100B protein is increased in asphyxiated term infants developing intraventricular hemorrhage〔J〕.Crit Care Med,2002;30(6):1356-60.
4 Hardemark HG,Ericsson N,Kotwica Z,et al.S-100 protein and neuronspecific enolase in CSF after experimental traumatic or focal ischemic brain damage〔J〕.J Neurosurg,1989;71(5):727-31.
5 Ingebrigtsen T,Romner B.Serial S-100 protein serum measurements related to early magnetic resonance imaging after minor head injury.Case report〔J〕.J Neurosurg,1996;85(5):945-8.
6 高俊霞,杨晓明.早期检测颅脑损伤患者血中S-100B蛋白含量变化的临床意义〔J〕.中西医结合心脑血管病杂志,2008;6(10):1172-4.
7 Nygaard O,Langbakk B,Romner B.Age-and sex-related changes of S-100 Protein concentrations in cerebrospinal fluid and serum in patients with no previous history of neurological disorder〔J〕.Clin Chem,1997;43(3):541-3.
8 Schultheiss TE,Kun LE,Ang KK,et al.Radiation response of the central nervous system〔J〕.Int J Radiat Oncol Biol Phys,1995;31(5):1093-112.
9 Kutita H,Kawahara N,Asai A,et al.Radiation-induced apoptosis of oligodendrocytes in the adult rat brain〔J〕.Neurol Res,2001;23(8):869-97.
10 Hoskin P,Crow J,Ford HT.The influence of extent and local management on the outcome of radiotherapy for brain metastases〔J〕.Int J Trdiat Oncol Biol Phys,1990;19(1):111-5.
11 丘 勇,石 梅,魏丽春,等.中等剂量(20Gy)电离辐照后早期大鼠脑内S-100免疫反应胶质细胞的变化〔J〕.中国神经科学杂志,2002;18(2):495-8.

