替吉奥联合奥沙利铂与FOLFOX6方案治疗晚期胃癌的疗效对比
孙宝信 白 璐 李青山 林萍萍 连相尧 高东奇
(承德医学院附属医院肿瘤外科,河北 承德 067000)
我国是胃癌高发国家,每年胃癌新发病例超过40万人,因胃癌死亡30万人,胃癌严重威胁着国民的身体健康。手术是胃癌的主要治疗方法,但胃癌早期症状不明显,约50%的患者就诊时已属中晚期,失去手术时机,化疗成为晚期胃癌患者的主要治疗手段。但迄今为止,晚期胃癌仍无标准的治疗方案,故如何选择化疗药物及化疗方案,使其发挥最大的疗效并使其不良反应减小到最低,成为目前研究的热点问题。本文对晚期胃癌患者随机给予替吉奥联合奥沙利铂或5-氟尿嘧啶(5-Fu)联合奥沙利铂及亚叶酸钙治疗,分析其疗效、安全性及对免疫功能的影响。
1 资料与方法
1.1 临床资料 入选病例标准:有组织病理学诊断;KPS评分≥70分,白细胞计数>4×109/L,血小板计数>80×109/L,肝肾功能正常,心电图正常,无化疗禁忌,预计生存期>3个月;有明确的观察指标,可经CT或MRI检测病灶大小;既往未接受过化疗或距末次化疗时间间隔超过1个月;没有第2种原发肿瘤;所有患者均知情同意,并签署化疗知情同意书。
2010年9月至2012年8月承德医学院附属医院放化疗科及肿瘤外科收治符合上述入选标准的晚期胃癌患者62例,其中男41例,女21例,年龄50~75岁;病理类型:腺癌51例,非腺癌11例;初治患者40例,复治22例;肝转移35例,肺转移7例,淋巴结转移50例,骨转移8例,其他转移12例。62例入选患者随机分为试验组(替吉奥联合奥沙利铂)和对照组(5-Fu联合奥沙利铂及亚叶酸钙),两组患者一般信息比较无显著性差异(P>0.05)。见表1,表2。
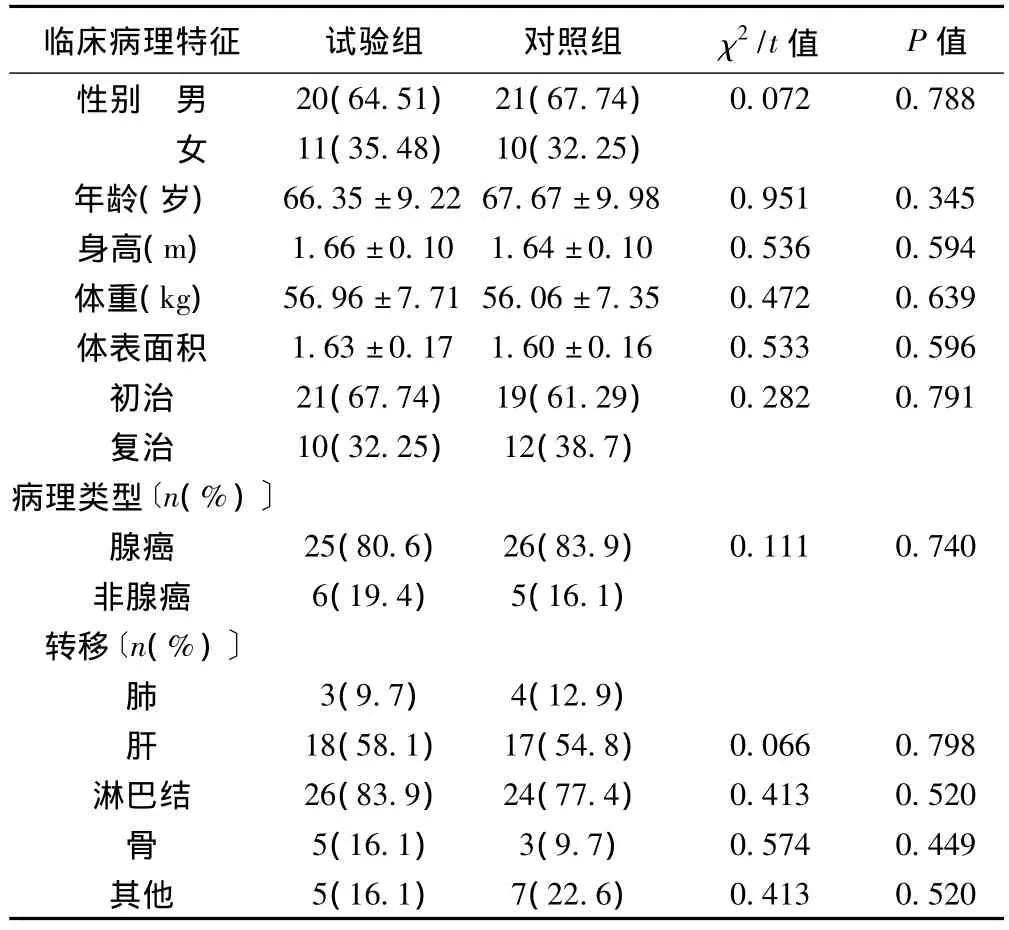
表1 两组一般资料比较(n=31)
1.2 治疗方法 试验组给予奥沙利铂130 mg/m2加入5%葡萄糖注射液250ml避光缓慢静注3 h,第1天;替吉奥每天80 mg/m2,分2次餐后口服,第1~14天;3 w为1个疗程。对照组给予FOLFOX6方案或其改良方案(5-Fu400 mg/m2静点d1,2 400~3 000 mg/m2持续静脉滴注 46 h;奥沙利铂80~100 mg/m2缓慢静点3 h,第1天;亚叶酸钙200 mg/m2静点第1天,2 w为1个周期)。所有患者化疗前后分别给予昂丹司琼预防胃肠道反应,如谷丙转氨酶或谷草转氨酶高于正常值且低于正常值2倍,给予预防性保肝药物治疗。
1.3 疗效评定 所有患者每周期化疗前、化疗后均行血常规、血生化、心电图、超声等检查。试验开始及2个周期化疗后分别行胃镜及CT、MRI等影像学检查。近期疗效判定采用RECIST标准,每2 w评价疗效,分为完全缓解(CR):肿瘤完全消失持续至少4 w;部分缓解(PR):肿瘤缩小超过50%,持续至少4 w;稳定(SD):肿瘤缩小不足50%;进展(PD):肿瘤增大超过25%以上或出现新病灶。客观有效率(RR)为CR+PR。
1.4 临床受益反应(CBR)包括对疼痛、体力状况及体重改变的综合评价,并被规定为至少下列一项指标好转,并无任何一项恶化:镇痛药用量减少≥50%,疼痛强度减轻≥50%;体力状况改善(KPS)≥20分;或镇痛药用量、疼痛强度及体力状况稳定,体重增加≥7%(非液体潴留)。CRB评估:疼痛评分或镇痛药用量、KPS评分、体重增加3项指标中至少有1项有效,其他两项稳定者为有效,3项全部稳定者为稳定,其中任何一项无效则认为无效。
1.5 毒副作用 按WHO抗癌药物急性及亚急性毒性表现和分级标准判定,分0~4级。
1.6 免疫功能评价 分别于试验前及每个周期化疗后采用美国Becton Dickinson(BD)公司生产的流式细胞仪(FACSCalibur)检测血中 CD3+、CD4+、CD8+、CD4+/CD8+、CD19+细胞的百分率,操作严格按说明书进行。
1.7 统计学分析 采用SPSS17.0统计分析软件,计量资料采用s表示,采用t检验。计数资料采用 χ2和非参数检验。P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效评价 所有入组病例除1例退出试验、1例因IV度骨髓抑制脱落外余60例均完成2个周期化疗,此2例患者未进行疗效评价,余试验组30例CR 2例,PR 12例,SD 14例,PD 2例,RR 46.7%。对照组30例CR 1例,PR 12例,SD 14例,PD 3例,RR 43.3%。两组客观有效率比较差异无统计学意义(χ2=0.067,P=0.795)。
2.2 临床获益评价 试验组与对照组均为2个周期化疗后评价临床获益,试验组30例中20例获益,10例未获益,临床获益率为66.7%;对照组30例中11例获益,19例未获益,临床获益率为36.7%。两组比较,试验组临床获益率高于对照组(χ2=5.406,P=0.02)。
2.3 毒副反应 两组主要的毒副反应为血液学毒性、消化道反应、肝肾功能损伤以及感觉神经毒性,且主要为Ⅰ~Ⅱ度不良反应,Ⅲ~Ⅳ度不良反应发生率较低,患者均可耐受,无严重不良反应导致死亡病例。血液学毒性反应以白细胞减少为主,其次为血小板减少、贫血值两组血液学毒性反应无显著差异(P>0.05)。非血液学毒性方面,胃肠道反应以恶心、呕吐、腹泻为主,试验组恶心呕吐发生率为40%,低于对照组的77.4%(P=0.002)。神经系统毒性、口腔黏膜炎及肝肾功能损伤,两组比较均无统计学差异(P>0.05)。见表2。
2.4 免疫功能 试验组第一周期化疗后、第二周期化疗后CD4+、CD4+/CD8+均较化疗前升高(P<0.001),第一周期化疗后、第二周期化疗后CD3+、CD8+、CD19+细胞均没有明显变化(P>0.05);对照组第一周期化疗后、第二周期化疗后CD4+、CD4+/CD8+也较化疗前升高(P <0.001),CD3+、CD8+、CD19+细胞没有明显变化(P>0.05);化疗后,试验组与对照组相比,CD4+、CD4+/CD8+两项有统计学差异(P<0.01)。见表3。
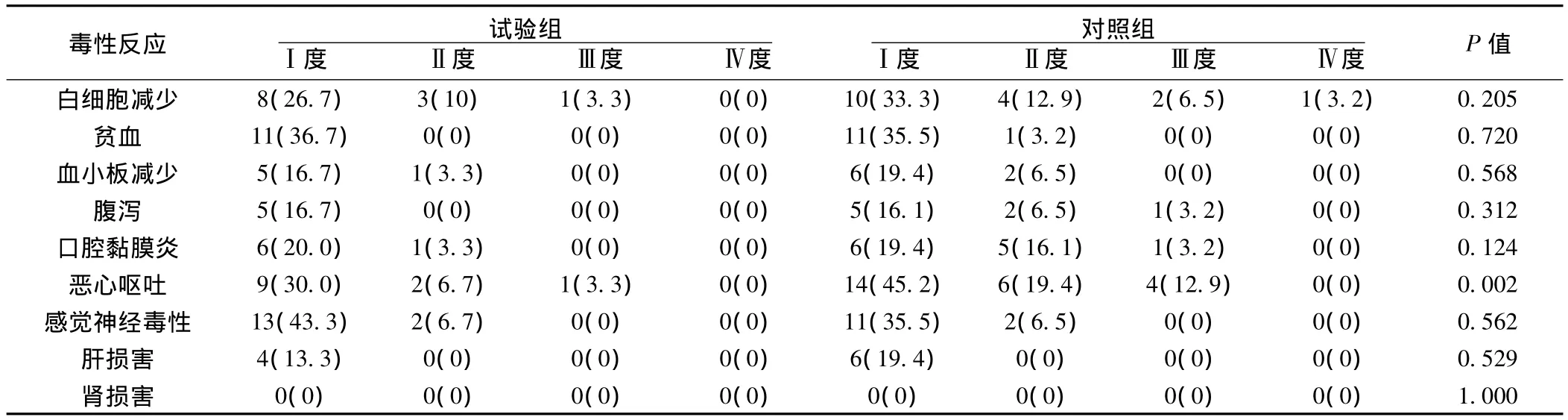
表2 试验组与对照组毒副反应评价〔n(%),n=30〕
表3 试验组与对照组淋巴细胞表型对比(s,%,n=30)
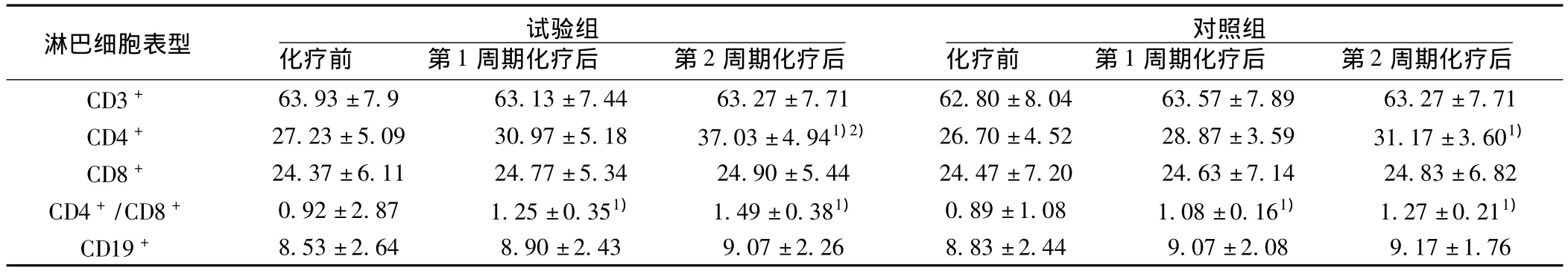
表3 试验组与对照组淋巴细胞表型对比(s,%,n=30)
与化疗前比较:1)P<0.05;与对照组比较:2)P<0.05
淋巴细胞表型 试验组化疗前 第1周期化疗后 第2周期化疗后周期化疗后CD3+ 63.93±7.9 63.13±7.44 63.27±7.71 62.80±8.04对照组化疗前 第1周期化疗后 第2 7±2.08 9.17±1.76 63.57±7.89 63.27±7.71 CD4+ 27.23±5.09 30.97±5.18 37.03±4.941)2) 26.70±4.52 28.87±3.59 31.17±3.601)CD8+ 24.37±6.11 24.77±5.34 24.90±5.44 24.47±7.20 24.63±7.14 24.83±6.82 CD4+/CD8+ 0.92±2.87 1.25±0.351) 1.49±0.381) 0.89±1.08 1.08±0.161) 1.27±0.211)CD19+ 8.53±2.64 8.90±2.43 9.07±2.26 8.83±2.44 9.0
3 讨论
晚期胃癌化学治疗的研究开始于上世纪60年代,当时单药一线治疗胃癌有效率仅在17% ~30%〔1〕,为提高疗效,联合化疗开始成为研究热点。2000年前,学者们多采用不含铂类的化疗方案,但有效率提高不明显。20世纪80~90年代含铂类方案开始逐渐应用于临床,当时许多学者把CF方案作为晚期胃癌的推荐方案〔2〕。但顺铂在胃肠道肿瘤治疗中疗效有限,毒副反应较重。以后人们逐渐发现了第三代铂类药物草酸铂,因此FOLFOX系列化疗方案在临床上开始得到广泛应用。2011年NCCN指南提出胃癌一线治疗可考虑奥沙利铂联合5-Fu及亚叶酸钙(FOLFOX)治疗。更有研究表明〔3〕,FOLFOX6方案治疗胃癌的有效率达50%。但该系列方案中5-Fu肿瘤选择性较差,毒性作用分布于全身,且5-Fu半衰期较短,需持续静脉滴注,可导致输注血管静脉炎的发生,目前多采用深静脉置管完成5-Fu的持续泵入,但由此产生的置管相关性感染及静脉血栓的发生率相对增高;再者,5-Fu不可口服,需住院治疗,增加住院费用,影响生活质量,从而影响患者的耐受性及依从性。
替吉奥胶囊是第三代氟尿嘧啶衍生物口服抗癌剂,其抗癌活性谱与Fu相似,并且其对晚期胃癌作用较5-Fu更强。替吉奥胶囊以替加氟为主体,加入吉美嘧啶及奥替拉西钾,三者按摩尔比为1∶0.4∶1。替加氟为5-Fu的前体药物,起抗肿瘤作用,再加入吉美嘧啶,为二氢嘧啶脱氢酶(DPD)抑制剂,通过抑制组织内的DPD,阻止Fu活化物降解,延长抗肿瘤药物的作用时间,减少个体药效差异,增强抗肿瘤作用〔4〕;再加入奥替拉西钾,其口服后主要分布于小肠,可抑制肠道黏膜细胞内乳清酸核糖转移酶的活性,阻断5-Fu的磷酸化,从而减轻抗肿瘤药物替加氟对胃肠道产生的细胞毒作用,保护胃黏膜,减轻消化道反应。随着 2007 年 ASCO 报道了 JCOG9912〔5〕及 SPIRITS〔6〕试验,各国关于替吉奥的研究也不断增多。代号为SPIRITS〔6〕的研究结果显示,替吉奥+DDP组的RR、mPFS及OS均高于替吉奥单药组,可是研究发现联合化疗组的Ⅲ~Ⅳ级血液学和胃肠道(食欲减退和恶心呕吐)毒性较单用替吉奥组显著增大,因此人们正在探索替吉奥的更好组合。据研究统计,目前日本晚期胃癌的化疗,有80%以上的患者使用替吉奥胶囊〔7〕,总反应率为44.6%,中位生存期为224 d,1年生存率为37%。Shirasaka等〔8〕还报道了一项21例晚期胃癌患者参加的开放性试验,总有效率为49%。替吉奥不但疗效较高,而且不良反应轻、安全。一项包括4 177例患者加入的临床研究显示〔9〕,其在Ⅱ期试验中的总副反应发生率为74.3%,Ⅲ级以上毒性反应发生率只有14.9%。一项最近的多中心(23个国家)Ⅲ期临床试验FLAGS〔10〕结果显示替吉奥联合顺铂虽未显示能延长晚期胃癌和胃食管腺癌患者OS期,但在安全性方面较5-Fu联合顺铂组显示出显著优势。
目前国内外替吉奥单药治疗胃癌疗效的研究有限。本研究中两组有效率与国内外研究基本一致,但由于我们观察周期短,未对生存期进行观察、分析,我们将继续扩大样本量对远期疗效进行评价。对照组恶心呕吐发生率高于试验组,考虑由于替吉奥是在替加氟基础上加入了奥替拉西钾,奥替拉西钾可减轻胃肠道毒性,保护胃黏膜,从而使患者消化道反应轻微。
在免疫功能方面,患者细胞免疫功能得到提高,而体液免疫没有明显变化。早有研究发现,恶性肿瘤患者全身免疫功能低下,细胞免疫功能处于抑制状态,T细胞免疫活性随着肿瘤的进展而升高〔11〕。展富琴等〔12〕研究显示,恶性肿瘤患者 CD3+、CD4+及NK细胞均明显低于正常对照组,说明患者的细胞免疫处于抑制状态。传统观念认为,化疗后患者免疫功能下降,但最近研究证明〔13,14〕,部分化疗药物及化疗方案不但不使患者免疫力降低,且有所升高,这可能是由于化疗使肿瘤细胞大量坏死,免疫抑制减轻有关。本实验也验证了,随着化疗使肿瘤逐渐消退,患者细胞免疫功能也得到了提高。
1 Wilson WH,Gutierrez M,O'Connor P,et al.The role of rituximab and chemotherapy in aggressive B-cell lymphoma:a preliminary report of doseadjusted EPOCH-R〔J〕.Semin Oncol,2002;29(1 suppl 2):41-7.
2 Ross P,Nicolson M,Cunningham D,et al.Prospective randomized trial comparing mitomycin,cisplatin,and protracted venous-infusion fluorouracil(PVI 5-Fu)with epirubicin,cisplatin,and PIV 5-Fu in advanced esophagogastric cancer〔J〕.J Clin Oncol,2002;20(8):1996-2004.
3 Neri B,Pantaleo P,Giommoni E,et al.Oxaliplatin,5-fluorouracil/leucovorin and epirubicin as first-line treatment in advanced gastric carcinoma:a phase II study〔J〕.Br J Cancer,2007;96(7):1043-6.
4 Takechi T,Okabe H,Ikeda K,et al.Correlations between antitumor activities of fluoropyridines and DPD activity in lung tumor xenografts〔J〕.Oncol Rep,2005;14(1):33-9.
5 Sato A,Nakumachi M.Clinical development of chemotherapy for advanced gastric cancer〔J〕.Gan To Kaqaku Ryoho,2008;35(9):1461-6.
6 Koizumi W,Narahara H,Hara T,et al.S-1 plus cisplain versus S-1 alone for first-line treatment of advanced gastric cancer(SPIRITS trial):a phase Ⅲ trial〔J〕.Lancet Oncol,2008;9(3):215-21.
7 Shirasaka T,Tsukuda M,Inuyama Y,et al.New oral anticancer drug TS-1(S-1)-from bench to clinic〔J〕.Gan To Kaqako Ryoho,2001;28(6):855-64.
8 Shirasaka T,Shimamato Y,Ohshimo H,et al.Development of a novel form of an oral 5-fluorouracil derivative S-1 directed to the potentiation of the tumor selective cytotoxicity of 5-fluorouracil by two biochemical modulators〔J〕.Anticaner Drugs,1996;7(5):548-57.
9 Ducreux M,Louret C,Bekradala M,et al.Oxalipatim for the treatment of advanced colorectal cancer,future directions〔J〕.Semin Oncol,1998;25(2):47-53.
10 Ajani JA,Rodriguez G,Bodoky G,et al.Multicenter phaseⅢ comparison of cisplatin/S-1(CS)with cisplatin/5-FU(CF)as first-line therapy in patients with advanced gastric cancer(FLAGS)〔J〕.San Francisco:ASCO Gastrointestinal Cancers Symposium Meeting,2009:8.
11 黄 丽.大肠癌患者外周血T淋巴细胞亚群变化与病程的相关性〔J〕.湖北中医学院报,2006;8(3):7-8.
12 展富琴,冯 萍.恶性肿瘤患者化疗前后免疫功能的变化〔J〕.中国血液流变学杂志,2007;17(1):137.
13 Hegde U,Chhabra A,Chattopadhyay S,et al.Presence of low dose of fludarabine in cultures blocks regulatory T cell expansion and maintains tumor-specific cytotoxic T lymphocytes〔J〕.Pathobiology,2008;75(3):200-8.
14 Ju SA,Cheon SH,Park SM,et al.Eradication of established renal cell carcinoma by a combination of 5-fluorouracil and anti-4-1BB monoclonal antibody in mice〔J〕.Clin Cancer Res,2008;14(11):3520-8.

