1-甲基-4-苯基-1、2、3、6-四氢吡啶的神经毒性与帕金森病
马晓伟 李晓丽 张忠霞 王铭维 (河北医科大学第一医院神经内科,河北 石家庄 050030)
神经毒素 1-甲基-4-苯基-1、2、3、6-四氢吡啶(MPTP)是目前唯一被公认的可以诱发人类及非人类灵长类动物及小鼠帕金森病(PD)症状的合成毒素〔1,2〕,诱导的动物模型在神经化学、行为学和组织病理学上的变化非常接近于临床上PD病人。PD的发病与遗传、环境因素、感染、衰老、氧化应激、细胞凋亡及神经生长因子缺乏等有关,是多种机制协同作用的结果〔3〕。近年来许多研究表明,黑质DA能神经元对氧化和炎症的损伤作用非常敏感〔4〕,氧化应激反应增强在PD黑质神经元凋亡中起着主要作用。现就MPTP引起的氧化应激和炎症对DA能神经元神经毒性与PD做一综述。
1 MPTP毒性作用途径
MPTP为脂溶性,能透过血-脑脊液屏障进入脑内,主要集中分布在黑质区含有DA能神经元的黑色素中。MPTP本身并不具有神经毒性,但进入体内在脑内星形胶质细胞和5-羟色胺能神经元内的单胺氧化酶B的作用下转变为有毒性的为1-甲基-4-苯基吡啶(MPP+),MPP+作为DA能神经元的DA重吸收系统的基质,通过黑质纹状体末梢优先聚集,经非特异性能量依赖的亲脂性正离子吸收机制成百倍聚集于线粒体内,特异性的作用于DA神经元线粒体呼吸链复合体Ⅰ,从而阻止电子呼吸链传递,导致了能量代谢的紊乱、产生一系列氧化应激和炎症损伤,并能损害DA转运体(DAT)的功能。MPP+还可以阻滞三羧酸循环中的α-酮戊二酸脱氢酶(α-KGDH)活性,复合体Ⅰ和α-KGDH的双重缺陷会严重影响线粒体呼吸链和ATP合成,从而产生更多的自由基〔5〕。此外,MPP+能引起局部谷氨酸盐的增高,间接使线粒体功能受损,并且加速了DA氧化代谢,增加了过氧化物、OH自由基、一氧化氮(NO)等活性产物的产生引起DA神经元氧化损伤〔6〕。见图1。
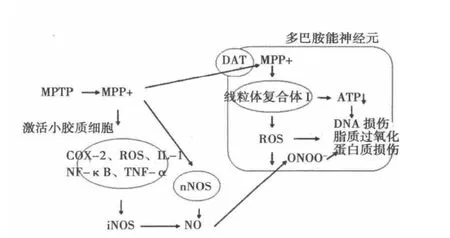
图1 MPTP毒性作用途径
2 氧化应激反应
2.1 活性氧(ROS)氧化应激是细胞氧化-抗氧化失衡而导致的应激损伤状态。当ROS的生成增加而其清除减少,或者对氧化修饰的大分子修复减少时,氧化应激就会发生〔7〕。ROS主要是线粒体电子传递链中的副产物,此外,内质网和各种氧化酶类(如脂氧合酶系、蛋白酶C、环氧合酶系、NADPH氧化酶复合体、NADPH氧化酶的同源物NOX蛋白家族)也能产生部分ROS。ROS,特别是羟自由基能够使脂质、蛋白质和核酸发生功能性改变。体内抗氧化系统包括抗氧化酶和非酶抗氧化剂。抗氧化酶类主要有:超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶、谷胱甘肽巯基转移酶(GST)、抗坏血酸过氧化物酶等,非酶类有谷胱甘肽(GSH)、维生素A、维生素C、维生素E、α-硫辛酸、类胡萝卜素、辅酶Q10、胆红素以及锌、硒等微量元素,另外,机体内的一部分游离氨基酸、多肽及蛋白质在维持较高浓度时可发挥低水平的抗氧化活性〔8〕。正常情况下生物体中ROS的产生量少,且其产生与清除处于动态的平衡状态。
ROS对神经元的损伤主要表现在如下几个方面:细胞膜发生脂质过氧化反应,膜磷脂被破坏降解;细胞膜对钠、钙及大分子物质通透性增加,神经元发生细胞毒性水肿;线粒体破坏,功能丧失〔9〕。正常大脑黑质特别容易受到氧化损害,其原因包括:①脑组织含高浓度的不饱和脂肪酸。②大脑接受了与其重量不成比例的氧耗。③自身保护机制相对薄弱,如与肝脏相比,大脑几乎无CAT,而GSH、谷胱甘肽过氧化物酶(GSH-Px)及维生素E等明显减少。④DA神经元中的神经黑素对Fe3+的高亲和力使黑质中聚集高浓度的Fe3+,并可随时转为活化的Fe2+〔10〕。PD发病过程中,氧化应激不仅与 ROS过度产生有关,也与机体清除ROS和抗氧化能力降低有关〔11〕。朱青等〔12〕实验也发现PD猴模型的氧化终产物丙二醛水平随病程进展逐渐升高,GSH水平在亚临床期即有显著下降,临床早期下降最快,而GSH-Px活性在亚临床期有所增高,表明在此时期抗氧化能力代偿性增高以抵抗增强的脂质过氧化和自由基生成增多,随着症状出现并逐渐加重,GSH-Px活性开始回落,SOD活性则随症状加重逐渐增强,但幅度较平缓。
2.2 NO NO是机体内广泛存在的一种小分子活性物质,是由NO合酶(NOS)催化生成的。包括3种不同亚型,诱导型NOS(iNOS),神经型NOS(nNOS)和内皮型NOS(eNOS)。nNOS和eNOS是钙离子及钙调蛋白依赖性酶,对外界刺激反应迅速,可在短时间内生成大量NO。iNOS在脑内正常情况下不表达,是非钙离子及钙调蛋白依赖性,它的调节取决于重新合成。在病理条件下,尤其是伴随胶质细胞增生,iNOS会被诱导产生,主要表达于巨噬细胞和小胶质细胞,会在数天或数小时内产生大量NO。NO不稳定,易于与其他分子反应,导致蛋白质氧化、亚硝基化和硝基化,产生多种生物学效应。当NO产生过量,它就会由生理状态下的神经调节因子转变为神经毒性因子,介导严重的神经毒性及细胞毒性作用而造成组织损伤〔13〕。目前认为自由基介导的氧化应激、线粒体功能障碍、谷氨酸兴奋性毒性以及神经炎症是DA神经元变性和死亡的重要机制。NO是参与这些机制的重要自由基和组成成分,并且能通过许多机制导致神经细胞的凋亡和死亡〔14〕。
有研究显示,NO对DA能神经元的损伤作用可能是通过以下的方式实现的〔15〕:与细胞外超氧化物反应,生成毒性更强的过氧化亚硝酸盐;置换血红素上的铁离子,使后者参与Fenton反应,生成毒性的氧自由基;硝化酪氨酸残基,形成3-硝化酪氨酸,导致蛋白质功能障碍;激活前列腺环素合成酶,促进前列腺环素的合成;破坏线粒体呼吸链的功能,导致细胞膜电位降低和ATP的耗竭。在PD患者的黑质致密部的小胶质细胞表达高水平的iNOS,而对照组无表达,iNOS一旦被激活,可以长时间地产生NO和超氧自由基〔16〕。在MPTP动物模型中,发现有明显的iNOS上调,缺乏iNOS基因的突变小鼠与野生型小鼠相比,前者能明显对抗MPTP诱导的DA神经元变性,认为iNOS在MPTP的神经毒性过程中扮演重要角色,抑制iNOS可能起到神经保护作用〔17〕。Iravani等〔18〕的研究也发现 iNOS参与了炎症反应诱导的DA神经变性过程。
3 炎症反应
环加氧酶(COX)是前列腺素(PGs)生物合成的限速酶,催化花生四烯酸转化为前列环素。COX有两种同形异构体:COX-1和COX-2。实验证明,COX-1主要参与维持细胞的稳态,而COX-2则在炎症过程中发挥重要作用。DA能神经元在静息条件下,仅少量甚至不表达 COX-2。在 MPTP、脂多糖(LPS)等神经毒素的刺激下,COX-2蛋白和mRNA表达水平迅速上升。研究发现,在MPTP等神经毒素PD小鼠模型中,甚至在PD患者脑内也有COX-2的高表达〔19〕。而且,无论体外实验还是体内试验都显示非甾体类抗炎药(如吡罗昔康等COX-2抑制剂)能拮抗MPTP介导的对DA能神经元的毒性作用,减轻DA能神经元的损伤和死亡〔20〕。JNK抑制剂也能阻止COX-2的表达,从而保护DA能神经元免受MPTP的神经毒性作用,敲除COX-2基因可在很大程度上阻断MPTP等神经毒素对DA能神经元的损伤〔21,22〕。流行病学研究证实,服用非甾体类抗炎药能降低PD患病率〔23,24〕。这些结果都说明,COX-2及其介导的炎症反应在PD疾病的发生发展过程中扮演了重要的角色,拮抗炎症反应有可能为PD的防治开辟新的治疗方向。
4 氧化应激与细胞凋亡
大量研究认为PD DA神经元死亡的方式为凋亡〔25〕。郑文荣等〔26〕在体内实验中证明DA可通过氧化应激途径而导致DA能神经细胞凋亡。王涛等〔27〕在体外实验中也表明细胞内抗氧化应激系统功能明显减弱,胞内氧自由基含量不断增多且处于脂质过氧化过程,进而诱导了纹状体内的细胞凋亡;模型组促凋亡蛋白Bax的表达增强,而抗凋亡蛋白Bcl-2表达减少,提示Bax和Bcl-2各自表达的变化在调控细胞凋亡方面起着关键性的作用。Bax是各种神经细胞损伤的启动子,Bax的增加早于细胞凋亡,通过与Bcl-2蛋白结合减弱Bcl-2的抑制凋亡作用,或通过促使细胞色素C激活Caspase家族来发挥作用〔28〕。
Caspase是氧化应激诱导的黑质DA能神经元凋亡的效应分子,其中,caspase-1,-3,-7和-8均被认为在细胞凋亡途径中起重要作用〔29〕。在PD患者的黑质纹状体区,caspase-1和-3的活性与对照组相比分别增加了 1.5 和 2倍〔30〕。Yamada等〔31〕的研究也表明,经MPTP处理的野生型小鼠24 h后在黑质纹状体内观察到了caspase-3的激活和凋亡现象,而敲除caspade-3可以阻止MPTP诱导的黑质DA能神经元凋亡,并且可以阻断MPTP诱导的酪氨酸羟化酶表达抑制等改变。同时,神经毒素MPP+可以通过氧化应激导致凋亡途径主要分子事件的激活,包括细胞色素C的释放及caspase-3和-9的活化,进而激活氧化应激敏感的激酶PKCδ(protein kinase C delta),从而导致黑质DA能神经元的变性和凋亡〔32〕,caspase-3,-7还可以通过 PKCδ通路调节小胶质细胞的激活而参与PD的发病〔29〕。此外,ROS对于有利于细胞凋亡的通路还具有显著的放大效应〔33〕。
5 展望
许多研究证明MPTP所引起的生化和细胞内改变与PD相似,通过氧化应激和炎症对DA能神经元产生神经毒性,导致了黑质DA能神经元的凋亡,而应用抗氧化剂和抗感染治疗来阻止PD的疾病进程也成为人们研究的热点。
1 Burch D,Sheerin F.Parkinson's disease〔J〕.Lancet,2005;365(9459):622-7.
2 Abdulwahid Arif I,Ahmad Khan H.Environmental toxins and Parkinson's disease:putative roles of impaired electron transport chain and oxidative stress〔J〕.Toxicol Ind Health,2010;26(2):121-8.
3 Cookson MR.The biochemistry of Parkinson's disease〔J〕.Ann Rev Biochem,2005;74:29-52.
4 Kostrzewa RM,Kostrzewa JP,Brus R.Neuroprotective and neurotoxic roles of levodopa(L-DOPA)in neurodegenerative disorders relating to Parkinson's disease〔J〕.Amino Acids,2002;23(1-3):57-63.
5 Fonck C,Baudry M.Rapid reduction of ATP synthesis and lack of free radical formation by MPP+in rat brain synaptosomes and mitochondria〔J〕.Brain Res,2003;975(1-2):214-21.
6 Watanabe H,Muramatsu Y,Kurosaki R,et al.Protective effects of neuronal nitric oxide synthase inhibitor in mouse brain against MPTP neurotoxicity:an immunohistological study〔J〕.Eur Neuropsychopharmacol,2004;14(2):93-104.
7 Laederach A,Shcherbakova I,Jonikas MA,et al.Distinc contribution of electrostatics,initial conformational ensemble,and macromolecular stability in RNA folding〔J〕.Proc Natl Acad Sci U S A,2007;104(17):7045-50.
8 陈 聆,李 敏.阻塞性睡眠呼吸暂停低通气综合征患者的氧化应激状态和血管内皮的改变〔J〕.诊断学理论与实践,2009;8(3):348-51.
9 Yang Y,Song Y,Loscalzo J.Regulation of the protein disulfide proteome by mitochondria in mammalian cells〔J〕.Proc Natl Acad Sci U S A,2007;104(26):10813-7.
10 张东齐,徐江平.抗氧化剂对帕金森病的保护作用及机制的进展〔J〕.医学综述,2006;12(2):113-5.
11 袁 红,梁立武.氧化应激与帕金森病多巴胺神经元死亡〔J〕.武警医学,2007;18(6):448-50.
12 朱 青,孙圣刚,张允建,等.帕金森病猴模型血清抗氧化系统改变的研究〔J〕.中国神经免疫学和神经病学杂志,2007;14(4):205-6.
13 Guix FX,Uribesalgo I,Coma M,et al.The physiology and patho-physiology of nitric oxide in the brain〔J〕.Neurobiology,2005;76(6):126-52.
14 Wei T,Chen C,Hou J,et al.Nitric oxide induces oxidative stress and apoptosis in neuronal cells〔J〕.Biochim Biophys Acta,2000;1498(1):72-9.
15 Stewart VC,Healea SJ.Nitric oxide-induced mitochondrial dysfunction:implications for neurodegeneration〔J〕.Free Radic Biol Med,2003;34(3):287-303.
16 Tieu K,Ischiropoulos H,Przedborski S.Nitric oxide and reactive oxygen species in Parkinson's disease〔J〕.IUBMB Life,2003;55(6):329-35.
17 Dehmer T,Lindenau J,Haid S,et al.Deficiency of inducible nitric oxide synthase protects against MPTP toxicity in vivo〔J〕.J Neurochem,2000;74(5):2213-16.
18 Iravani MM,Kashefi K,Mander P,et al.Involvement of inducible nitric oxide synthase in inflammation-induced dopaminergic neurodegeneration〔J〕.Neuroscience,2002;110(1):49-58.
19 Hakansson A,Bergman O,Chrapkowska C,et al.Cyclooxygenase-2 polymorphisms in Parkinson's disease〔J〕.Am J Med Genet B Neuropsychiatr Genet,2007;144B(3):367-9.
20 Soliman Y,Jackson T,Mazzio E,et al.The effects of piroxicam in the attenuation of MPP+/MPTP toxicity in vitro and in vivo〔J〕.Neurochem Res,2009;34(2):304-10.
21 Wang Y,Zhang Y,Wei Z,et al.JNKinhibitor protects dopaminergic neurons by reducing COX-2 expression in the MPTP mouse model of subacute Parkinson's disease〔J〕.J Neuro Sci,2009;285(1-2):172-7.
22 Boyd JD,Jang H,Shepherd KR,et al.Response to 1-methyl-4-phenyl-1,2,3,62tetrahydropyridine(MPTP)differs in mouse strains and reveals a divergence in JNK signaling and COX-2 induction prior to loss of neurons in the substantia nigra pars compacta〔J〕.Brain Res,2007;1175(2007):107-16.
23 Hernan MA,Logroscino G,Garcia Rodriguez LA.Nonsteroidal anti-inflammatory drugs and the incidence of Parkinson disease〔J〕.Neurology,2006;66(7):1097-9.
24 Chen H,Jacobs E,Schwarzschild MA,et al.Nonsteroidal anti-inflammatory drug use and the risk for Parkinson's disease〔J〕.Ann Neurol,2005;58(6):963-7.
25 Gallagher DA,Schapira AH.Etiopathogenesis and treatment of Parkinson's disease〔J〕.Curr Top Med Chem,2009;9(10):860-8.
26 郑文荣,徐胜利.多巴胺诱导SH-SY5Y多巴胺能细胞凋亡〔J〕.神经疾病与精神卫生,2008;8(6):427-9.
27 王 涛,纪 超.帕金森病模型大鼠纹状体内氧化应激与细胞凋亡蛋白的表达〔J〕.中国康复理论与实践,2009;15(5):431-3.
28 张春阳.MPTP小鼠黑质神经元凋亡及相关蛋白表达与还原型谷胱甘肽的干预研究〔J〕.中国煤炭工业医学杂志,2009;12(7):1114-6.
29 Burguillos MA,Deierbory T,Kavanagh E,et al.Caspase signalling controls microglia activation and neurotoxicity〔J〕.Nature,2011;472(7343):319-24.
30 Mogi M,Togari A,Kondo T,et al.Nagatsu,Caspase activities and tumor necrosis factor receptor R1(p55)level are elevated in the substantia nigra from parkinsonian brain〔J〕.J Neural Transm,2000;107:335-41.
31 Yamada M,Kida K,Amutuhaire W,et al.Gene disruption of caspase-3 prevents MPTP-induced Parkinson's disease in mice〔J〕.Biochem Biophys Res Commun,2010;402(2):312-8.
32 Kanthasamy A,Jin H,Mehrotra S,et al.Novel cell death signaling pathways in neurotoxicity models of dopaminergic degeneration:relevance to oxidative stress and neuroinflammation in Parkinson's disease〔J〕.Neuro Toxicol,2010;31:555-61.
33 Levy OA,Malagelada C,Greene LA.Cell death pathways in Parkinson's disease:proximal triggers,distal effectors,and final steps〔J〕.Apoptosis,2009;14(4):478-500.

