大鼠原位肺移植后CD8+调节性T细胞的变化*
郭海周,赵 松,崔广晖,李玮浩,王建军,江 科
1)郑州大学第一附属医院胸外科 郑州 450052 2)华中科技大学附属协和医院胸外科 武汉 430022
排斥反应以及免疫抑制相关并发症对肺移植患者术后存活时间和生存质量构成严重挑战,采取一定措施使受体对供体抗原产生长期耐受而又不影响其他免疫功能有望解决以上难题。调节性T细胞(Treg)由于具备发挥自我耐受和保持免疫稳态的特性,正在成为移植领域一项颇具前景的治疗策略。在大鼠心脏移植模型中,CD8+Treg可以通过直接接触方式或者由吲哚胺2,3-双加氧酶发挥免疫调节作用,从而产生移植耐受[1],但其对肺移植的作用尚未有相关的研究。作者观察了大鼠原位肺移植后CD8+Treg的变化,报道如下。
1 材料与方法
1.1实验动物选用SPF级8~10周Lewis大鼠35只和6~8周Wistar大鼠20只(均购自北京维通利华实验动物技术有限公司)构建原位左肺移植模型[2],其中同种移植组(n=20)为Wistar→Lewis,同基因移植组(n=5)为Lewis→Lewis。对照组(n=5)选取Lewis大鼠,左侧开胸后单纯肺门阻断30 min构建假移植模型[3]。对照组与同基因移植组动物于术后7 d被处死取材;同种移植组动物分批于术后3、7、14、28 d被处死取材;每批5只。
1.2标本采集全麻及气管插管后正中切开胸腹部,肝素化后切除脾脏,研磨法获取单细胞悬液,加入红细胞裂解液去除红细胞,留取白细胞备用。右心房抽取2 mL静脉血,PBS倍比稀释后小心加到淋巴细胞分离液表层,提取外周血单个核细胞(PBMC)备用。切除左心耳,PBS右室流出道灌注,冲净肺内血液。整块切除心肺组织,1.5 mL PBS经气管左肺灌洗(4次)。切除左肺门部淋巴结1~2枚,研磨法获取淋巴细胞备用。切除左肺,均分3份分别用于常规病理检查、流式细胞术及冻存备份。
1.3实验试剂小鼠抗大鼠CD3-FITC、CD8-PE-Cy7、CD25-APC及破膜穿孔液购自eBioscience公司;小鼠抗大鼠CD4-APC、CD4-APC-Cy7及CD45RC-PE购自Biolegend公司;兔抗CD3、CD4、CD8多克隆抗体购自Bioss Inc公司;胶原酶Ⅰ和RPMI 1640培养基购自Invitrogen公司;DNA酶及戊巴比妥钠购自Sigma-Aldrich公司。其他常用分子生物学试剂购自湖北医药集团,均为分析纯。
1.4肺组织HE染色40 g/L多聚甲醛固定切除的肺组织24 h,乙醇梯度脱水透明,蜡块包埋保存,制5 μm厚组织切片,脱蜡后染色,之后脱水透明,封片观察。
1.5流式细胞术将拟匀浆肺组织剪碎后加入胶原酶Ⅰ溶液3 h,制作单细胞悬液。取5×(105~106)个细胞,参照流式细胞术抗体说明书加入适量的表面抗体,冰上避光反应30 min。PBS洗涤后加入500 μL Foxp3固定/穿孔工作液,冰上破膜30 min。穿孔缓冲液洗涤后加入抗Foxp3-PE,30 min后PBS洗涤2次,上流式细胞仪检测各亚型淋巴细胞。实验重复5次。
1.6统计学处理采用SPSS 13.0进行分析,移植术后1周同基因移植组和同种移植组间CD8+Treg所占比例的比较采用两独立样本的t检验,检验水准α=0.05。
2 结果
2.1同种移植组与同基因移植组大鼠肺组织的病理变化同种移植组肺组织切片可见到与人类肺移植后排斥反应相当的典型表现,即环血管浸润的袖状单个核细胞群。术后3 d排斥反应以1~2级为主,术后7 d以2~3级为主,术后2周后则以3级以上病变为主。而同基因移植组和对照组肺组织切片镜下观察接近正常。见图1。

图1 各组大鼠肺移植1周后肺组织HE染色结果(×100)
2.2CD8+CD45RC-Treg对移植肺的免疫调节作用将淋巴细胞以CD45RC进行标记后,可以看到,CD8+T细胞分为CD8+CD45RC+和CD8+CD45RC-2群,同基因移植组肺组织中CD8+CD45RC-占CD8+T细胞的比例高于同种移植组[(30.68±5.25)%vs(18.04±4.65)%,t=4.030,P=0.004]。
2.3肺移植后CD8+CD45RC-Treg的空间分布规律不同组织CD8+CD45RC-Treg占CD3+和CD8+T细胞的比例见表1、2。

表1 肺移植1周后不同组织CD8+CD45RC-Treg/CD3+的差异 %
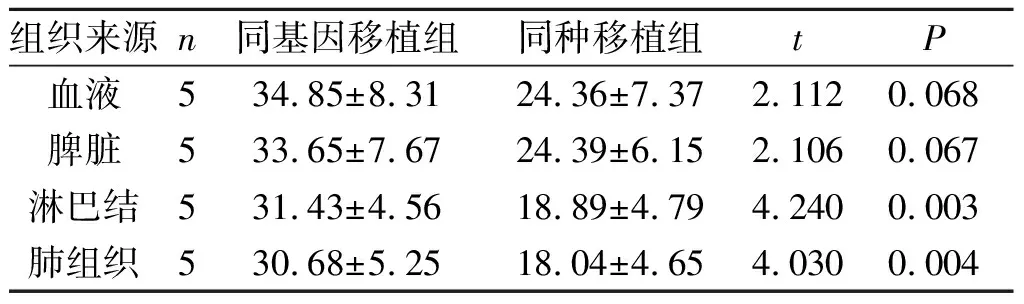
表2 肺移植后1周后不同组织CD8+CD45RC-Treg/CD8+的差异 %
2.4肺移植后CD8+CD45RC-Treg的时间分布规律对同种移植组的肺组织观察结果显示,随着术后时间的延长和排斥强度的增加,其数量呈下降趋势。
3 讨论
近年来,人们发现,体内存在一些具有调节属性的CD8+T细胞。经过抗CD3处理后或者在上皮细胞、抗原的慢性刺激下,机体出现能够抑制淋巴细胞增殖的CD8+T细胞[4-8],在功能上它们均属于Treg范畴,但细胞表型却呈现出较大的异质性,目前尚未发现CD8+Treg的特征性标志物。
作者以CD45RC对大鼠的CD8+T细胞进行标记,将CD8+T细胞分为CD45RC+和CD45RC-2个类型。研究[4]证实,在体外抗原提呈细胞作用下,CD45RC+CD8+T细胞能分泌IL-2和IFN-γ,具备细胞毒性功能,而CD45RC-CD8+T细胞则能通过分泌IL-4、IL-10和IL-13,发挥调节功能。对于接受过供体特异性血液输注的大鼠,移植肝脏内持续性的CD45RC-浸润有助于延长移植物存活时间[9],说明在功能上CD45RC-CD8+T细胞应该归类于CD8+Treg。在该研究中,作者顺利地检测到了该群细胞,提示其在肺移植术后的免疫耐受方面可能通过特定机制发挥作用。和CD8+CD25+Foxp3+Treg不同的是,其在淋巴细胞内占有较高的比例,经过2个表面标志物即能达到鉴定和高通量分离的目的。
研究表明,在灵长类和啮齿类生物中,当以CD40免疫球蛋白阻断CD40-CD40L间的相互作用后能够诱导CD8+CD45RC-Treg的产生[10],从而导致MHC完全不匹配的同种异体移植物的免疫耐受[1, 11]。在该研究中,可以看到,同基因移植的肺组织内该群细胞的数量要多于同种移植者。提示该群细胞可能作为一种保护因素存在于肺组织中,其所具有的免疫调节作用有助于减轻移植术后的肺排斥。
进一步比较不同组织间CD8+CD45RC-Treg的差异,同基因移植组肺组织和肺门淋巴结内该群细胞比例高于同种移植组,而在血液和脾脏中差别不大,提示该群细胞可能主要在局部发挥免疫调节作用。导致这种区域性差异分布的原因目前尚不清楚,可能与循环Treg向移植肺内移动有关,也可能是局部Treg的扩增或者非Treg向Treg转化的结果[12]。
[1] Li XL, Menoret S, Bezie S, et al. Mechanism and localization of CD8 regulatory T cells in a heart transplant model of tolerance[J]. J Immunol, 2010, 185(2):823
[2] Guo H, Nie J, Fan K, et al. Improvements of surgical techniques in a rat model of an orthotopic single lung transplant[J]. Eur J Med Res, 2013, 18(1):1
[3] 郭海周, 张春芳, 张恒. 鼠肺缺血预处理后肺组织中热休克蛋白27检测[J]. 郑州大学学报:医学版, 2009, 44(1):81
[4] Xystrakis E, Cavailles P, Dejean AS, et al. Functional and genetic analysis of two CD8 T cell subsets defined by the level of CD45RC expression in the rat[J]. J Immunol, 2004, 173(5):3140
[5] Subra JF, Cautain B, Xystrakis E, et al. The balance between CD45RChigh and CD45RClow CD4 T cells in rats is intrinsic to bone marrow-derived cells and is genetically controlled[J]. J Immunol, 2001, 166(5):2944
[6] Bisikirska B, Colgan J, Luban J, et al. TCR stimulation with modified anti-CD3 mAb expands CD8+ T cell population and induces CD8+CD25+ Tregs[J]. J Clin Invest, 2005, 115(10):2904
[7] Allez M, Brimnes J, Dotan I, et al. Expansion of CD8+ T cells with regulatory function after interaction with intestinal epithelial cells[J]. Gastroenterology, 2002, 123(5):1516
[8] Lu L, Cantor H. Generation and regulation of CD8(+) regulatory T cells[J]. Cell Mol Immunol, 2008, 5(6): 401
[9] Miyanari N, Yamaguchi Y, Matsuno K, et al. Persistent infiltration of CD45RC-CD4+ T cells, Th2-like effector cells, in prolonging hepatic allografts in rats pretreated with a donor-specific blood transfusion[J]. Hepatology, 1997, 25(4):1008
[10]Guillonneau C, Hill M, Hubert FX, et al. CD40Ig treatment results in allograft acceptance mediated by CD8CD45RC T cells, IFN-gamma, and indoleamine 2,3-dioxygenase[J]. J Clin Invest, 2007, 117(4):1096
[11]Guillot C, Guillonneau C, Mathieu P, et al. Prolonged blockade of CD40-CD40 ligand interactions by gene transfer of CD40Ig results in long-term heart allograft survival and donor-specific hyporesponsiveness, but does not prevent chronic rejection[J]. J Immunol, 2002, 168(4): 1600
[12]Neujahr DC, Cardona AC, Ulukpo O, et al. Dynamics of human regulatory T cells in lung lavages of lung transplant recipients[J]. Transplantation, 2009, 88(4):521

