血清对SH-SY5Y细胞吗啡戒断后ERK1/2、p38和JNK磷酸化表达的影响*
李文杰,王明洋,白银亮,程月芳,李 静,刘 宇,张 旗#
1)郑州大学药学院临床药学系 郑州 450001 2)兰州大学第二医院药剂科 兰州 730030 3)河南省肿瘤医院药剂科 郑州 450008
细胞外信号调节激酶(extracelluar signal-regulated kinase,ERK)是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族中的一员,有研究[1]表明ERK(尤其是ERK1/2)信号转导通路参与吗啡依赖戒断过程。多种细胞模型被用于研究吗啡依赖和戒断过程中ERK1/2磷酸化的表达情况,但研究结果并不一致,甚至相反;作者还发现不同研究者建立细胞吗啡依赖与戒断模型中所用的血清浓度和纳洛酮浓度等实验条件并不相同[2-5]。而血清作为体外细胞培养必需的一种天然培养基,成分复杂,其中含有的大量促生长的成分如生长因子、激素、贴壁因子等对MAPKs家族激酶活性的影响较大[6-7],所以作者推测血清对研究吗啡依赖与戒断过程中ERK的磷酸化水平会有明显影响。神经母细胞瘤细胞(SH-SY5Y)来源于神经母细胞瘤细胞(SK-N-SH)株[8],表达μ、δ阿片受体[9],已广泛用于建立细胞吗啡依赖和戒断模型。该实验拟建立SH-SY5Y吗啡依赖戒断模型,探讨血清浓度和纳洛酮浓度对ERK1/2、p38和JNK蛋白磷酸化表达的影响,以期确证影响ERK磷酸化表达的关键因素,为今后研究吗啡依赖及戒断机制提供适当的方法。
1 材料与方法
1.1试剂及仪器DMEM/F12(11)培养基和青、链霉素均购自赛默飞世尔生物化学制品(北京)有限公司(批号N×L0742);胎牛血清(FBS)购自上海依科赛生物制品有限公司(批号120502);抗β-actin抗体 (兔抗人)、抗p-ERK1/2、p-p38和p-JNK抗体(兔抗人)购自Cell Signalling Technology公司;蛋白酶抑制剂(Cat.No.04 693 116 001)、磷酸酶抑制剂(Cat. No.04 906 845 001 )均购自Roche公司;盐酸纳洛酮注射液(贵州联合西创药物有限公司,批号20110601);盐酸吗啡注射液(东北制药集团沈阳第一制药有限公司,批号110111-2)。其他试剂均为国产分析纯。CJ-2F超净工作台(苏州冯氏实验动物设备有限公司),CO2培养箱(美国Thermo公司),Z-323型高速冷冻离心机(德国HERMLE公司)。
1.2细胞来源、培养及分组SH-SY5Y细胞由北京宣武医院惠赠,在含有体积分数10%的FBS、100 kU/L青霉素和100 mg/L链霉素的DMEM/F12(11)培养基中,于37 ℃、体积分数为5% CO2孵箱中培养。细胞的冻存、复苏、传代按照常规方法进行。取对数生长期的SH-SY5Y细胞,以(1~3)×105个/孔接种于6孔板中,分别设无血清培养组和有血清培养组。待细胞生长达80%~90%融合时,无血清培养组以不含血清的DMEM/F12(11)培养基作用10 h后,加入10 μmol/L的吗啡孵育48 h后,戒断组给予10 μmol/L的纳洛酮戒断10、30和60 min,空白对照组不经吗啡处理,吗啡组用吗啡孵育48 h后不经纳洛酮处理;或者用10 μmol/L的吗啡孵育48 h后,戒断组以5、10和30 μmol/L纳洛酮戒断10 min。有血清培养组与上述培养过程完全一致,仅在培养过程中加入体积分数10%FBS。
1.3p-ERK1/2、p-p38和p-JNK蛋白表达的Westernblot检测弃去6孔板中的培养液,冰浴的PBS洗2次,加入细胞裂解液 (每孔加入100 μL RIPA裂解缓冲液、4 μL 蛋白酶抑制剂、10 μL磷酸酶抑制剂) 冰上裂解30 min。然后,利用冷冻离心机4 ℃ 12 000 r/min离心15 min,吸取上清。采用BCA法测定样品中总蛋白质的含量,调整上样量为30~40 μg。利用SDS-PAGE凝胶电泳分离蛋白,并转移至PVDF膜上。脱脂奶粉封闭PVDF膜2 h,加入一抗(兔抗人p-ERK1/2、p-p38和p-JNK抗体均按11 000稀释) 4 ℃过夜。TBST漂洗3次,10 min/次,加入二抗(按110 000稀释,辣根过氧化物酶标记的羊抗兔抗体)室温孵育2 h。再次以TBST漂洗3次,10 min/次,ECL显色,利用软件Image pro plus 6.0比较条带的积分光密度。
1.4统计学处理采用SPSS 15.0进行分析,应用单因素方差分析及LSD-t检验比较各组光密度值的差异,检验水准α=0.05。
2 结果
2.1有和无血清培养对10μmol/L纳洛酮戒断不同时间后SH-SY5Y细胞中p-ERK1/2表达的影响见图1和表1。

图1 有(上)和无(下)血清培养对10 μmol/L纳洛酮戒断不同时间SH-SY5Y细胞中p-ERK1/2表达的影响
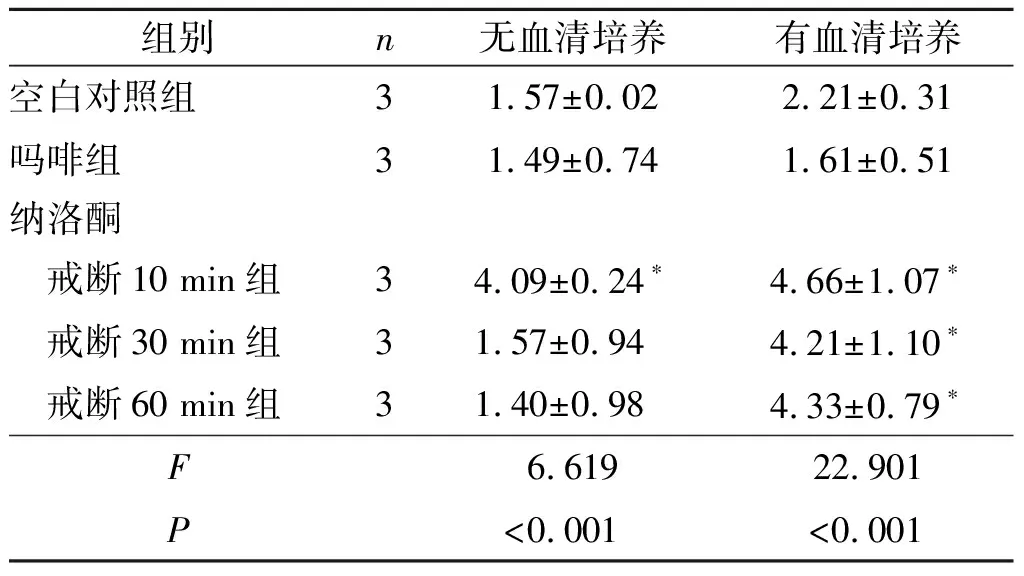
表1 有和无血清培养对10 μmol/L纳洛酮戒断不同时间SH-SY5Y细胞中p-ERK1/2表达的影响
*:与吗啡组比较,P<0.05。
2.2有和无血清培养对不同浓度纳洛酮戒断SH-SY5Y细胞中p-ERK1/2表达的影响见表2。

表2 有和无血清培养对不同浓度纳洛酮戒断SH-SY5Y细胞中p-ERK1/2表达的影响
*:与吗啡组比较,P<0.05。
2.3有和无血清培养对10μmol/L纳洛酮戒断不同时间SH-SY5Y细胞中p-p38、p-JNK表达水平的影响见图2,表3、4。

图2 有和无血清培养对10 μmol/L纳洛酮戒断不同时间SH-SY5Y细胞中p-p38(上)、p-JNK(下)表达水平的影响

表3 有和无血清培养对10 μmol/L纳洛酮戒断不同时间SH-SY5Y细胞中p-p38表达的影响
*:与吗啡组比较,P<0.05;△:戒断组间两两比较,P<0.05。

表4 有和无血清培养对10 μmol/L纳洛酮戒断SH-SY5Y细胞中p-JNK表达的影响
*:与吗啡组比较,P<0.05;△:戒断组间两两比较,P>0.05。
3 讨论
该实验成功建立了SH-SY5Y细胞吗啡依赖戒断模型。结果显示纳洛酮戒断能诱发无血清培养组细胞ERK1/2磷酸化水平的瞬时升高,戒断后10 min时达峰值,接着迅速恢复至基值水平;而有血清培养组细胞则表现出ERK1/2磷酸化水平的持续升高,从戒断后10 min一直持续到60 min。在无和有血清培养条件下,纳洛酮戒断均引起p38磷酸化水平时间依赖性递增,也能引起JNK磷酸化水平的增加,但戒断不同时间点之间JNK磷酸化水平差异无统计学意义。
Burgess等[10]研究表明血清能剂量依赖性地上调ERK1/2的磷酸化水平。Lee等[7]也发现FBS能在短时间内(2 min)上调ERK1/2的磷酸化水平,并导致p-ERK由胞质转位至胞核,而MEK特异抑制剂U0126能够显著抑制FBS引起的ERK1/2蛋白磷酸化。作者的研究也证实了这一点,体积分数为10% FBS确实能明显增加p-ERK1/2、p-JNK和p-p38的水平。
关于ERK参与吗啡成瘾及戒断过程的报道很多,但作者发现在动物模型中针对吗啡调节ERK磷酸化研究在不同对象中研究结果并不一致,甚至在同一对象不同脑区的研究结果也不一致[1,11]。这就表明吗啡与ERK的作用是一复杂的信号转导过程。但较为一致的是,纳洛酮戒断后均表现出ERK的磷酸化水平急剧升高。在细胞模型中,也有各种不同的结果[12-14]。近年来的研究[3]结果显示,体积分数0.5%FBS条件下培养SH-SY5Y细胞,1 μmol/L吗啡作用72 h能引起ERK1/2磷酸化水平降低,3 μmol/L纳洛酮戒断10 min后进一步降低,但随着时间延长,又逐渐恢复升高。有学者[4]发现,体积分数10%FBS条件下培养SH-SY5Y细胞,1 μmol/L芬太尼作用60 min内ERKs磷酸化水平没有明显变化,慢性作用7 d没有明显变化,10 μmol/L纳洛酮戒断也没有明显变化。 Ferrer-Alcon等[5]也发现体积分数10%FBS条件下培养SH-SY5Y细胞,1 μmol/L吗啡作用1~60 min,3 min后就能检测到ERK磷酸化水平的明显升高,30 min达峰值,60 min时则恢复至基值水平。作者在实验中也发现血清对细胞吗啡依赖模型中ERK1/2磷酸化表达时程有明显影响,血清能明显延长ERK1/2磷酸化高表达持续时间。作者还发现5~30 μmol/L的纳洛酮对ERK1/2磷酸化表达时程并无明显影响。由此作者推测,影响SH-SY5Y细胞吗啡依赖戒断模型中ERK1/2磷酸化表达的主要影响因素为血清。
JNK、p38MAPK通路是与ERK1/2并行的MAPKs信号通路。研究[15]表明,哺乳类细胞可以通过多种机制维持其每一条MAPKs信号通路转导的特异性。即使在细胞凋亡过程中ERK1/2与JNK、p38也表现出相反的作用[16-17]。研究[13]显示,纳洛酮催促吗啡戒断能诱导多个区域ERK1/2磷酸化的高表达,但对JNK和p38磷酸化没有明显影响。作者的实验结果显示,纳洛酮能诱发ERK1/2、JNK和p38蛋白磷酸化水平高表达,但对其表达时程的影响并不一致,有血清培养能明显延长p-ERK高表达持续时间,由此可见,血清因素对研究纳洛酮吗啡戒断ERK1/2磷酸化表达有明显影响,而不同浓度纳洛酮戒断对ERK1/2磷酸化水平没有明显影响,这就为进一步在SH-SY5Y细胞中探索纳洛酮戒断机制提供了方法学依据。
[1] Narita M,Ioka M, Suzuki M, et al.Effect of repeated administration of morphine on the activity of extracellular signal regulated kinase in the mouse brain[J].Neurosci Lett,2002,324(2):97
[2] Chantara W,Watcharasit P,Thiantanawat A, et al.Acrylonitrile-induced extracellular signal-regulated kinase (ERK) activation via protein kinase C (PKC) in SK-N-SH neuroblastoma cells[J].J Appl Toxicol,2006,26(6):517
[3] Bilecki W,Zapart G,Ligeza A, et al.Regulation of the extracellular signal-regulated kinases following acute and chronic opioid treatment[J].Cell Mol Life Sci,2005,62(19/20):2369
[4] Mouledous L,Diaz MF,Gutstein HB.Modulation of extracellular signal-regulated kinase(ERK) activity by acute and chronic opioid treatment in neuronal and glial cell lines[J].J Neurochem,2004,90(6):1371
[5] Ferrer-Alcon M,Garcia-Fuster MJ,La Harpe R, et al.Long-term regulation of signalling components of adenylyl cyclase and mitogen-activated protein kinase in the pre-frontal cortex of human opiate addicts[J].J Neurochem,2004,90(1):220
[6] 朱萍,冯吉,杨荟敏,等.血清通过调节 mGluR1 介导的信号通路调控细胞的生长与凋亡[J]. 中国生物化学与分子生物学报,2010, 26(4):332
[7] Lee JH,Johnson PR,Roth M, et al.ERK activation and mitogenesis in human airway smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol,2001,280(5):L1019
[8] 刘守跃,张影,胡林森,等.体外诱导SH-SY5Y细胞凋亡的氧糖剥离再灌注模型的建立及评价[J]. 吉林大学学报:医学版, 2012, 38(4): 658
[9] Yu VC,Richards ML,Sadee W.A human neuroblastoma cell line expresses mu and delta opioid receptor sites[J].J Biol Chem, 1986,261(3):1065
[10]Burgess JK,Lee JH,Ge Q, et al.Dual ERK and phosphatidylinositol 3-kinase pathways control airway smooth muscle proliferation: differences in asthma[J].J Cell Physiol,2008,216(3):673
[11]Asensio VJ,Miralles A,Garcia-Sevilla JA.Stimulation of mitogen-activated protein kinase kinases (MEK1/2) by mu-, delta- and kappa-opioid receptor agonists in the rat brain: regulation by chronic morphine and opioid withdrawal[J]. Eur J Pharmacol,2006,539(1/2):49
[12]Li T,Hou Y,Cao W, et al.Naloxone-precipitated withdrawal enhances ERK phosphorylation in prefrontal association cortex and accumbens nucleus of morphine-dependent mice[J].Neurosci Lett,2010,468(3):348
[13]Cao JL,He JH,Ding HL, et al. Activation of the spinal ERK signaling pathway contributes naloxone-precipitated withdrawal in morphine-dependent rats[J].Pain,2005,118(3):336
[14]Schulz S,Hollt V.Opioid withdrawal activates MAP kinase in locus coeruleus neurons in morphine-dependent rats in vivo[J].Eur J Neurosci,1998,10(3):1196
[15]Minden A,Lin A,Smeal T, et al.c-Jun N-terminal phosphorylation correlates with activation of the JNK subgroup but not the ERK subgroup of mitogen-activated protein kinases[J].Mol Cell Biol,1994,14(10):6683
[16]Xia Z,Dickens M,Raingeaud J, et al.Opposing effects of ERK and JNK-p38 MAP kinases on apoptosis[J].Science,1995,270(5240):1326
[17]甄永占,章广玲,赵毓芳,等.丝裂原活化蛋白激酶在力达霉素抑制鼠骨髓瘤细胞增殖和诱导凋亡中的作用[J]. 吉林大学学报:医学版,2012, 38(6):1129

