芬太尼对MCF-7乳腺癌细胞增殖及迁移和凋亡的影响
阳丽云 曾涟 莫浪平 韦雄丽
阿片类药物因其强大的镇痛作用,在癌痛的治疗中起着 非常重要的作用[1]。目前研究认为阿片类药物除对癌痛患者具有镇痛效果以外,对癌细胞的增殖、转移和凋亡也产生一定影响[2-4]。阿片类中的代表药物芬太尼,广泛用于手术患者及癌痛患者的镇痛。国内张咸伟等[5]研究表明,芬太尼抑制MCF-7乳腺癌细胞增殖且具有时间和剂量依赖性。其研究中采用未去除雌激素的新生小牛血清进行实验。Berthois等[6]研究发现,酚红、雌激素都会对MCF-7细胞的增殖产生影响,建议在研究MCF-7细胞的增殖时尽量排除这些因素的干扰。所以本实验拟在去激素新生小牛血清及无酚红培养基条件下研究芬太尼对MCF-7乳腺癌细胞增殖、迁移和凋亡的影响。以观察在不同培养条件下,芬太尼对MCF-7乳腺癌细胞的影响是否存在差异。
1 材料与方法
1.1 实验材料 MCF-7乳腺癌细胞由广西医科大学覃怡师姐惠赠。含酚红高糖DMEM培养基购自Hyclone公司;无酚红高糖DMEM培养基购自Wisent公司;新生小牛血清购自杭州四季青公司;活性炭购自西陇化工股份有限公司;葡聚糖4万南购自京都莱生物技术有限公司;MTT粉末及二甲基亚砜购自Sigma公司;Annexin V-FITC细胞凋亡检测试剂盒购自invertrogen公司;芬太尼购自宜昌人福药业有限责任公司;倒置相差显微镜为Olympus公司;酶标仪为美国Thermo公司;流式细胞检测仪为Beckman Coulter公司。
1.2 细胞的培养 细胞培养于含10%新生小牛血清、100 μg/mL链霉素、100 U/ml青霉素的含酚红的高糖DMEM培养基中,在37 ℃、5%CO2培养箱中培养,当细胞达80%~90%融合时传代,以1:2的比例传代。在进行实验处理时更换为含10%去激素新生小牛血清的无酚红高糖DMEM培养基,去激素新生小牛血清的制备参照考朱毅等[7]文献中的方法获得。实验均采用对数生长期细胞。
1.3 细胞增殖的检测 将细胞消化离心后,用含10%去激素新生小牛血清的无酚红DMEM培养基重悬。按照3×104/ml的密度接种于96孔板,200 μl/孔。设置正常对照组(C组)、芬太尼组(F1组、F2组、F3组、F4组、F5组)和凋零组。24 h后,F1、F2、F3、F4、F5组加入芬太尼,使芬太尼终浓度分别为1、0.1、0.01、0.001、0.0001 μmol/L,C组加入等体积的PBS,凋零组为无细胞只加培养基组,每组设6个复孔。放入培养箱中继续培养。在24、48、72 h三个时间点,加入MTT(5 mg/ml)20μl,继续于培养箱中培养4 h,弃掉培养液,每孔加入二甲基亚砜200μl,摇床缓慢振荡10 min,用酶标仪在492 nm波长下测定吸光度值。实验重复3次。
1.4 细胞迁移的检测 将细胞用含10%去激素新生小牛血清的无酚红DMEM培养基重悬,以2×105/ml的密度接种于6孔板内,每孔1 ml,待细胞长至90%满时,用规格为200μl的Tip头对细胞进行划痕,用PBS轻轻吹打以去除刮掉的细胞,设置C组、F1、F2、F3、F4、F5组,F1、F2、F3、F4、F5组加入芬太尼使芬太尼终浓度分别为1、0.1、0.01、0.001、0.0001 μmol/L,C组为对照组加入等体积PBS,每组设3个复孔,分别于0、24 h进行拍照,采用Image Pro Plus6分析图像,计算迁移距离。实验重复3次。
1.5 细胞凋亡的检测 将细胞用含10%去激素新生小牛血清的无酚红DMEM培养基重悬后,按2×105/ml的密度接种于6孔板内,每孔1 ml,24 h后,F1、F2、F3、F4、F5组加入芬太尼使芬太尼终浓度分别为1、0.1、0.01、0.001、0.0001 μmol/L,C组加入等体积的PBS,各组细胞继续培养24 h后,用0.25%不含EDTA的胰酶对细胞进行消化,收集细胞,采用Annexin Ⅴ-FITC试剂盒(按照说明书进行)结合流式细胞仪检测细胞凋亡率。每组3个复孔,实验重复3次。
1.6 统计学处理 采用SPSS 16.0软件进行统计分析,计量资料采用(±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度芬太尼对MCF-7乳腺癌细胞增殖的影响 作用MCF-7乳腺癌细胞24、48、72 h时,芬太尼组各组OD值与C组比较差异无统计学意义(P>0.05)。见表1。
表1 芬太尼对MCF-7乳腺癌细胞增殖的影响(±s)
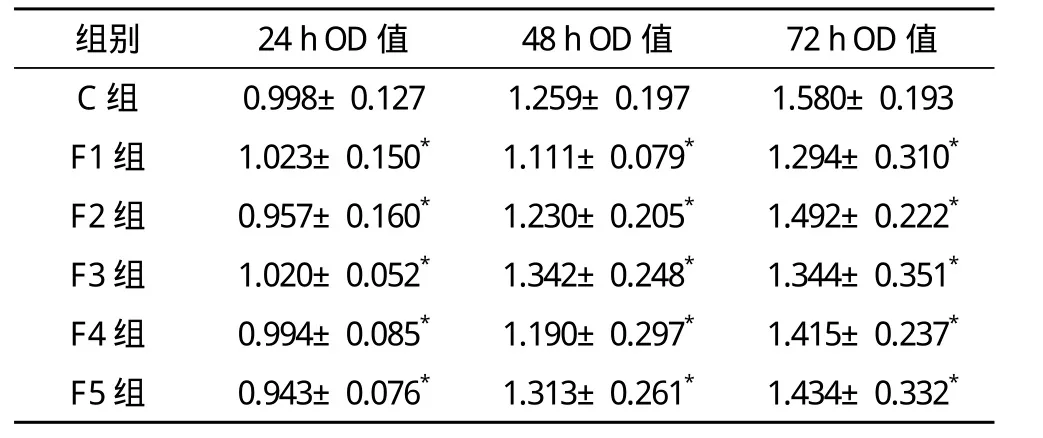
表1 芬太尼对MCF-7乳腺癌细胞增殖的影响(±s)
*与C组比较,P>0.05
组别 24 h OD值 48 h OD值 72 h OD值C 组 0.998±0.127 1.259±0.197 1.580±0.193 F1 组 1.023±0.150* 1.111±0.079* 1.294±0.310*F2 组 0.957±0.160* 1.230±0.205* 1.492±0.222*F3 组 1.020±0.052* 1.342±0.248* 1.344±0.351*F4 组 0.994±0.085* 1.190±0.297* 1.415±0.237*F5 组 0.943±0.076* 1.313±0.261* 1.434±0.332*
2.2 不同浓度芬太尼对MCF-7乳腺癌细胞迁移的影响 作用MCF-7乳腺癌细胞24 h时,C组、F1组、F2组、F3组、F4 组、F5 组迁移距离分别为:(191.95±43.05)μm,(212.96±116.83)μm,(260.43±112.90)μm,(239.54±43.33)μm,(231.10±45.62)μm,(234.81±61.59)μm。芬太尼组各组细胞迁移距离与C组比较,差异无统计学意义(P>0.05)。细胞划痕结果如图1所示。
2.3 不同浓度芬太尼对MCF-7乳腺癌细胞凋亡的影响作用MCF-7乳腺癌细胞24 h时,C组、F1组、F2组、F3组、F4组、F5组凋亡率分别为:(31.84±12.85)%,(22.53±8.75)%,(34.02±11.23)%,(26.72±14.18)%,(28.87±5.40)%,(33.23±17.11)%,芬太尼组各组凋亡率与C组比较,差异无统计学意义(P>0.05)。
3 讨论
乳腺癌为女性常见恶性肿瘤,与女性健康密切相关。乳腺癌细胞的增殖、迁移和凋亡与乳腺癌的生长和转移密切相关,因此一直是研究的热点。石利涛等[8]从治疗药物的角度,研究发现干扰素-γ、干扰素-α2b的联合应用可诱导MCF-7乳腺癌细胞凋亡。本实验拟从癌痛镇痛的角度,研究常用镇痛药物芬太尼对雌激素受体阳性的MCF-7乳腺癌细胞增殖、迁移和凋亡的影响,为临床研究奠定基础。

图1 芬太尼对MCF-7乳腺癌细胞迁移的影响 (划痕实验,×40倍)
本实验研究发现,在含去激素新生小牛血清的无酚红培养基培养条件下,芬太尼对MCF-7乳腺癌细胞增殖、迁移和凋亡无明显影响。张咸伟等[5]研究发现,芬太尼浓度大于0.1 μmol/L时,MCF-7乳腺癌细胞增殖活性明显下降。赵海燕等[9]研究认为,芬太尼抑制MCF-7乳腺癌细胞侵袭。丁汉琳等[10]研究发现,芬太尼大于5 μmol/L时,MCF-7凋亡细胞明显增加。本实验与以上研究结论产生差别的主要原因考虑为培养条件不一致导致的。本实验采用的是去激素新生小牛血清和无酚红培养基,张咸伟、赵海燕等采用的是未去除激素的新生小牛血清。Berthois等[6]研究发现,酚红、雌激素会对雌激素受体阳性的MCF-7细胞的增殖产生影响,建议在研究MCF-7细胞的增殖时尽量排除这些因素的干扰。因此本实验采用去激素新生小牛血清和无酚红培养基,拟尽量减少干扰因素的影响,研究芬太尼对MCF-7细胞的直接作用。Maneckjee等[11]研究发现,在含激素新生小牛血清中,吗啡具有抑制MCF-7细胞增殖的作用,但在去除了新生小牛血清中的激素后,吗啡并不表现出抑制MCF-7乳腺癌细胞增殖的作用。并进一步发现添加17β-雌二醇可以增加吗啡对MCF-7细胞的增殖抑制效应。但是雌激素通过何种途径影响MCF-7乳腺癌细胞对吗啡的敏感性的机制待于进一步研究[11]。张咸伟、丁汉琳等进一步研究发现,μ受体拮抗剂纳洛酮并不能拮抗芬太尼对MCF-7细胞的抑制增殖作用和促凋亡作用[5,10]。
因此,根据本实验结果与张咸伟等实验结果的比较,推测芬太尼可能不是直接作用于MCF-7乳腺癌细胞产生抑制效应,而是有可能通过影响培养基中雌激素类物质与MCF-7乳腺癌细胞表面雌激素受体的作用而产生抑制效应,也有可能是雌激素影响MCF-7乳腺癌细胞对芬太尼的敏感性,这些推测有待于进一步的实验研究证实。
[1]Friesen C, Bacher S, Hormann I,et al. Cytotoxic effects of opioids on cancer cell lines[J].Int J Clin Pharmacol Ther, 2011,49(1):60-62.
[2]Lazarczyk M,Matyja E,Lipkowski A W.A comparative study of morphine stimulation and biphalin inhibition of human glioblastoma T98G cell proliferation in vitro[J].Peptides,2010 ,31(8):1606-1612.
[3]Gach K,Szemraj J, Wyrebska A.The influence of opioids on matrix metalloproteinase-2 and -9 secretion and mRNA levels in MCF-7 breast cancer cell line[J].Mol Biol Rep,2011,38(2):1231-1236.
[4]HatsukariI,Hitosugi N,Ohno R,et al.Induction of apoptosis by morphine in human tumor cell lines in vitro[J].Anticancer Res,2007,27(2):857-864.
[5]张咸伟,丁汉琳,张传汉,等.芬太尼对MCF-7细胞增殖和细胞周期影响研究[J].中国医师杂志,2005,7(1):23-25.
[6]Berthois Y, Katzenellenbogen J A, Katzenellenbogen B S.Phenol red in tissue culture media is a weak estrogen: implications concerning the study of estrogen-responsive cells in culture[J].Proc Natl Acad Sci USA,1986,83(8):2496-2500.
[7]朱毅,舒为群,田怀军.影响 MCF-7细胞增殖试验相关因素的初步研究[J].第三军医大学学报,2003,25(11):977-979.
[8]石利涛,杨宗伟,孙立新,等.干扰素-γ、干扰素-α2b联合应用诱导MCF-7乳腺癌细胞凋亡及机制[J].中国医学创新,2010,7(17):1-2.
[9]赵海燕,张宏波,张海生,等.枸橼酸芬太尼对乳腺癌细胞体外增殖和侵袭的影响[J].中国妇幼保健,2012,27(1):112-114.
[10]丁汉琳,张咸伟,张传汉.芬太尼影响MCF-7细胞凋亡的实验研究[J].实用医学杂志,2004,20(12):1351-1353.
[11]Maneckjee R, Biswas R, Vonderhaar B K.Binding of opioids to human MCF-7 breast vancer cells and their effects on growth[J].Cancer Res,1990,50(8):2234-2238.

