有氧运动和白藜芦醇对II型糖尿病大鼠肝脏氧化应激及NF-κBp65的影响
曹姣,肖国强
(华南师范大学 体育科学学院,广东 广州 510006)
当前,糖尿病已成为全世界危害人类健康的严重性疾病之一,其中 II型糖尿病(T2DM)占到该人群的90%[1]。T2DM是以高血糖和胰岛素抵抗(IR)为主要特征的一种代谢综合症,常伴随有脂代谢异常如脂质异位沉积[2],特别是沉积在肝脏、骨骼肌引起氧化应激和IR等,氧化应激和炎症参与 IR和肥胖相关的代谢紊乱,可通过引起一系列变化导致糖尿病并发症的发生发展[3]。SREBPs(包括SREBP1和SREBP2)是一组螺旋-环螺旋亮氨酸拉链转录因子家族,在代谢率较强器官中高表达,调控胆固醇和脂肪酸代谢的相关酶基因,在脂肪生成、胰岛素敏感性和脂肪酸稳态中扮演非常重要作用的角色[4]。NF-κB为启动炎症反应的重要转录因子,研究发现,选择性敲除高脂饮食大鼠肝脏NF-κB能抑制脂质介导的IR,提示NF-κB在其中起重要作用,可能作为防治IR相关疾病的靶标[5]。
规律运动作为一种非药理学治疗手段[6],具有的多效功能能显著改善 T2DM大鼠高血糖、氧化应激、IR和代谢综合征等[1],但能否通过 SREBPs、NF-κBp65改善肝脏氧化应激和炎症尚不清楚。白藜芦醇(Res)属于芳香植物营养素中的一种多酚类化合物,具有抗氧化[7]、抗炎症[8]和抗细胞凋亡等,能较好改善IR[9]和T2DM的氧化应激状态[7],然而对T2DM肝脏的具体作用机制尚不明确。并且将有氧运动和白藜芦醇联合作为一种新型的干预手段,是否对T2DM有更好的作用?尚未被研究。因此,本研究通过开展7周游泳训练及Res干预,探讨有氧运动和Res对T2DM肝脏的作用机制及联合作用效应,旨在为防治T2DM及其并发症提供一定的实验依据和理论基础,为临床治疗提供新的研究思路和方向。
1 材料与方法
1.1 实验动物
健康SPF级雄性SD大鼠(购自广州中医药大学实验动物中心),体重(180±20) g。正常大鼠以普通饲料(购自广州中医药大学实验动物中心)喂养,T2DM 造模组大鼠以高糖高脂饲料喂养。高糖高脂饲料配方:20%蔗糖,10%猪油,5%蛋黄粉,0.2%胆酸钠,64.8%(均为质量比)。基础饲料由广州花都东信华实验动物养殖场配制。
1.2 T2DM模型大鼠造模
大鼠经高糖高脂饲料喂养5周后按35 mg/kg腹腔注射链脲佐菌素(STZ),STZ现配现用,配好的STZ在避光条件下30 min内完成注射。注射3 d和7 d后,尾静脉取血测试随机血糖浓度,血糖浓度均≥16.7 mmol/L为成模大鼠。
1.3 实验分组
将40只健康SPF级雄性SD大鼠分为正常对照组(C组,8只)、II型糖尿病组(D组,8只)、“II型糖尿病+运动”组(DE组,8只),“II型糖尿病+Res”组(DR组,8只)、“II型糖尿病+运动+Res”组(DER组,8只)。
1.4 运动训练方案
运动组大鼠进行为期7周不负重游泳训练,1周的适应性训练后(10 min/d)进行正式训练,训练时间为第 1周30 min/d,第 2周45 min/d,第3~7周 60 min/d,每周训练6 d。游泳在白色大水桶中进行,每桶4只动物,水深60 cm。
1.5 Res灌胃处理
Res溶于双蒸水中制成(6 mg/mL)悬浊液。采用灌胃的方法按照45 mg/(kg·d)对大鼠进行干预,灌胃组大鼠灌胃每周7 d。对照组大鼠灌以双蒸水。
1.6 标本采集与处理
7周游泳训练和Res给药干预,停止干预36 h后(避免急性运动效应)禁食 12 h,尾静脉取血检测空腹血糖(FBG)和空腹胰岛素(FINS)。之后宰杀大鼠,利用质量分数为10%水合氯醛(3.5~4.0 mL/kg)进行麻醉后,5 min后宰杀大鼠,取肝脏称重并测定肝脏中超氧化物歧化酶(SOD)活性、丙二醛(MDA)、甘油三脂(TG)、总胆固醇(TC),另取少部分组织置于液氮罐中保存待测肝脏中的TNF-a蛋白及SREBP1、SREBP2、NF-κBp65核蛋白。
1.7 检测指标及方法
1)FBG采用 JPS-5怡成血糖仪测定;FINS采用ELISA法测定;肝重采用电子天平测定;SOD、MDA、TG、TC均采用南京建成生物有限公司提供试剂盒测定;TNF-a、nSREBP1、nSREBP2、NF-κBp65 核蛋白测定(北京博奥森生物技术有限公司提供 TNF-a、NF-κBp65、SREBP1、SREBP2多克隆抗体)均参照李树基的Western-blot测试方法[10]。
2)胰岛素抵抗指数(HOMA-IR)计算方法:HOMA-IR =FBG×FINS/22.5。
1.8 统计学方法
各组数据通过Excel2003和SPSS16.0软件包进行统计学分析。实验数据均以平均数±标准差表示,各处理组间数据比较采用双因素方差分析和两样本T检验,显著性水平为P<0.05,非常显著性水平为P<0.01。
2 结果与分析
2.1 各组大鼠FBG、FINS、HOMA-IR的变化
如表1所示,D组(T2DM组)与C组(正常对照组)比较,FBG、HOMA-IR 非常显著升高(P<0.01,P<0.01),FINS显著升高(P<0.05)。与D组比较,DE组、DR组FINS、HOMA-IR显著下降(P<0.05),DER组与D组比较,FINS非常显著降低(P<0.01),而 HOMA-IR显著降低(P<0.05)。
表1 各组大鼠FBG、FINS和HOMA-IR的变化

表1 各组大鼠FBG、FINS和HOMA-IR的变化
与C组比较,1)P<0.05,2)P<0.01;与D组比较,3)P<0.05,4)P<0.01
组别 n/只 c(FBG)/(mmol·L-1) ρ(FINS)/(ng·mL-1) HOMA-IR C 8 5.83±0.46 1.20±0.17 0.357±0.052 D 8 7.25±0.882) 1.54±0.091) 0.517±0.0762)DE 8 6.24±0.62 1.29±0.203) 0.382±0.0563)DR 8 6.60±0.28 1.25±0.423) 0.398±0.0253)DER 8 6.40±0.30 1.13±0.074) 0.367±0.0393)
2.2 各组大鼠肝脏氧化应激水平的变化
如表2所示,与C组比较,D组大鼠肝脏MDA质量摩尔浓度显著升高(P<0.05),而 SOD活性显著下降(P<0.05);与D组比较,DE组、DR组和DER组大鼠肝脏MDA质量摩尔浓度显著下降(P<0.05),SOD活性显著升高(P<0.05),与DER组比较,DE组MDA质量摩尔浓度非常显著升高(P<0.01),而DR组显著升高(P<0.05),DE组、DR组和DER组SOD活性3组之间无显著性差异(P>0.05)。
表2 各组大鼠肝脏MDA表达、SOD活性的变化

表2 各组大鼠肝脏MDA表达、SOD活性的变化
与C组比较,1)P<0.05;与D组比较,2)P<0.05;与DER组比较,3)P<0.05,4)P<0.01
组别 n/只 b(MDA)/(nmol·mg-1) SOD活性/(U·mg-1)C 8 18.96±0.60 506.13±35.12 D 8 30.24±1.071) 438.95±32.261)DE 8 24.71±0.132)4) 477.62±30.562)DR 8 23.41±1.912)3) 439.39±26.642)DER 8 19.29±0.792) 501.01±29.612)
2.3 各组大鼠肝脏脂质各指标的变化
1)各组大鼠肝指数及TG、TC的变化。
如表3所示,与C组比较,D组肝指数、肝脏TG、TC均非常显著升高(P<0.01),与 D组比较,DE组、DR组和 DER组肝指数、肝脏 TG、TC均显著下降(P<0.05),而DE组和DR组较DER组表现为显著升高(P<0.05)。
表3 各组大鼠肝指数及TG、TC的变化
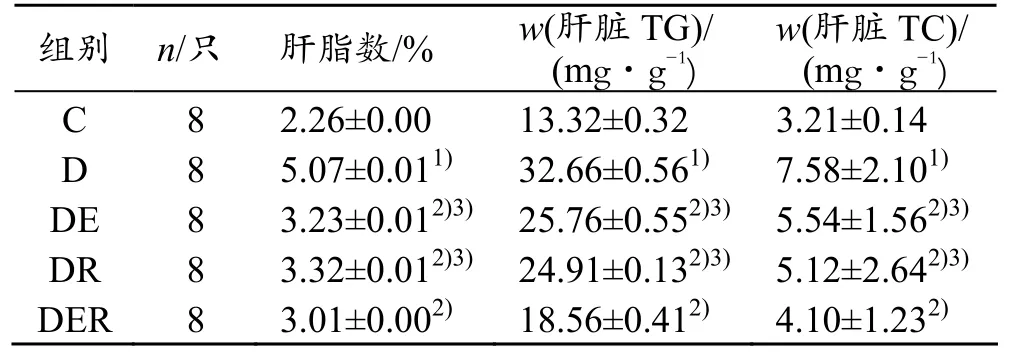
表3 各组大鼠肝指数及TG、TC的变化
与C组比较,1)P<0.01;与D组比较,2)P<0.05;与DER组比较,3)P<0.05
组别 n/只 肝脂数/% w(肝脏TG)/(mg·g-1)w(肝脏 TC)/(mg·g-1)C 8 2.26±0.00 13.32±0.32 3.21±0.14 D 8 5.07±0.011) 32.66±0.561) 7.58±2.101)DE 8 3.23±0.012)3) 25.76±0.552)3) 5.54±1.562)3)DR 8 3.32±0.012)3) 24.91±0.132)3) 5.12±2.642)3)DER 8 3.01±0.002) 18.56±0.412) 4.10±1.232)
2)各组大鼠肝脏SREBPs(SREBP1和SREBP2)核蛋白(nSREBPs)的表达。
由图1可知,与C组比较,D组肝脏中nSREBP1的表达显著升高(P<0.05),与 D组比较,DE组、DR组、DER组肝脏nSREBP1的表达显著降低(P<0.05),与DER组比较,DE组、DR组肝脏中nSREBP1表达显著升高(P<0.05)。由图2可知,与C组比较,D组肝脏nSREBP2表达升高,无显著性差异(P>0.05);与D组比较,DE组、DR组、DER组肝脏中nSREBP2表达逐步呈降低趋势(P>0.05)。
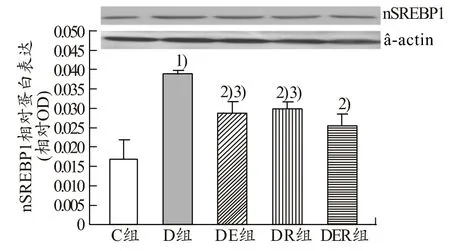
图1 不同组别大鼠肝脏中nSREBP1的表达
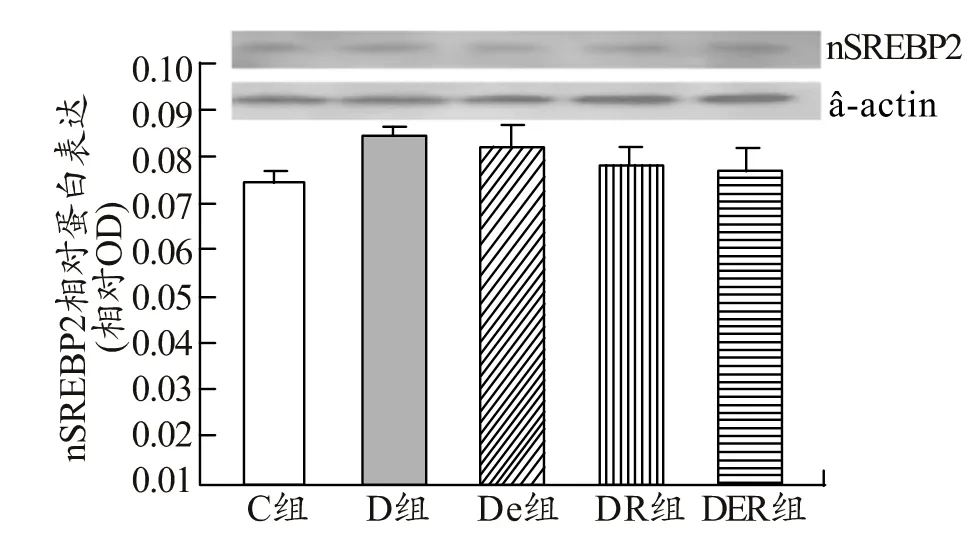
图2 不同组别大鼠肝脏中nSREBP2的表达
2.4 各组大鼠肝脏炎症反应水平(TNF-a)、NF-κBp65核蛋白表达的变化
由图3、图4可知,与C组比较,D组肝脏中TNF-a、NF-κBp65核蛋白表达非常显著升高(P<0.01,P<0.01),与D组比较,DE组、DR组、DER组肝脏中TNF-a、NF-κBp65核蛋白表达均显著降低(P<0.05,P<0.05,P<0.01),与DER组比较,DE组、DR组肝脏中TNF-a、NF-κBp65核蛋白表达均显著升高(P<0.05,P<0.05)。
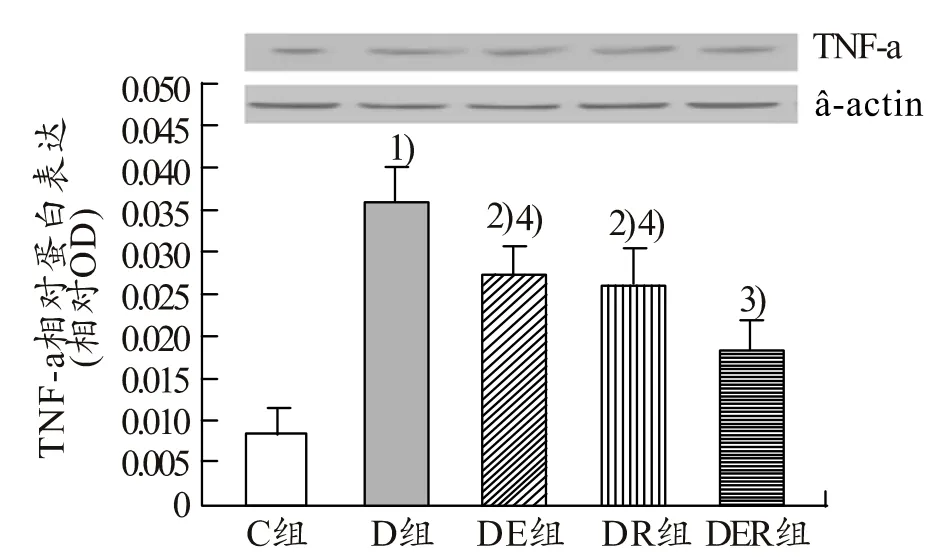
图3 不同组别大鼠肝脏中TNF-α的表达
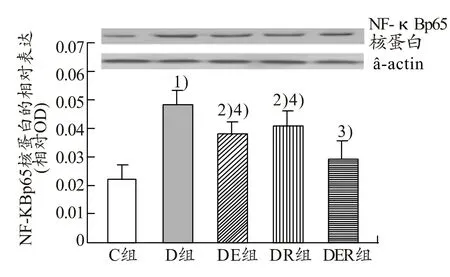
图4 不同组别大鼠肝脏中NF-κBp65核蛋白的表达
3 讨论
本实验结果显示,7周有氧运动或Res能显著降低T2DM大鼠血清FINS和HOMA-IR,与相关研究结果相一致[11],而运动和 Res联合干预与单一干预比较能进一步降低T2DM血清FINS和HOMA-IR,尽管无显著性差异(P>0.05)。
氧化应激是糖尿病及其并发症共同的发病机制。然而在T2DM中,肝脏由于代谢紊乱和肝脏IR,成为遭受应激的最主要器官。氧化应激与IR之间存在紧密联系[12]。TNF-a也能直接或间接介导IR状态[13]。因此,本研究就 T2DM肝脏氧化应激和炎症之间的分子联系,探讨有氧运动和Res对T2DM大鼠肝脏氧化应激和炎症影响及可能的作用机制。
3.1 有氧运动和Res对T2DM大鼠肝脏氧化应激的影响
肝脏中脂质过氧化物反映脂质过氧化程度,可以MDA质量摩尔浓度变化来表示。研究表明,经高脂饮食后,大鼠肝脏氧化应激增加,所引起的氧化损伤是IR和代谢综合症的发病原因[14]。氧化应激过程中产生的活性氧(ROS)可通过激活各种应激敏感性细胞内信号通路,包括NF-κB、p38MAPK、JNK/SAPK、PKC和多元醇通路间接损伤细胞。文献表明,在实验性糖尿病大鼠肝脏中脂质过氧化产物水平升高[15]。我们的研究结果显示,T2DM大鼠肝脏中MDA质量摩尔浓度显著升高,而SOD活性显著下降,表明T2DM大鼠肝脏氧化应激加强。经过 7周有氧运动后,T2DM大鼠MDA质量摩尔浓度显著下降,而SOD活性显著升高,与相关研究结果相一致[16]。Res能改善T2DM大鼠的氧化应激[7],我们的研究结果进一步表明,7周Res干预能显著改善T2DM大鼠肝脏的氧化应激,此外,经7周有氧运动联合Res较单一干预,其肝脏中MDA水平进一步下降(P<0.01,P<0.05),且 SOD活性呈升高趋势,表明肝脏氧化应激得到更好的改善。
脂质的过度堆积导致线粒体中脂肪酸β氧化不充分,ROS生成增多,脂质过氧化物产生增多,导致氧化应激。SREBPs是膜结合转录因子,控制胆固醇和脂肪酸代谢相关酶基因的表达,调节脂肪生成、胰岛素敏感性和脂肪酸稳态。SREBP家族包括SREBP1(SREBP1a、SERBP1c)和 SREBP2。前者在代谢活性较强器官中高表达,如肝脏、脂肪组织和骨骼肌,调节脂质代谢及胰岛素[4],后者参与合成TC ,同时可调节血脂,影响动脉粥样硬化血管[17]。
目前关于运动对DM大鼠肝脏SERBP的影响仅徐国琴[18]有相关研究,该项研究表明,运动训练能降低DM大鼠肝脏中SREBP表达。至于SREBP哪一种亚型起作用或是否两者共同作用尚不清楚。本实验在此基础上进一步研究,结果显示,有氧运动干预后T2DM大鼠肝指数、肝脏TG、TC均显著下降(P<0.05),控制脂质生成的转录因子 nSREBP1水平显著下降,而nSREBP2呈下降趋势,提示有氧运动能显著降低肝脏的脂质沉积,其机制可能通过作用于 nSREBP1。Res作为 SIRT1的一种强激活剂,可增加 SIRT1、AMPK的活性[19],抑制SREBP1及PGC-1a活性,抑制慢性酒精性脂肪肝脂肪变性[20]。Res也能通过抑制脂肪变性细胞 SREBP1的表达及活性改善脂肪变性[21]。我们的研究结果显示,Res可通过抑制 T2DM大鼠肝脏中SREBP1激活减少肝脏的脂质沉积,而有氧运动和白藜芦醇联合干预较单一干预进一步降低肝脏中 TG、TC,可能部分通过降低T2DM大鼠肝脏SREBP1活性(减少nSREBP1),改善肝脏脂质沉积引起的氧化应激。其原因可能与联合干预能更好改善肝脏的内质网应激有关。本实验中,经干预后,T2DM大鼠肝脏中作为调控TC的调节因子SREBP2活性未出现显著变化,而TC呈现显著降低,其具体原因有待进一步研究。
3.2 有氧运动和Res对肝脏炎症状态的影响
研究发现,有氧运动可降低高脂饮食介导的 IR大鼠、NAFLD大鼠、T2DM大鼠[22]肝脏中TNF-a的表达,改善肝脏炎症状态。我们的研究结果显示,7周游泳训练后,T2DM大鼠肝脏中TNF-a水平显著降低,与前人研究结果相一致。在炎性相关性疾病的机制研究中,研究学者目前已发现多条炎症信号转导通路,包括SIRT1/PGC-1a通路、NF-κB通路、AMPK通路、PI3K/PKB/eNOS通路等,其中NF-κB通路为细胞内极为重要的炎症信号转导通路。Arkan MC等[5]研究发现,大鼠选择性敲除肝脏NF-κB能抑制脂质介导的IR,提示NF-κB在其中起重要作用,可能作为防治IR相关疾病的靶标。NF-κB是由多肽链p50和p65 2亚基形成的二聚物。包括p50同源二聚物、p65同源二聚物、p50和p65异源二聚物,细胞内主要发挥作用的是其异源二聚体形式。未受应激情况下,NF-κB以无活性的化合物形式存在于胞浆中,一旦受到TNF-a、白细胞介素-6(IL-6)等炎症因子刺激,NF-κ B便被激活转位至细胞核内,促使机体分泌更多炎症因子,加剧炎症反应[23]。研究已发现DM肝脏中NF-κB被激活[24]。本实验中结果显示,T2DM 肝脏 NF-κBp65核蛋白显著增加,此外我们的实验还发现,经过7周运动后,不仅T2DM大鼠肝脏中TNF-a水平降低,而且NF-κBp65核蛋白减少,表明7周有氧运动可能通过抑制NF-κBp65活性,降低TNF-a改善肝脏炎症。
细胞水平研究表明,Res能抑制TNF-a介导的NF-κB激活[8]。动物实验研究表明,Res能显著降低高脂饮食肾脏[25]和T2DM大鼠胰腺[26]中NF-κBp65的表达及活性。然而对T2DM肝脏的研究尚未见到。我们的研究结果显示,Res能显著降低T2DM大鼠肝脏中的NF-κBp65的激活,同时下游TNF-a的水平也显著降低。表明,在体条件下,Res可通过抑制NF-κBp65的活性,降低TNF-a的水平,改善肝脏炎症反应。而7周有氧运动和Res联合干预后,T2DM大鼠肝脏中细胞核NF-κBp65水平较单一干预进一步降低,同时 TNF-a出现同样的变化趋势,表明联合干预较单一干预对T2DM大鼠肝脏炎症效果更为显著,其机制可能是通过抑制NF-κBp65,最终抑制TNF-a的表达而实现。
事实上,ROS介导的氧化应激是NF-κB的激活子,在经外源性 H2O2处理的细胞研究、促使内源性H2O2升高的动物研究中均得到证实。Lee YC等[27]研究也发现,使用抗氧化剂L-2-氧硫杂唑烷-4-羧酸(半胱氨酸前提物质)能引起NF-κB转位至细胞核总量及下游的调节因子如黏附分子、趋化因子和细胞因子表达显著降低,提示抗氧化剂在控制NF-κB转位和转录中均发挥重要作用。目前研究已发现,ROS能激活细胞内多条信号通路如NIK[28]、MAPKs[29]、PI3K/AKT[30]、TGF-β1激活 NF-κB,经磷酸化修饰作用增加下游TNF-a的表达。
TNF-a是一种内源性炎症介导子,参与免疫反应,在炎症反应中发挥重要作用。TNF-a主要通过与细胞表面受体肿瘤坏死因子受体 1(TNFR-1)结合发挥作用。经TNF-a结合的受体复合物可进一步募集肿瘤坏死因子相关死亡结构域(TRADD)、TRAF-2和RIP-1,激活MAPK、IκB激酶(IKK)和NADPH氧化酶等信号激酶[31]。其中IKK-NF-κB为细胞内经典的炎症信号通路,当细胞内TNF-a表达升高,可使IκBa Ser32和Ser36发生磷酸化降解,促使NF-κBp65被释放,转位至细胞核经修饰后与不同靶基因结合,增加相应炎症基因的表达。近年来研究已发现,NF-κB/RelA存在的可被磷酸化位点包括PKAc和MSK-1磷酸化Ser276,蛋白激酶 c磷酸化 Ser311,IKKβ磷酸化 Ser536。而Mohammad Jamaluddin等最新研究显示,阻断ROS信号通路可抑制 TNF-α介导的 NF-κ B/RelA Ser276磷酸化,而向细胞核转位的NF-κ B的含量保持不变,此外依赖于ROS且磷酸化RelA Ser276的激酶PKAc的活性显著降低,提示ROS信号通路并不影响IKK-NF-κ B转位过程,但对于 PKAc激酶磷酸化 NF-κ B/RelASer276过程中却起着必要的作用[32]。
由此可见,氧化应激通路和炎症通路彼此之间存在相互作用,结合本研究结果可以得知,有氧运动和Res能改善T2DM大鼠肝脏的氧化应激和炎症反应,可能通过减少因nSREBPs引起的脂质沉积,降低肝脏氧化应激,抑制NF-κBp65活性和转录,减少TNF-a水平最终改善肝脏炎症状态,其中两者联合较单一干预效果更为显著。此外,NF-κBp65通路上游存在非常重要的调节因子SIRT1,SIRT1是一种NAD+依赖的组蛋白脱乙酰化酶,在限热和Res条件下能显著被激活,对机体发挥多种有利效应[19]。细胞水平相关研究表明,Res能通过降低3T3-L1脂肪细胞中NF-κB的活性抑制TNF-a诱导的MCP-1启动子的活性[33]。肝脏特异性的敲除SIRT1基因能导致高脂饮食大鼠脂肪酸代谢紊乱,引起肝脏脂肪变性和炎症[34],由此推测,作为细胞内一重要的能量平衡调节因子 SIRT1,可能参与7周有氧运动和Res干预后T2DM大鼠肝脏氧化应激和炎症改善过程,调节NF-κBp65介导的TNF-a,对此还有待我们进一步研究。
[1] Teixeira-Lemos E,Nunes S,Teixeira F,et al. Regular physical exercise training assists in preventing type 2 diabetes development:focus on its antioxidant and anti-inflammatory properties[J]. Cardiovasc Diabetol,2011,10:12.
[2] Yki-Järvinen H. Liver fat in the pathogenesis of insulin resistance and type 2 diabetes[J]. Dig Dis,2010,28(1):203-209.
[3] Sohet F M,Neyrinck A M,Pachikian B D,et al.Coenzyme Q10 supplementation lowers hepatic oxidative stress and inflammation associated with diet-induced obesity in mice[J]. Biochem Pharmacol,2009,78(11):1391-1400.
[4] Sewter C,Berger D,Considine R V,et al. Human obesity and type 2 diabetes are associated with alterations in SREBP1 isoform expression that are reproduced ex vivo by tumor necrosis factor-a[J]. Diabetes,2002,51(4):1035-1041.
[5] Arkan M C,Hevener A L,Greten F R,et al. IKK-beta links inflammation to obesity-induced insulin resistance[J]. Nat Med,2005,11(2):191-198.
[6] Teixeira de Lemos E,Pinto R,Oliveira J,et al.Differential effects of acute (Extenuating) and chronic(Training) exercise on inflammation and oxidative stress status in an animal model of type 2 diabetes mellitus[J]. Mediators Inflamm,2011;2011:253061.
[7] Yun J M,Chien A,Jialal I,et al. Resveratrol up-regulates SIRT1 and inhibits cellular oxidative stress in the diabetic milieu:mechanistic insights[J]. J Nutr Biochem,2012,7(23):699-705.
[8] Csiszar A,Smith K,Labinskyy N,et al.Resveratrol attenuates TNF-alpha-induced activation of coronary arterial endothelial cells:role of NF-κappaB inhibition[J].Am J Physiol Heart Circ Physiol,2006,291(4):H1694-1699.
[9] Sun C,Zhang F,Ge X,et al.SIRT1 improves insulin sensitivity under insulin-resistant conditions by repressing PTP1B[J]. Cell Metab,2007,6(4):307-319.
[10] 李树基. BK通路在氧葡萄糖剥夺诱导海马神经元死亡中的作用[D].广州:南方医科大学,2009.
[11] Pold R,Jensen L S,Jessen N,et al. Long-term AICAR administration and exercise prevents diabetes in ZDF rats[J]. Diabetes,2005,54(4):928-934.
[12] Mahmoud A M,Ashour M B,Abdel-Moneim A,et al.Hesperidin and naringin attenuate hyperglycemia-mediated oxidative stress and proinflammatory cytokine production in high fat fed/streptozotocin-induced type 2 diabetic rats[J]. J Diabetes Complications,2012,26(6):483-90.
[13] Ryden M,Dicker A,van Harmelen V,et al.Mapping of early signaling events in tumor necros is factor-alpha-mediated lipolysis in human fat cells[J]. J Biol Chem,2002,277(2):1085 -1091.
[14] Matsuzawa-Nagata N,Takamura T,Ando H,et al.Increased oxidative stress precedes the onset of high-fat diet-induced insulin resistance and obesity[J]. Metabolism,2008,57(8):1071-7.
[15] Youssef W,McCullough A J. Diabetes mellitus,obesity,and hepatic steatosis[J]. Semin Gastrointest Dis,2002,13(1):17-30.
[16] 林文弢,陈景岗. 有氧运动及芦荟对糖尿病大鼠肝脏抗氧化酶活性的影响[J]. 广州体育学院学报,2005,25(6):49-51.
[17] Yamabe N,Kim H Y,Kang K S,et al. Effect of Chinese prescription Kangen-karyu on lipid metabolism in type 2 diabetic db/db mice[J]. J Ethnopharmacol,2010,129(3):299-305.
[18] 徐国琴. 不同强度运动对糖尿病大鼠内质网应激的影响及其作用机制研究[D]. 北京:北京体育大学,2008.
[19] Hu Y,Liu J,Wang J,et al. The controversial links among calorie restriction,SIRT1,and resveratrol[J]. Free Radical Biology & Medicine,2011,51(2):250-256.[20] Ajmo J M,Liang X,Rogers C Q,et al. Resveratrol alleviates alcoholic fatty liver in mice[J]. Am J Physiol Gastrointest Liver Physiol,2008,295(4):G833-842.
[21] Wang G L,Fu Y C,Xu W C,et al. Resveratrol inhibits the expression of SREBP1 in cell model of steatosis via Sirt1-FOXO1 signaling pathway[J]. Biochem Biophys Res Commun,2009,380(3):644-649.
[22] 林文弢,李品芳,翁锡全. 不同强度有氧运动对糖尿病大鼠肝脏炎症状态的影响[J]. 体育学刊,2011,18(3):136-139.
[23] Shoelson1 S E,Lee J,Yuan M. Inflammation and the IKKβ/IκB/NF-κB axis in obesity-and diet-induced insulin resistance[J]. Int J Obes Relat Metab Disord,2003,27(3):S49-52.
[24] Bi Y,Sun W P,Chen X,et al. Effect of early insulin therapy on nuclear factor kappaB and cytokine gene expressions in the liver and skeletal muscle of high-fat diet,streptozotocin-treated diabetic rats[J]. Acta Diabetol,2008,45(3):167-178.
[25] 丁洪成,夏文芳,陈璐. 白藜芦醇对高脂喂养大鼠肾脏的保护作用[J]. 中国现代医学杂志,2009,19(16):2429-2432.
[26] 赵赛. 白藜芦醇对2型糖尿病大鼠胰岛细胞保护作用及其机制的研究[D]. 石家庄:河北医科大学,2011.
[27] Lee Y C,Lee K S,Park S J,et al. Blockade of airway hyperresponsiveness and inflammation in a murine model of asthma by a prodrug of cysteine,L-2-oxothiazolidine-4-carboxylic acid[J]. FASEB J,2004,18(15):1917-9.
[28] Lee I T,Yang C M. Role of NADPH oxidase/ROS in pro-inflammatory mediators-induced airway and pulmonary diseases[J]. Biochem Pharmacol,2012,84(5):581-590.
[29] Liu C M,Sun Y Z,Sun J M,et al. Protective role of quercetin against lead-induced inflamma-tory response in rat kidney through the ROS-mediated MAPKs and NF-κB pathway[J]. Biochimic Biophys Acta,2012,1820(10):1693-1703.
[30] Li Q,Engelhardt J F. Interleukin-1 beta induction of NF kappa B is partially regulated by H2O2-mediated activation of NF kappa b-inducing kinase[J]. J Biol Chem,2006,281(3):1495-1505.
[31] Hsu H,Shu H B,Pan M G,et al. TRADD–TRAF2 and TRADD–FADD interactions define two distinct TNF receptor 1 signal transduction pathways[J]. Cell,1996,84(2):299-308.
[32] Jamaluddin M,Wang S,Boldogh I,et al.TNF-α-induced NF-κB/RelASer(276) phosphorylation and enhanceosome formation is mediated by an ROS-dependent PKAc pathway[J]. Cellular Signalling,2007,19(7):1419-1433.
[33] Csiszar A,Smith K,Labinskyy N,et al. Resveratrol attenuates TNF-alpha-induced activation of coronary arterial endothelial cells:role of NF-κappaB inhibition[J].Am J Physiol Heart Circ Physiol,2006,291(4):H1694-1699.
[34] Purushotham A,Schug T T,Xu Q,et al. Hepatocyte-Specific Deletion of SIRT1 Alters Fatty Acid Metabolism and Results in Hepatic Steatosis and Inflammation[J]. Cell Metab,2009,9(4):327-338.

