改性ZSM-5催化剂的制备及其在甲醇氢氯化合成氯甲烷中的应用
张文娇,余海鹏,张兆翔,郝 丛,刘玉敏,胡永琪
(河北科技大学化学与制药工程学院,河北 石家庄 050018)
氯甲烷作为一种有机合成中间体,主要用于合成树脂、橡胶、助剂和农药等[1,2]。由于原料来源及运输比较方便,以甲醇为原料的甲醇氢氯化合成氯甲烷的方法成为生产氯甲烷的主要工业生产方法。目前,甲醇氢氯化法合成氯甲烷有3 种技术路线:气液相非催化法、气液相催化法和气固相催化法[3]。气液相非催化法是早期的工业生产方法,由于在非催化条件下氯化氢和甲醇的反应速率较低,需要较大的反应设备[4,5],同时该方法对设备材质的要求较高,在工业上未能推广;气液相催化法由于采用了氯化锌作为催化剂,加快了反应速率,成为目前常用的方法,但存在副产物二甲醚比气液相非催化法高[6-8],对反应器耐腐蚀要求较高等缺点;气-固相催化反应法是在超过300 ℃条件下,气态的甲醇与氯化氢在固体催化剂的作用下发生反应,可有效利用反应热,易于连续化操作,因此可用于大规模生产,且具有甲醇单耗接近理论值,氯甲烷选择性高,反应过程腐蚀性低,反应器材质易解决等优点,引起了人们关注,正在推广实施。气-固相法生产氯甲烷工艺的核心是催化剂,国外推广的气固相氯甲烷合成催化剂为含有99%氧化铝的圆球型颗粒,但由于价格太高,难以在国内推广使用。为此,国内研究者开展了相关的研究和开发工作。宋立新等[9,10]采用ZnCl2/γ-Al2O3作催化剂,对气固相催化法催化剂进行了研究,发现该种催化剂易积炭,寿命较短。积炭是气-固相法生产氯甲烷工艺中降低选择性的重要原因,而ZSM-5 分子筛具有较小的内孔,不利于积炭生成的前驱物聚合反应所需要的大分子过渡状态,因此可有效地阻止反应过程中形成大分子物质而在孔内积炭,但是由于ZSM-5 催化剂的强酸性,积炭会沉积于ZSM-5 催化剂外表面上而堵塞孔道,而且甲醇和氯化氢反应发生在催化剂弱酸中心上,过多的强酸中心会抑制氯甲烷生成,因此SiO2改性ZSM-5 催化剂表面强酸中心,一方面可减少积炭,延长催化剂寿命,另一方面为生成氯甲烷提供适合的酸性中心。本工作筛选合适硅铝比的ZSM-5,通过SiO2改性来改变催化剂表面的酸性,以符合甲醇氢氯化反应特点,考察反应温度、氯化氢与甲醇比和停留时间对催化剂反应性能的影响,并对催化剂的寿命、失活原因和再生方法进行了研究。
1 实验部分
1.1 催化剂制备
采用等体积浸渍法对ZSM-5 催化剂进行改性。将硅溶胶(AR,天津市化学试剂三厂)溶于去离子水中配成溶液,将ZSM-5(50)(AR,南开大学催化剂厂)放入上述溶液中充分搅拌,并浸渍24 h,再于120 ℃下干燥4 h,于550 ℃下焙烧7 h,即得所需催化剂i%SiO2/ZSM-5(50)(i为SiO2的用量,按质量分数记)。
1.2 催化剂表征
样品X 射线衍射(XRD)分析采用日本Rigaku D/max-2500 型X 射线衍射仪,扫描速率为0.06 (°)/s;样品N2吸附测试在美国Quantachrome 公司的NOVA2000 型比表面分析仪上完成,样品在250 ℃下抽真空活化,N2为吸附质,于液氮温度下测得;样品程序升温脱附(NH3-TPD)实验在天津先权公司TP5000 上完成,称取150 mg ZSM-5 颗粒(粒径250~380 μm),在400 ℃通氮气吹扫样品表面物质,冷却至室温,通入NH3吸附至平衡,然后升温至120 ℃以脱除物理吸附的NH3,最后以10 ℃/min的速率升温脱附。
1.3 催化剂评价
甲醇与氯化氢催化合成氯甲烷在Φ17 mm×60 mm 的玻璃管固定床反应器中进行,管式电阻炉加热。催化剂床层温度用热电偶测量。甲醇通过蠕动泵进入预热器,经汽化后进入反应器。氯化氢进料采用医用注射泵将盐酸经浓硫酸挥发出氯化氢气体进入反应器。产物经冷凝干燥后,采用上海天美公司的GC7890Ⅱ型气相色谱仪进行定量分析,6201 红色担体涂邻苯二甲酸二丁醋和聚乙二醇2000 固定液作载体的填充柱,TCD 检测器。
失活催化剂采用空气氧化法再生,将催化剂逐步升温至550 ℃,保持3 h。
2 结果与讨论
2.1 催化剂筛选
甲醇氢氯化法生成氯甲烷反应需在酸性催化剂条件下进行,ZSM-5 的硅铝比不同,催化剂酸性不同,本工作选择不同硅铝比的ZSM-5(25),ZSM-5(38),ZSM-5(50)和ZSM-5(80)(AR,南开大学催化剂厂),考察其对甲醇与氯化氢催化合成氯甲烷的反应性能,其结果见图1和图2。
由图1可知:随着硅铝比的增加氯甲烷的收率先增加后减小,当ZSM-5 的硅铝比为50 时,氯甲烷的收率最大,可达到78%;选择性随着硅铝比的增加先增加后保持稳定。由图2可知:随着硅铝比的增加,强酸中心和弱酸中心均减少,而弱酸中心有利于氯甲烷的生成,强酸中心由于促进积炭和二甲醚的生成而抑制氯甲烷的生成;当硅铝比较小时,过多的强酸中心会生成大量的二甲醚且容易造成催化剂积炭,从而降低目的产物的选择性和收率;若硅铝比过大,无足够的弱酸中心进行生成目的产物氯甲烷的反应,从而降低氯甲烷的收率,但强酸中心减少,所以选择性变化不大。因此,当ZSM-5硅铝比为50 时,催化剂活性较好。
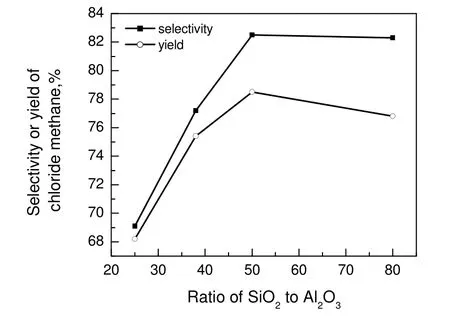
图1 硅铝比对选择性和氯甲烷收率的影响Fig.1 Effect of different ratio of SiO2 to Al2O3 on selectivity and yield of chloride methane
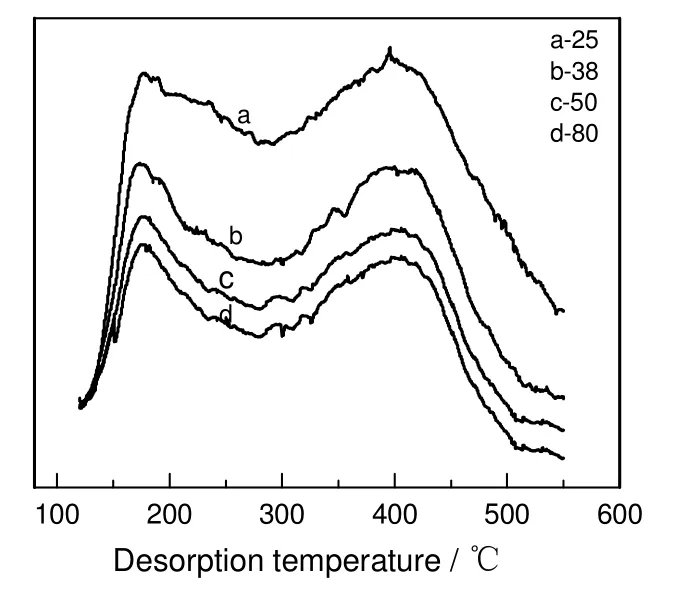
图2 不同硅铝比ZSM-5 催化剂的NH3-TPD 图谱Fig.2 NH3-TPD curves of ZSM-5 with different ratio of SiO2 to Al2O3
采用改性剂SiO2对ZSM-5(50)进行改进,得到一系列改性催化剂,其XRD 分析结果见图3。由图3可知,所有样品都显示出ZSM-5(50)的特征衍射峰,并且强度基本一致。这表明SiO2改性后,ZSM-5(50)催化剂的骨架结构能够得到良好的保持。
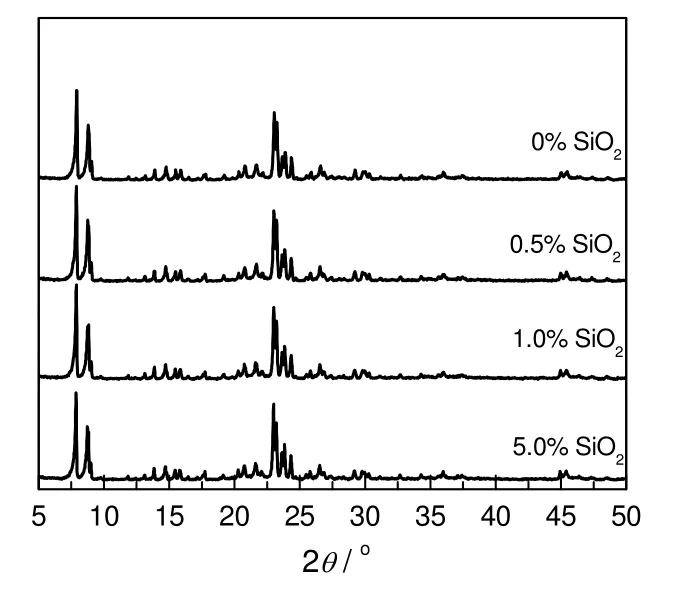
图3 SiO2 改性的ZSM-5(50)催化剂的XRD 图谱Fig.3 XRD spectra of ZSM-5(50) modified by SiO2

表1 SiO2 改性ZSM-5(50)系列催化剂结构性质Table 1 Textural proterties of ZSM-5(50) catalysts modified by SiO2
表1为经SiO2改性的ZSM-5(50)催化剂结构性质。由表可知,SiO2改性后,样品的比表面积略有下降,这是由于SiO2改性后,钝化了催化剂表面酸性,而催化剂的微孔基本没变化,是因为硅溶胶的分子直径大于ZSM-5 孔道直径,无法进入孔道内,因此,微孔孔道不会被引入的硅物种堵塞,改性后的催化剂显示出了良好的孔道开放性。

图4 SiO2 用量对氯甲烷收率和选择性的影响Fig.4 Effect of SiO2 dosage on yield and selectivity of chloride methane
图4为SiO2用量对氯甲烷收率和选择性的影响。由图可知,氯甲烷收率随着SiO2用量的改变而改变,其质量分数为1.0%时,氯甲烷收率达到最大,当用量继续增大,氯甲烷收率降低,选择性随着SiO2用量的增加先增加,随后变化不大。
图5为用不同量的SiO2改性后的ZSM-5(50)的NH3-TPD 谱图。由图可知,SiO2使ZSM-5 催化剂的弱酸中心和强酸中心均发生变化,随着SiO2用量的增加,强酸中心越来越少,从而减少了副反应二甲醚的生成和催化剂表面积炭的生成,因此选择性随SiO2用量的增加先增加后变化不大;当SiO2用量为0.5%和1.0%时,ZSM-5 催化剂弱酸中心数目显著增多。但SiO2用量为1.0%时,其强酸中心明显小于SiO2用量为0.5%时,因此,当SiO2用量为1.0%时,由于催化剂强酸中心的减少和弱酸中心的增多,使得氯甲烷收率和选择性达到较高值。后续研究所用催化剂均是用量为1.0% SiO2/ZSM-5(50)。
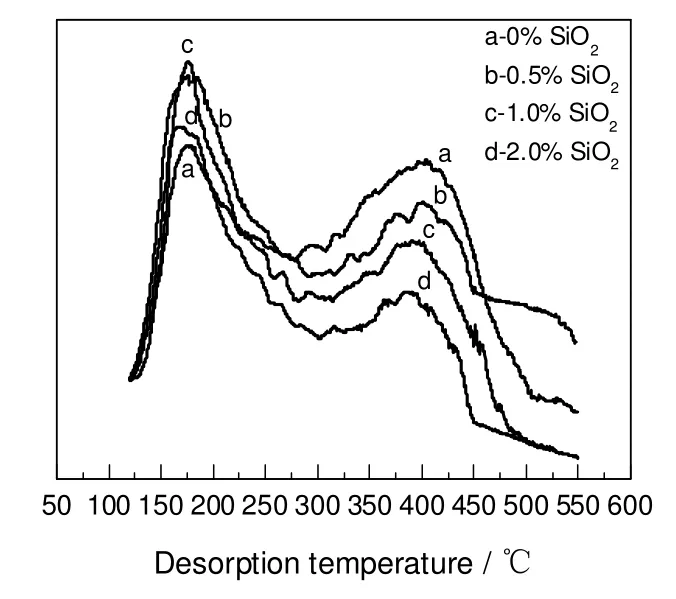
图5 不同用量SiO2 改性的ZSM-5(50)的NH3-TPD 图谱Fig.5 NH3-TPD curves of ZSM-5(50) modified by SiO2 with different dosage
2.2 反应条件优化
2.2.1 反应温度的影响
图6为反应温度对催化剂性能的影响。由图可知,随着反应温度的升高,氯甲烷收率逐渐增加,当反应温度为230 ℃时,氯甲烷收率达到最大(95%),选择性变化不大。这是由于甲醇与氯化氢催化合成氯甲烷是吸热反应,所以高温有利于反应正向进行,使得氯甲烷收率有所升高,但由于温度相对较低,抑制了副反应的生成,因此选择性变化不大;继续升温,氯甲烷收率开始降低,这是由于温度过高引起副产物二甲醚的生成以及催化剂上积炭的增加,导致催化剂性能下降。因此反应温度为230 ℃较合适。

图6 温度对1.0%SiO2/ZSM-5(50)性能的影响Fig.6 Effect of temperature on performance of 1.0%SiO2/ZSM-5(50)
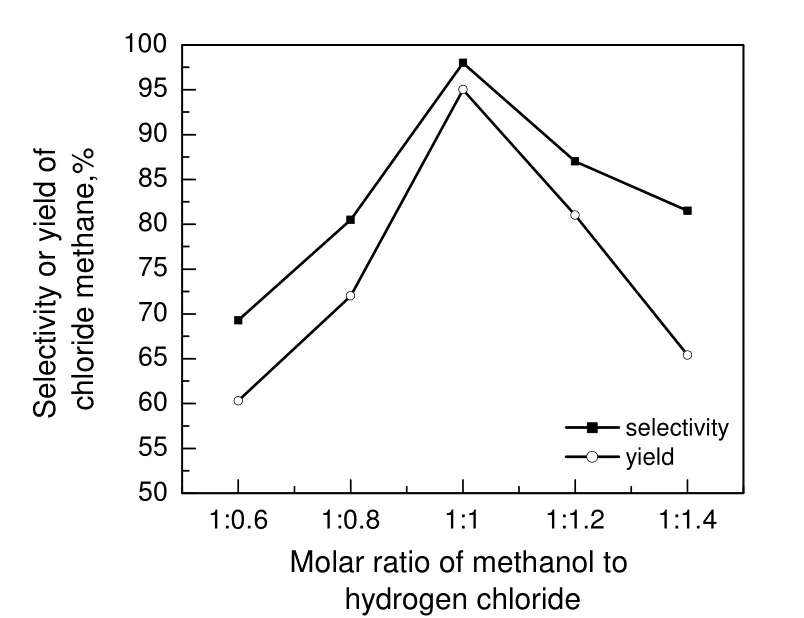
图7 甲醇与氯化氢比对1.0%SiO2/ZSM-5(50)性能的影响Fig.7 Effect of molar ratio of methanol to hydrogen chloride on performance of 1.0%SiO2/ZSM-5(50)
2.2.2 甲醇与氯化氢配比的影响
图7为甲醇与氯化氢物质的量之比对1.0%SiO2/ZSM-5(50)催化剂性能的影响。由图可知,随着甲醇与氯化氢物质的量之比的增加,氯甲烷的选择性和收率均先增大后减小,当甲醇与氯化氢物质的量之比为1∶1 时,达到最大值。这是由于当甲醇过量时会导致副产物二甲醚的生成,二甲醚会抑制氯甲烷的生成,氯甲烷收率降低,选择性降低;当甲醇量减少,氯化氢过量时,酸性环境易加速分子筛催化剂表面积炭生成,因此氯甲烷的收率降低,选择性降低。可见,甲醇与氯化氢的比为1∶1 时较合适。
2.2.3 空速的影响
图8为空速对1.0%SiO2/ZSM-5(50)催化剂性能的影响。由图可知:随着空速的增大,氯甲烷的收率增大,选择性也增大;当空速为724.4 h-1时氯甲烷收率和选择性达最大;当空速再增大时,氯甲烷收率则开始降低,选择性缓慢降低。这是由于空速较小时,停留时间过长,导致副反应增加,从而影响主产物的生成,氯甲烷收率低,选择性低;当空速过大时,停留时间过短,反应不充分,导致收率低。因此,空速为724.4 h-1较合适。

图8 空速对1.0%SiO2/ZSM-5(50)性能的影响Fig.8 Effect of space velocity on performance of 1.0%SiO2/ZSM-5(50)
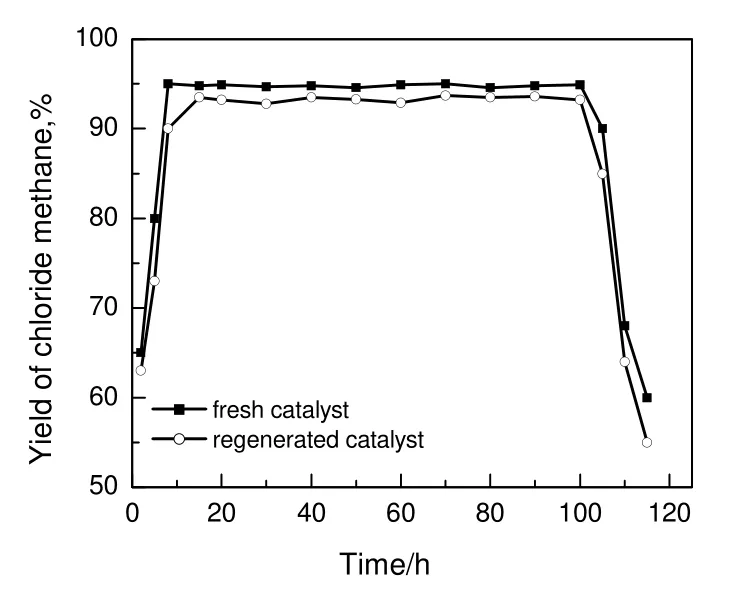
图9 新鲜和再生催化剂的稳定性Fig.9 Stability of the fresh and regenerated catalysts
2.3 催化剂稳定性和再生
在常压,温度为230 ℃,甲醇与氯化氢物质的量之比为1∶1,空速为724.7 h-1的条件下,考察了催化剂稳定性,结果见图9。由图可见:随着反应时间的延长,氯甲烷的收率逐渐增加,至8 h 时达到95%,之后的92 h 催化剂性能基本保持稳定;随着反应的继续进行,催化剂活性开始下降,至115 h时,氯甲烷收率降至60%。为了研究催化剂失活的原因,对催化剂进行了对比分析,结果见表2。由表可知,随着反应时间的延长,催化剂比表面积下降(反应115 h 后,催化剂比表面积由新鲜催化剂的283.9 m2/g 降至150 m2/g)。这表明反应过程中催化剂可能产生了积炭,导致催化剂活性降低。
采用空气氧化法对催化剂进行再生,并考察了再生后催化剂性能的稳定性,结果见图9。由图可知,再生催化剂与新鲜催化剂相比,再生催化剂上氯甲烷收率略有降低,稳定性接近。

表2 催化剂比表面积Table 2 The specific surface area of catalyst
3 结 论
a)SiO2改性ZSM-5(50)催化剂可以明显减少其强酸性中心数量,改善其表面酸性环境,提高甲醇氢氯化合成氯甲烷过程中氯甲烷的选择性和收率。
b)当SiO2用量为1.0%时,催化剂活性和反应选择性较高,氯甲烷收率最高可达95%。
c)催化剂使用一段时间后,经氧化再生,催化活性和反应选择性仍有所下降,因此进一步开展催化剂失活机理研究,延长催化剂寿命是下一步研究重点。
[1]杨聚法, 解自杰, 陈国峰.氯甲烷的合成与应用[J].中国氯碱, 1996, 12:39-40.Yang Jufa, Jie Zijie, Chen Guofeng.The synthesis and application of chloride methane[J].China Chlor-Alkali, 1996, 12:39-40.
[2]洪 钟.一氯甲烷生产工艺的选择及应用[J].化学工程, 2011, 10(39):100-102.Hong Zhong.Analysis on selection and application of methylchloride production processes[J].Chemical Engineering, 2011, 10(39):100-102.
[3]宋立新.氯甲烷生产技术进展[J].有机硅材料, 2000, 14(3):7-10.Song Lixin.Production and technique progress of chloromethane[J].Silicone Material, 2000, 14(3):7-10.
[4]Mond L, Eschellmann G.Process of obtaining chlorine:US, 416038[P].1989-01-16.
[5]Habata K, Tanaka S, Araki H.Preparation of methyl chloride:US, 3983180[P].1975-5-15.
[6]Linke W, Trapp S, Omas L V, et al.Preparation of catalysts supported on activated carbon:US, 237058[P].1986-4-20.
[7]周积平, 李 山, 曾崇余, 等.用甲醇和氯化氢经气液相催化反应生成氯甲烷的反应动力学研究[J].南京工业大学学报(自然科学版), 1985, 2(5):113-119.Zhou Jiping, Li Shan, Zeng Chongyu, et al.A kinetic study on the formation of methyl chloride from methanol and hydrogen chloride by catalytic gas-liquid reaction[J].Journal of Nanjing University of Technology(Natural Science Edition), 1985, 2(5):113-119.
[8]周积平, 李 山, 曾崇余, 等.甲醇和氯化氢气—液催化反应生成氯甲烷反应动力学的研究[J].化学反应工程与工艺, 1986, 3(2):1-7.Zhou Jiping, Li Shan, Zeng Chongyu, et al.A kinetic study on the formation of methyl chloride from methanol and hydrogen chloride by catalytic gas-liquid reaction[J].Chemical Reaction Engineering and Technology,1986, 3(2):1-7.
[9]宋立新, 曹美华, 王莉洪.合成氯甲烷的负载型ZnCl2/γ-Al2O3催化剂的研制[J].化工科技, 2000, 8(4):25-30.Song Lixin, Cao Meihua, Wang Lihong.Preparation and investigation of supported ZnCl2/γ-Al2O3catalyst for chloromethane synthesis[J].Science&Technologyin Chemical Industry, 2000, 8(4):25-30.
[10]唐雨东.气-固相法合成氯甲烷技术研究[D].北京:北京化工大学, 2000.

