外周血肿瘤坏死因子-α信使核糖核酸表达及与核因子-κB活化与慢性心力衰竭严重程度的临床研究
杨丽霞,吕晋琳,齐峰,叶金善,郭瑞威,石燕昆
慢性心力衰竭(CHF)时细胞因子网络失衡既是其结果,又成为维持与加重心衰和心肌重塑的原因。其中,肿瘤坏死因子-α(TNF-α)是参与心肌重塑、心衰进展最为密切的细胞因子之一,可作为判断心衰程度和预后的指标[1]。核因子-κ B(NF-κ B)为调节细胞基因转录的关键因子,近年研究表明除了心肌细胞、内皮细胞外,外周血单个核细胞中也存在NF-κ B激活通路[2]。本研究通过探讨CHF患者外周血单个核细胞中NF-κ B的活化程度及其与TNF-α基因表达的关系,旨在阐明NF-κ B活化、TNF-α表达在心肌重塑和CHF中的病理意义。
1 资料与方法
研究对象: 我院心内科2006-10至2007-08住我院的CHF患者76例为CHF组,其中男40例,女36例,平均年龄(56.8±8.7) 岁,心功能NYHA分级Ⅱ~ Ⅳ级,病因为扩张型心肌病和缺血性心肌病,左心射血分数<50 %。对照组为我院同期门诊健康体检者,共30例,男13 例,女17例,平均年龄(51.2±10.6) 岁, 所有受试者均除外感染、哮喘、风湿活动、肾衰竭和肿瘤等疾病。
超声心动图(UCG)检查,使用惠普5500型彩色多普勒超声心动图仪,探头频率2~4 MHz ,分别测定左心房内径(LAD),左心室舒张末内径(LVDd),左心室后壁厚度(LVPW)。采用Simpson法,描记舒张期和收缩期心内膜边缘,计算机自动描记室壁运动曲线,根据左心室舒张末容积(LVEDV)和左心室收缩末期容积(LVESV) ,计算左心室射血分数(LVEF)、左心室短轴缩短率(LVFS) 、心输出量(CO)和心指数(CI),并按Devereux公式计算左心室重量(LVMW)及左心室重量指数(LVMI),LVMW = 1.04[ ( IVST + LVDD +LVPW)3- LVDD3] -13.6 (g);LVMI = LVMW/体表面积 (g/m2)。
外周血单个核细胞的分离: 用灭菌的肝素抗凝管抽取外周血5 ml,采用密度梯度离心法分离外周血单个核细胞(PBMCs)。用含10%新生牛血清的RPMI1640培养基调整细胞数为2×106/ ml的细胞悬液[2]。
细胞核蛋白的提取:参照Biosource公司提供的细胞裂解液及核蛋白抽提液配方,离心收集外周血单个核细胞,将细胞悬浮于500μl细胞裂解液冰浴15 分钟,加入 25μl 10%NP-40 溶液,混匀后 3000 g 4℃离心10分钟,沉淀重悬于50μl核蛋白抽提液,冰浴30分钟,4℃高速离心30分钟,取上清分装并立即保存于-80℃冰箱待用。
NF-κB浓度检测: NF-κB试剂盒(cat KHO0371)购于Biosource公司(美国),按试剂盒说明书操作。用酶联免疫吸附法(ELISA)检测核蛋白提取物NF-κ B在波长450 nm处的吸光度值(OD值)。根据标准品浓度绘制标准曲线,再根据OD值在标准曲线上查出NF-κB浓度。
逆转录-多聚酶链反应(RT-PCR):用灭菌的肝素抗凝管抽取外周血5 ml,采用密度梯度离心法分离外周血单个核细胞。 用Trizol 法提取细胞总RNA。TNF-α 引物序列 :上游 5-CTT CTC CTT CCT GAT CGT GG-3 ,下游 5-GCT GGT TAT CTC TCA GCT CCA-3。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内对照,产物长度分别为226 bp和266 bp。TNF-α反应条件为 94℃ 变性 1 min ,60℃ 退火 2 min ,72 ℃延伸1 min ,循环35次。GAPDH退火温度为64℃,循环30 次,其余条件相同。PCR 产物于2 %琼脂糖凝胶电泳,溴化乙锭染色,紫外灯下观察拍照,应用图像分析系统对电泳带进行光密度值测定,以光密度比值作为TNF-αmRNA 相对定量表达水平。
2 结果
CHF组NF-κ B水平和TNF-αmRNA表达较对照组明显增高,差异均有统计学意义(P<0.01)。CHF组随着心功能恶化,NF-κB水平、TNF-αmRNA表达逐渐升高,CHF组与对照组相比差异均有统计学意义(P<0.01)。(表 1、图 1)
表1 两组外周血单个核细胞肿瘤坏死因子-α信使核糖核酸表达与核因子-κ B水平(±s)
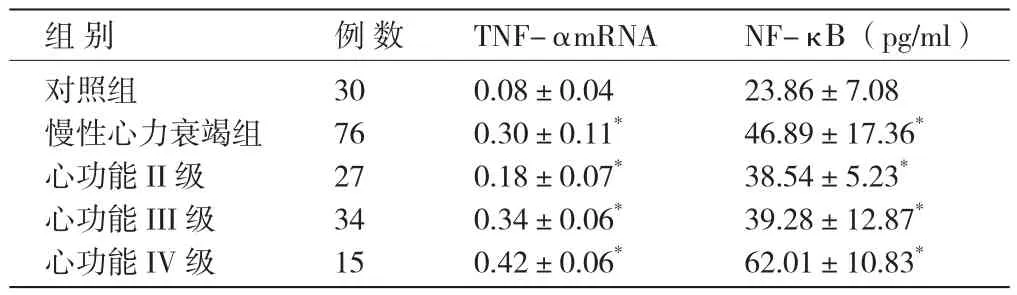
表1 两组外周血单个核细胞肿瘤坏死因子-α信使核糖核酸表达与核因子-κ B水平(±s)
注:与对照组相比 * P<0.01 。TNF-α mRNA:肿瘤坏死因子 -α 信使核糖核酸 NF-κ B:核因子 -κB
组 别 例 数 TNF-αmRNA NF-κ B(pg/ml)对照组 30 0.08±0.04 23.86±7.08慢性心力衰竭组 76 0.30±0.11* 46.89±17.36*心功能II级 27 0.18±0.07* 38.54±5.23*心功能III级 34 0.34±0.06* 39.28±12.87*心功能IV级 15 0.42±0.06* 62.01±10.83*
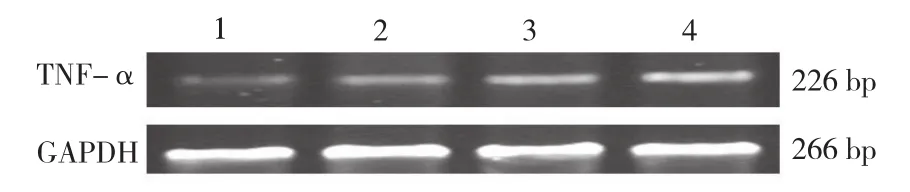
图1 逆转录-多聚酶链反应 分析电泳后外周血单个核细胞的肿瘤坏死因子-α和甘油醛-3-磷酸脱氢酶的信使核糖核酸表达 1:对照组 2:心功能Ⅱ级 3:心功能Ⅲ级 4:心功能Ⅳ级。TNF-α:肿瘤坏死因子 -α GAPDH:甘油醛 -3- 磷酸脱氢酶
CHF组 NF-κB水平与 TNF-α mRNA 表 达 呈正相关(r=0.658,P<0.01),建立回归方程为 y=0.139+0.004X。
CHF患者两指标与心功能的相关性分析: NF-κ B水平及TNF-α mRNA表达均与左心室射血分数、心输出量、心指数呈显著负相关,P<0.05有统计学意义,与左心室短轴缩短率负相关,但无统计学意义。(表2)
CHF患者两指标与心脏结构的相关性分析:NF-κ B水平与左心室舒张末期内径、左心室收缩末容积、左心室舒张末期容积、左心室重量指数呈显著正相关,P均 <0.05。差异均有统计学意义。TNF-α mRNA与左心室舒张末期内径、左心室重量指数呈显著正相关,有统计学意义(P<0.05~0.01)。(表 3)

表2 慢性心力衰竭患者外周血单个核细胞核因子-κ B水平和肿瘤坏死因子-α信使核糖核酸表达与心功能的相关性分析

表3 慢性心力衰竭患者外周血单个核细胞核因子-κ B和肿瘤坏死因子-α信使核糖核酸与心脏结构的相关性
3 讨论
20世纪后期,人们认识到CHF预后差,主要是由于神经体液因素和心肌重构造成的恶性循环不断进展的结果[3,4]。近年来在CHF的病理生理机制中引入了细胞因子网络失衡学说[5,6],认为细胞因子与神经内分泌激活使CHF恶化。基础研究已证实活化的NF-κ B核定位序列暴露并发生核移位,能与DNA上特异性κ B序列结合并启动靶基因的转录,其中包括对细胞的活化、增殖、分化和分泌起直接调控的细胞因子,例如TNF-α的转录[7]。除了心肌细胞及血管内皮细胞外,外周血单个核细胞中也存在着TNF-α的转录翻译以及NF-κ B的激活通路[8]。
本研究结果显示,CHF患者外周血单个核细胞NF-κ B水平和TNF-αmRNA表达显著高于对照组,且TNF-αmRNA表达与NF-κ B的水平呈显著正相关。TNF-αmRNA表达和NF-κ B浓度均与心功能指标及心肌重塑超声心动图指标相关。说明TNF-αmRNA表达的增加可能与NF-κ B活化有关,两者相互作用共同促进心肌重塑和心肌收缩力减弱,从而导致心功能恶化。其可能机制为CHF时机体处于高炎症反应状态,脂多糖(LPS) 与LPS结合蛋白(LBP) 结合,再与脂多糖在巨噬细胞表面的特异性结合受体CD14 相互作用,激活蛋白酪氨酸激酶(PTK) 通路:Ras →Raf →MEK→MAPK→NF-κ B,被活化的NF-κB进入细胞核内,激活TNF-α启动子使之转录[9]。CHF 时的血流动力学因素如心率、左房压、平均动脉压、肺动脉楔压、左室射血分数和生化因素如肾上腺素、NE、ET、AngⅡ 及心肌缺血、缺氧、室壁应力增大等都可刺激单核-巨噬细胞等合成和分泌TNF-α,在TNF-α表达增加的同时TNF-α受体结合NF-κB诱导激酶(NIK)途径进一步激活NF-κ B,如此循环作用导致TNF -α不断增加,抑制心肌收缩、诱发心肌细胞凋亡和基质纤维增生,加重心力衰竭[10,11]。
综上所述,NF-κ B细胞信号转导通路及TNF-α参与了慢性心力衰竭的发生、发展,并与心功能恶化及心肌重塑同步。如何阻断这一通路的激活将给CHF的治疗带来新的希望。基于对慢性心力衰竭发生机制的研究,除了临床上较常使用的增强心肌细胞收缩能力、减轻前后负荷等药物外[12],一些拮抗细胞因子作用的药物如p38 MAPK抑制剂以及针对NF-κ B信号转导通路的特异性阻断剂如吡咯烷二硫氨基甲酸酯(pyrrolidine dithiocar-bamates,PDTC)等的应用仍有待进一步研究[13]。
[1] Negrusz-Kawecka M. The role of TNF-alpha in the etiopathogenes -is of heart failure. Pol Merkur Lekarski,2002,12:69-72.
[2] 李玉宏.慢性心力衰竭患者外周单核细胞TNF-α mRNA转录和蛋白质表达的改变 .心肺血管病杂志, 2004, 23 : 24-25.
[3] 王娟.右心衰竭的病因和发病机制研究进展.中国循环杂志,2012,27: 75-76.
[4] 李小鹰.2010 年慢性心力衰竭治疗进展. 中国循环杂志 ,2011,26: 81-83.
[5] Jankowska EA, von Haehling S, Czarny A,et al. Activation of the NF-kappaB system in peripheral blood leukocytes from patients with chronic heart failure. Heart Fail, 2005,7:984-990.
[6] 杨丽霞,祝善俊,王先梅,等.心力衰竭患者细胞因子网络及内源性调控的变化 . 中华内科学杂志,2001 ,40 :660-662.
[7] Gupta S, Sen S. Role of the NF-kappaB signaling cascade and NF-kappaB-targeted genes in failing human hearts. Mol Med, 2005 ,83:993-1004.
[8] Siednienko J, Jankowska EA, Banasiak W, et al. Nuclear factor-kappaB activity in peripheral blood mononuclear cells in cachectic and non-cachectic patients with chronic heart failure. Cardiol. 2007,122:111-116.
[9] Shames BD, Selzman CH, Pulido EJ, et al. LPS-Induced NF-kappaB activation and TNF-alpha release in human monocytes are protein tyrosine kinase dependent and protein kinase C independent. Surg Res, 1999,83:69-74.
[10] Li H, Lin X . Positive and negative signaling components involved in TNFalpha-induced NF-kappaB activation. Cytokine, 2008,41:1-8.
[11] Sato H, Watanabe A, Tanaka T, et al. Regulation of the human tumor necrosis factor-alpha promoter by angiotensin II and lipopolysaccharide in cardiac fibroblasts: different cis-acting promoter sequences and transcriptional factors. Mol Cell Cardiol, 2003,35:1197-1205.
[12] Cakar M, Balta S, Demirkol S, et al. The Therapy of Acute decompensated heart failure should be performed like a work of art.Cardiology, 2013, 15;124:62.
[13] 杨成明,潘波,陈鹏,等.吡咯烷二硫代氨基甲酸盐对大鼠缺血性心肌损伤后心室扩张及心衰的研究. 岭南心血管病杂志,2011,SI:245-246.

