凝集素样氧化低密度脂蛋白受体-1甲基化在同型半胱氨酸作用下对人内皮细胞存活的影响*
马胜超, 孙炜炜, 巩慧慧, 马长剑, 王菊, 田珏, 姜怡邓
同型半胱氨酸(Hcy)浓度异常升高与动脉粥样硬化的发生发展密切相关,叶酸是Hcy代谢途径中的重要决定因子,可减少Hcy的生成,维生素B12作为辅助因子可促进叶酸的循环利用[1]。凝集素样氧化低密度脂蛋白受体-1(LOX-1)是氧化低密度脂蛋白的特异性受体,其主要功能是介导血管内皮细胞摄取氧化低密度脂蛋白,诱导黏附分子产生,导致血管内皮细胞损伤,从而加重动脉粥样硬化的发生发展[2]。但Hcy浓度异常升高引起动脉粥样硬化发病的主要分子机制尚不明确。本研究采用人脐静脉内皮细胞为实验对象,通过不同浓度的Hcy及拮抗剂叶酸和维生素B12干预后,分别对相关因子进行检测,探讨LOX-1甲基化在Hcy作用下对内皮细胞存活作用的分子机制。
1 材料与方法
主要实验试剂和仪器:本实验的起始时间为2010-11至2011-08。M199培养基(Gibco公司,美国),胎牛血清(四季清公司),胰蛋白酶,同型半胱氨酸(Sigma公司,德国),过氧化氢测试盒(南京建成公司),氧化低密度脂蛋白和脱氧核糖核酸(DNA)甲基转移酶-1酶免试剂盒(RD公司,美国),核糖核酸(RNA)提取试剂Trizol(上海英俊生物技术公司 ),逆转录试剂盒和荧光定量聚合酶链式反应(PCR)试剂盒(Fermentas公司,加拿大),引物由上海生工公司合成,兔抗人LOX-1抗体和辣根过氧化物酶标记的羊抗兔IgG(Santa Cruz Biotechnology.Inc公司,美国),DNA提取试剂盒(Promega公司,美国), 实时荧光定量基因扩增仪(FTC-3000,Funglyn Biotech公司,加拿大), 酶标仪和紫外凝胶成像系统 (BIO-RAD公司,美国)。新鲜脐带取自宁夏医科大学附属医院产科。
人脐静脉内皮细胞的体外培养、鉴定及分组:按徐支芳等[3]的方法体外培养和鉴定原代人脐静脉内皮细胞。将实验组分为:①不同浓度的Hcy对人脐静脉内皮细胞作用组:对照组 (0μMHcy)、50 μ M Hcy组、100μ M Hcy组、200 μ M Hcy组和 500 μ M Hcy组。②拮抗剂组 : 100 μ M Hcy+30 μ M 维生素B12+ 30 μ M叶酸组,各组n均=5。各实验组培养液孵育72 h,以备实验使用。
人脐静脉内皮细胞存活率实验:收集对数期的细胞,制成 5×104/mL 悬液, 按徐支芳等[3]的 3-( 4,5)-双甲基-2 -噻唑-(2, 5) -2苯基溴化四氮唑蓝试验方法检测。
试剂盒测人静脉内皮细胞内过氧化氢、氧化低密度脂蛋白和甲基转移酶-1(DNMT-1)含量:按说明书,采用分光光度计测定过氧化氢[4]含量;酶标仪检测氧化低密度脂蛋白[5]和DNMT-1[6]含量。
荧光定量PCR法测LOX-1和DNMT-1信使核糖核酸(mRNA)的表达: LOX-1引物:上游 : 5’-AATGATAG AAACCCTTGC-3’, 下游 :5’-TTCCCAGTTAAATGAGCC-3’;DNMT-1:上游 : 5’-GGAGCCCAGCAAG AGTA-3’,下游 : 5’-GGGAGACACCAGCCAAAT-3’;甘油醛-3-磷酸脱氢酶(GAPDH):上游 :5’-AGAAGGCTGGGGCTCATTTG-3’, 下游 :5’-AGGGGCCACAGTCTTC-3’。 PCR反应条件: 94℃预变性 3 min, 94℃变性 45 s, 46℃(LOX-1),51℃(DNMT-1)退火 45s, 72℃延长 45 s, 扩增 50(LOX-1)、65 (DNMT-1)个循环。实验结果根据孙艳侠等[7]的计算方法获得目的基因的相对表达量。
蛋白免疫印迹法检测LOX-1蛋白的表达:裂解细胞提取蛋白, BCA法[8]测蛋白浓度;取等量蛋白上样后电泳;转膜封闭后, LOX-1一抗(1:500)。辣根过氧化物酶(1:3000)作用1h后曝光。用Bio-Rad Quantity 4.5.2软件分析测定其区带的感光密度。
巢式降落式PCR法检测LOX-1甲基化:亚硫酸盐修饰基因组DNA。LOX-1外引物:上游:5’-TTAGTATTGTGGGAGGTTGAGGTAG-3’, 下游 :5’-TAAAATTTCACCCTTATTACCCA AA-3’。甲基化引物 :上游 : 5’-TTGAAAATATAAAATAATTAGTCGG-3’,下游 : 5’-TAAATTACAATAA CATAATCTCG-3’,产物长度137 bp;非甲基化引物: 上游:5’-TTGAAAATATAAAATAATTAGTTGG-3’,下游 : 5’-AAT AAATTACAATAACATAATCTCAAC-3’, Tm 42℃,产物长度139 bp。PCR反应条件、结果检测与判断按姜怡邓等[9]方法进行。计算公式:甲基化%=甲基化(OD值)/ [甲基化(OD值)+非甲基化(OD值)]×100%。
2 结果
同型半胱氨酸对人脐静脉内皮细胞存活率的影响:人脐静脉内皮细胞存活率降低与不同浓度的同型半胱氨酸作用时间呈依赖关系, 其中100、200、500μM Hcy组在Hcy作用24 h、48 h和72 h后与对照组比较,人脐静脉内皮细胞存活率均降低,500 μ M Hcy组72 h较24 h降低,上述差异有统计学意义(P<0.05~0.001)。表1
表1 同型半胱氨酸对人脐静脉内皮细胞存活率的影响 [()%,n=5]
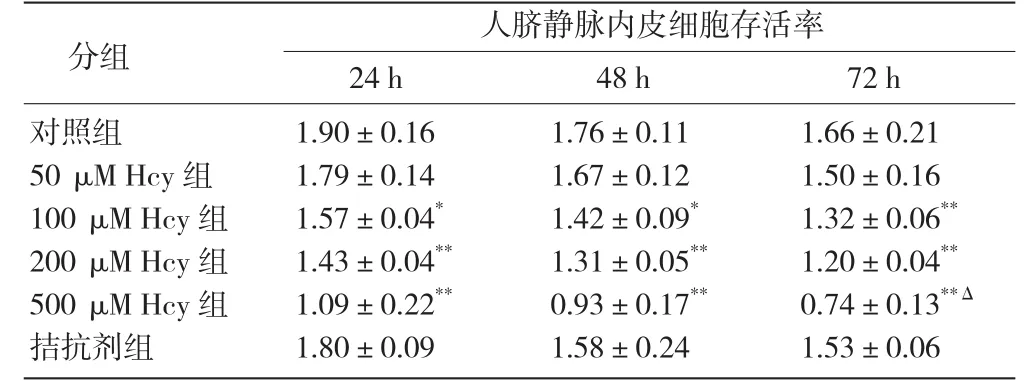
表1 同型半胱氨酸对人脐静脉内皮细胞存活率的影响 [()%,n=5]
注:与对照组比较*P<0.05 **P<0.001;与本组24h比较ΔP<0.05
?
同型半胱氨酸对人脐静脉内皮细胞中氧化低密度脂蛋白和过氧化氢含量的影响 :氧化低密度脂蛋白和过氧化氢含量随Hcy浓度的增加而增加,呈量-效依赖关系,其中100、200、500 μM Hcy组的氧化低密度脂蛋白和过氧化氢的含量比对照组均增加,差异有统计学意义(P<0.001)。表2
表2 同型半胱氨酸 对人脐静脉内皮细胞内氧化低密度脂蛋白和过氧化氢含量的影响 ( ,n=3)
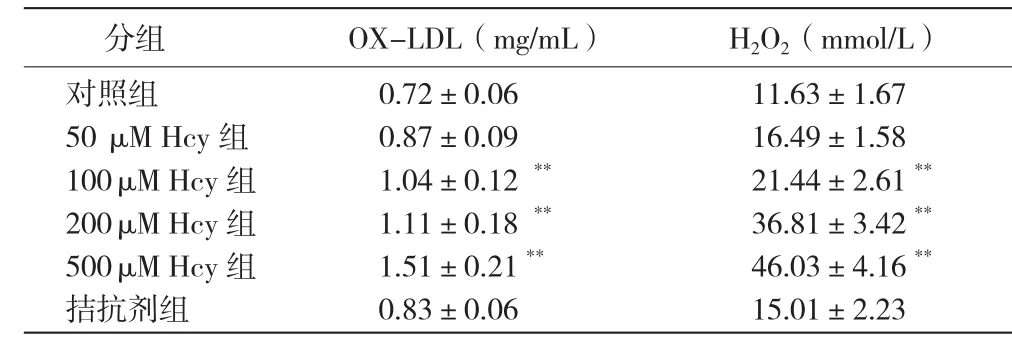
表2 同型半胱氨酸 对人脐静脉内皮细胞内氧化低密度脂蛋白和过氧化氢含量的影响 ( ,n=3)
注:与对照组比较*P<0.05 **P< 0.001。OX-LDL: 氧化低密度脂蛋白H2O2: 过氧化氢 Hcy:同型半胱氨酸
?
同型半胱氨酸对人脐静脉内皮细胞中DNMT-1含量和mRNA表达的影响:DNMT-1的含量和mRNA表达随Hcy浓度的升高而降低,其中100、200和500μM Hcy组与对照组比较,DNMT-1的含量和mRNA表达均降低,差异有统计学意义(P<0.001)。表 3
表3 同型半胱氨酸对人脐静脉内皮细胞中DNMT-1含量和mRNA表达的影响( ,n=3)
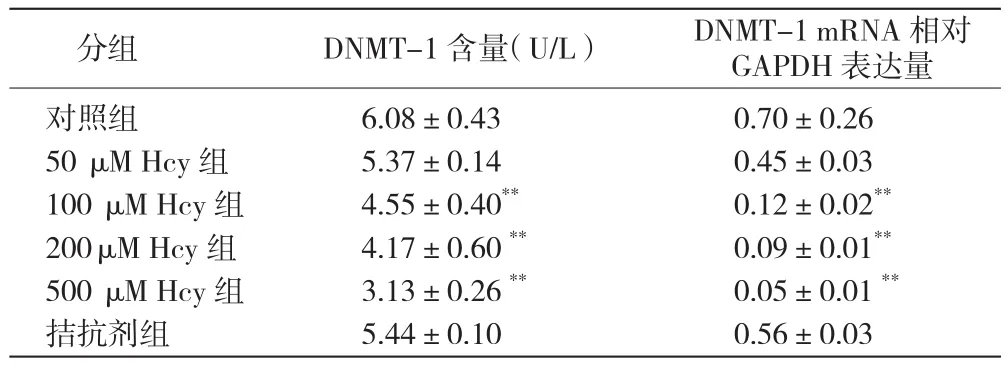
表3 同型半胱氨酸对人脐静脉内皮细胞中DNMT-1含量和mRNA表达的影响( ,n=3)
注:与对照组比较**P<0.001。 DNMT-1: 甲基转移酶-1 mRNA:信使核糖核酸 GAPDH:甘油醛-3-磷酸脱氢酶 Hcy:同型半胱氨酸
分组 DNMT-1含量(U/L) DNMT-1 mRNA相对GAPDH表达量对照组 6.08±0.43 0.70±0.2650 μ M Hcy组 5.37±0.14 0.45±0.03100 μ M Hcy组 4.55±0.40** 0.12±0.02**200μ M Hcy组 4.17±0.60 ** 0.09±0.01**500 μ M Hcy组 3.13±0.26 ** 0.05±0.01 **拮抗剂组 5.44±0.10 0.56±0.03
同型半胱氨酸对人脐静脉内皮细胞中LOX-1 mRNA和蛋白表达的影响 : LOX-1 mRNA相对GAPDH表达量随Hcy浓度的增加而增多,其中100、200和500 μ M Hcy组与对照组比较,LOX-1 mRNA相对GAPDH表达量 及LOX-1 蛋白相对β-肌动蛋白表达量均增加,差异均有统计学意义(P<0.001)。图1,表4

图1 各组人脐静脉内皮细胞中LOX-1蛋白表达图 LOX-1:凝集素样氧化低密度脂蛋白受体-1 β-actin:β-肌动蛋白 1: 对照组 (0μ M Hcy),2: 50μ M Hcy组 3: 100μM Hcy组 4: 200μ M Hcy组 5: 500μ M Hcy组 6:100μ M Hcy+30μM维生素B12+ 30μ M叶酸组
表4 同型半胱氨酸对人脐静脉内皮细胞中LOX-1蛋白和mRNA表达以及LOX-1基因甲基化改变的影响 ( ,n=3)
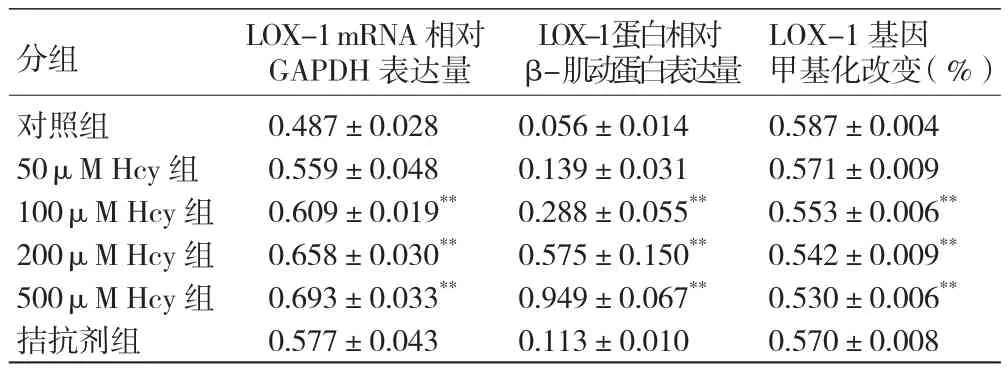
表4 同型半胱氨酸对人脐静脉内皮细胞中LOX-1蛋白和mRNA表达以及LOX-1基因甲基化改变的影响 ( ,n=3)
注:与对照组比较 **P<0.001。余注见表3 图1
分组 LOX-1 mRNA相对GAPDH表达量LOX-1基因甲基化改变 (%)对照组 0.487±0.028 0.056±0.014 0.587±0.00450μM Hcy 组 0.559±0.048 0.139±0.031 0.571±0.009100μM Hcy组 0.609±0.019** 0.288±0.055** 0.553±0.006**200μM Hcy组 0.658±0.030** 0.575±0.150** 0.542±0.009**500μM Hcy组 0.693±0.033** 0.949±0.067** 0.530±0.006**拮抗剂组 0.577±0.043 0.113±0.010 0.570±0.008 LOX-1 蛋白相对β-肌动蛋白表达量
同型半胱氨酸对人脐静脉内皮细胞中LOX-1甲基化改变的影响: LOX-1甲基化程度随Hcy浓度的增高而降低, 其中100、200和500μM Hcy组与对照组比较,LOX-1基因甲基化程度降低, 差异均有统计学意义(P<0.001)。 图 2,表 4
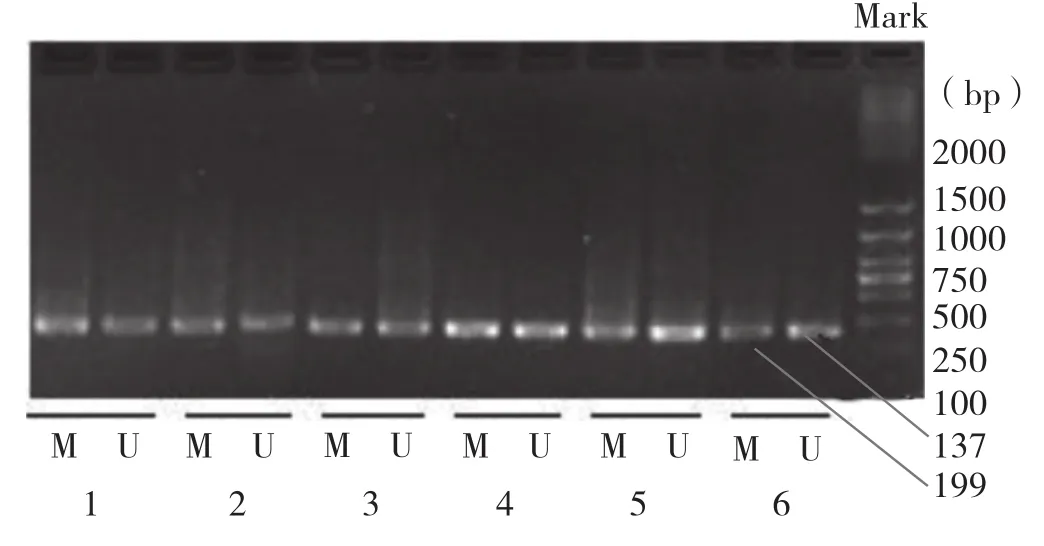
图2 各组人脐静脉内皮细胞中LOX-1基因甲基化扩增产物电泳图。M:甲基化 U:非甲基化。余注见图2
3 讨论
循证医学证据表明,Hcy是动脉粥样硬化重要的独立危险因子。已报道的Hcy促进血管损害的可能机制包括:造成脂质和内皮细胞的氧化损伤;促进血栓的形成;诱发胰岛素抵抗;抑制内皮源性一氧化氮的生成[10]等。但Hcy引起动脉粥样硬化的发病机制并不完全清楚,Hcy如何引起动脉粥样硬化及如何防治仍是国内外学者研究的热点。
活性检测结果显示,不同浓度的Hcy作用于人脐静脉内皮细胞24h、48h、72h后,细胞活性显著降低,尤以72h受损显著,说明Hcy对内皮细胞有损伤作用,从而导致动脉粥样硬化的发生发展,此结果与胡允兆等[11]的结论一致 ,也表明本课题采用不同浓度的Hcy作用人脐静脉内皮细胞72h使其受损,复制细胞模型是成功的。
Hcy是体内一碳单位代谢的中间产物,参与甲基转移的代谢,其异常升高会干扰DNA的甲基化修饰,该代谢途径的异常很可能是Hcy致动脉粥样硬化的关键环节之一。甲基化作为表遗传学的重要内容,不改变DNA 的序列,对基因的表达与沉默起重要的调节作用,通常甲基化程度和基因表达活力呈负相关[12]。LOX-1是介导内皮细胞对氧化低密度脂蛋白等促炎物质的摄取和降解的主要受体,是诱导氧化应激、干扰内皮一氧化氮合成,以致激活内皮细胞炎症反应的重要物质[13]。本文结果显示LOX-1甲基化程度降低,主要原因可能是Hcy是甲硫氨酸循环中的一个关键调控点,由于Hcy的增加以及DNMT-1表达的降低所致的甲基转移减少导致了此循环异常,从而使LOX-1甲基化程度降低,其具体机制有待进一步研究,而本文结果提示Hcy组中LOX-1 mRNA及蛋白的表达增高,而加入拮抗剂叶酸和维生素B12有拮抗Hcy的作用,进一步证明了Hcy引起LOX-1低甲基化是引起内皮细胞损伤重要机制。
为了探讨Hcy引起甲基化水平改变的机制,我们检测了各组内皮细胞中氧化低密度脂蛋白和过氧化氢含量。氧化低密度脂蛋白和过氧化氢是氧化应激的两个重要指标,一方面,LOX-1是氧化低密度脂蛋白的受体, 氧化低密度脂蛋白可激活LOX-1使其表达增多,导致内皮细胞损伤,另一方面,Hcy结构中存在巯基,易发生自身氧化生成过氧化氢等,因此,我们推测Hcy很可能通过活性氧簇以及所形成的氧化应激引起甲硫氨酸循环代谢异常,从而导致LOX-1甲基化改变,介导内皮细胞损伤, 氧化低密度脂蛋白和过氧化氢表达量的增加可能是引起基因甲基化重要机制之一,仍有待进一步研究。
综上所述,Hcy引起内皮细胞损伤与过氧化氢、氧化低密度脂蛋白、DNMT-1和LOX-1等的表达密切相关,其中LOX-1 甲基化起了重要的作用,是引起内皮细胞损伤又一重要机制。本文对甲基化的深入研究可能会为动脉粥样硬化的防治提供一个新的思路。
[1] Taban-Shomal O, Kilter H, Wagner A et al.The cardiac effects of prolonged vitamin B12and folate deficiency in rats . Cardiovasc Toxicol, 2009, 9 : 95-102.
[2] Koh JM, Lee YS, Kim YS, et al. Homocysteine enhances bone resorption by stimulation of osteoclast formation and activity through increased intracellular ROS generation.J Bone Miner Res, 2006, 21 :1003-1011.
[3] 徐支芳,于海娇,马琳娜,等.TLR4/NF-ΚB信号通路在同型半胱氨酸致内皮细胞损伤中的作用研究. 重庆医科大学学报,2011,36 :1409-1412.[4] Zafari AM, Ushio-Fukai M, Akers M, et al.Role of NADH /NADPH oxidase-derived H2O2in angiotensinIIinduced vascular hypertrophy.Hypertension,1998,32:488-495.
[5] 李 飞,王景峰,聂如琼,等. Ox-LDL对巨噬细胞Toll样受体和炎症反应的影响以及GW1929的干预作用.中国病理生理杂志,2008,24 :909-914.
[6] Zhao Q,Rank G,Tan YT, et al. PRMT5-mediated methylation of histone H4R3 recruits DNMT3A, coupling histone and DNA methylation in gene silencing. Nat Struct Mol Biol,2009,16:304 -311.
[7] 孙艳侠,王国干,催小岱,等. 曲美他嗪对病毒性心肌炎小鼠的保护作用及其机制. 中国循环杂志,2012,27 :224-227.
[8] 袁晓晨,刘乃丰,严金川,等.过氧化物酶体增殖物激活受体γ对糖基化终产物诱导大鼠血管平滑肌细胞增殖的作用.中国心血管病杂志,2005,33 :940-944.
[9] 姜怡邓,孙炜炜,马长剑,等. LDLR启动子区DNA甲基化调控同型半胱氨酸致平滑肌细胞增殖的作用机制. 基础医学与临床,2012,32 :245-250.
[10] 郑平,刘学文,祁哲,等.别嘌呤醇对同型半胱氨酸和低密度脂蛋白协同损伤血管内皮细胞的保护作用.中国循环杂志,2005,20 :172-175.
[11] 胡允兆,董吁钢,翟玉锋,等.辛伐他汀对同型半胱氨酸诱导的人脐静脉内皮细胞的毒性和炎症反应的影响.中华医学杂志.2006,86:2297-2300.
[12] Yu X,Ling W, Mi M. Relationship of impairment induced by intracellular S-adenosylhomocysteine accumulation with DNA methylation in human umbilical vein endothelial cells treated with 3-deazaadenosine. Int J Exp Pathol, 2009,90 :638-648.
[13] Zhu WG,Li S,Lin LQ,et al.Vascular oxidative stress increases dendritic cell adhesion and transmigration induced by homocysteine.Cell Immunol,2009,254 :110-116.

