白芷醇提液中总黄酮测定方法的比较研究
★ 吴铁松* 吴丽霞(广东深圳市龙华新区观澜人民医院药剂科 深圳 518110)
1 前言
白芷为伞形科植物川白芷(Angelica dahurica(Fisch.ex Hoffm)Benth.et Hook.f)或杭白芷(Angelica dahurica(Fisch.ex Hoffm)Benth.et Hook.f.Var.formosana(Boiss)Shan et Yuan)的干燥根。始载于《神农本草经》,列为中品。《中国药典》各个版本均有收载。白芷性温味辛,归胃、大肠、肺经。具有散风除湿、通窍止痛、消肿排脓之功效,用于感冒头痛、鼻塞、鼻渊、牙痛、白带异常、疮疡肿痛等病症[1-2]。黄酮类化合物广泛分布在植物界中,因具有各种显著生物活性已成为目前研究的热点。近年来黄酮类化合物因其独特的功效,常作为降血糖、降血脂、抗心律失常、抗氧化、增强机体免疫力的药物予以应用[3]。白芷的化学成分主要为香豆素类和挥发油类,也含有黄酮类化合物[4]。在白芷的化学成分含量测定的研究上,近年来主要对香豆素类、挥发油类进行大量的研究,例如已报道采用薄层扫描法[5]、反相高效液相色谱法[6]、紫外分光光度法[7]、毛细管色谱法[8]等方法对白芷中一种或几种主要香豆素含量测定。但未见有白芷的黄酮类化合物含量测定,此方面实属空缺,值得研究。本试验采用微波辅助提取法提取总黄酮,采用分光光度法进行测定。
2 仪器与试剂
2.1 仪器
UV-4501S型紫外可见分光光度计(天津市港东科技有限公司),电子分析天平(厦门精艺科技有限公司),电热恒温干燥箱(上海跃进医疗器械厂),HH-4数显恒温水浴箱(上海跃进医疗器械厂),XH-100A微波快速制样系统(北京祥鹄科技有限公司)。
2.2 试剂
白芷(购于樟树中药饮片公司,由广东药学院中药学院生药教研室鉴定):芦丁精品(由广东药学院药物化学实验室提供):石油醚、无水乙醇、硝酸铝、亚硝酸钠、三氯化铝、氢氧化钠均为分析纯。
3 方法与结果
3.1 白芷中总黄酮的乙醇提取
将5.0g原药材粉(过40目筛)置于60%乙醇水溶液200mL中室温浸泡2h,置于微波(温度50度,功率500W)中提取2次,合并提取液,粗提取液经石油醚萃取,用60%乙醇浓缩定容至100mL,作为待测液。
3.2 芦丁对照品溶液的配制
准确称取120℃干燥后的芦丁对照品10.5mg,加入适量60%乙醇,稍加热溶解,冷却后用60%乙醇定容至100mL,摇匀备用,配成质量浓度为0.0105 mg/mL的芦丁对照溶液。
3.3 紫外分光光度法测白芷醇提液中总黄酮
3.3.1 最大吸收峰的确定:在190-500nm波段,以1nm为间隔对芦丁对照液和样品进行光谱扫描如下图1,结果芦丁在205nm处出现最大吸收峰,样品在该处也有最大吸收峰。

图1 芦丁对照液和白芷醇提液的紫外吸收图
3.3.2 标准曲线的制备:精密吸取0.0、1.0、2.0、3.0、4.0、5.0mL芦丁对照品溶液,分别置于试管中,用体积分数为60%乙醇稀释至10mL,摇匀。以60%乙醇为空白,在最大吸收波长处测吸光度,并以芦丁用量(mg/ml)为横坐标,吸光度为纵坐标作曲线,得回归方程:Y=0.1762X+0.0108,r=0.9993。

表1 芦丁对照品线性关系考察

图2 不加显色剂的芦丁标准曲线
3.3.3 中药白芷提取物中总黄酮含量测定:吸取1mL待测样,用60%乙醇定容至10 mL,以60%乙醇作空白液,在205 nm处测定吸光度,并代入回归方程计算总黄酮的含量。
3.4 络合-分光光度法测定白芷提取物中的总黄酮含量
3.4.1 AlCl3显色法
3.4.1.1 最大吸收峰的确定:在190-1 000nm波段,以1nm为间隔对芦丁对照液和样品进行光谱扫描如下图3,结果:芦丁约在510nm处出现最大吸收峰,样品在该处也有最大吸收峰。
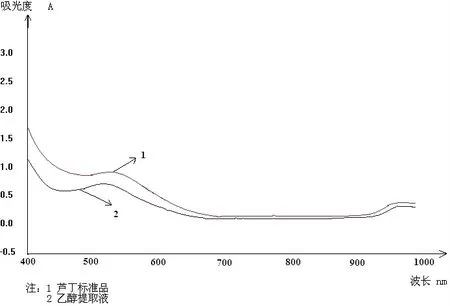
图3 AlCl3显色的芦丁对照液和白芷醇提液紫外吸收图
3.4.1.2 标准曲线的制备:精密吸取0.0、1.0、2.0、3.0、4.0、5.0 mL芦丁对照品溶液,分别置于6支试管中,然后分别加入定量的AlCl3溶液,并用60%乙醇稀释至10mL。以60%乙醇为空白,在最大吸收波长处测吸光度,作出标准曲线,得回归方程:Y=0.126X+0.022,r=0.9975

表2 AlCl3显色的芦丁对照品线性关系考察
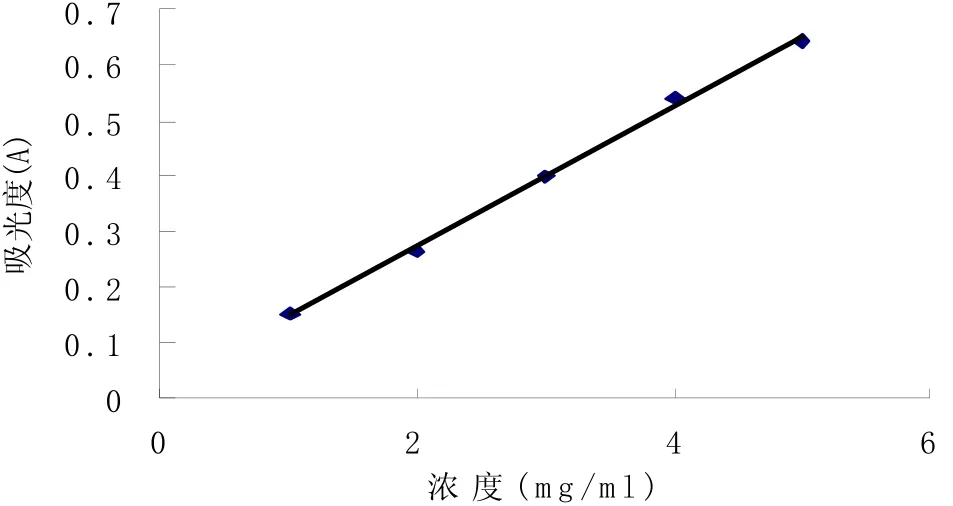
图4 AlCl3显色的芦丁标准曲线
3.4.1.3 样品黄酮含量的测定:取1mL白芷醇提液,加入AlCl3溶液显色,用60%乙醇定容至10mL,以60%乙醇为空白,测吸光度,并代入回归方程计算总黄酮的含量。
3.4.2 Al(NO3)3显色法
3.4.2.1 最大吸收峰的确定:在190-1 000nm波段,以1nm为间隔对芦丁对照液和样品进行光谱扫描如上图3,结果芦丁约在510nm处出现最大吸收峰,样品在该处也有最大吸收峰。
3.4.2.2 标准曲线的制备:精密吸取0.0,1.0,2.0,3.0,4.0 ,5.0mL芦丁对照品溶液,分别置于试管中,均加入5%NaNO20.1mL,摇匀,放置6分钟后均加入10%Al(NO3)30.1mL,摇匀,放置 6 分钟,再分别加入1moL/LNaOH 3mL,摇匀,放置15分钟,然后以50%乙醇为空白,在510nm波长处分别测定吸光度,绘制标准曲线,得回归方程:Y=0.1687X-0.0012,r=0.9972。

表3 A(lNO3)3显色的芦丁对照品线性关系考察

图5 Al(NO3)3显色的芦丁标准曲线
3.4.2.3 样品黄酮含量的测定:分别吸取1mL醇提液,按3.4.2.2操作,以60%乙醇作空白液,测510nm处的吸光度,并代入回归方程计算总黄酮的含量。
3.5 实验结果
根据以上3种方法得出实验结果如见表4。

表4 3种方法测定结果
4 结论
由表4可知采用不加任何显色剂的方法测得的总黄酮含量最高,可能原因是60%乙醇-水溶液使甾体、果胶、低聚糖、蹂质、色素及其他多酚类物质一起提取出来,这些杂质尤其是色素严重干扰测定,使得测定结果不准确。
络合-分光光度法可以避免醇溶性有关杂质的干扰,本实验采用了AlCl3显色法和Al(NO3)3络合法测定白芷醇提液中黄酮含量,由表4可知Al(NO3)3络合法测得的总黄酮含量比AlCl3络合法测得的总黄酮含量要高。Al(NO3)3络合法的基本原理是先用NaNO2还原黄酮,黄酮类化合物中的3-羟基、4-羟基、5-羟基、4-羰基或邻二位酚羟基,与Al3+进行络合反应,最后加NaOH溶液(在碱性条件下)使黄酮类化合物开环,生成2′-羟基查耳酮红色络合物而显色,从而进行显色定量。该法源于芦丁含量测定法,并逐步用于黄酮类化合物的测定后来发现这并不是黄酮类化合物的专属反应,因为凡具有也只有具有邻苯二羟基的物质,均能用此法进行显色定量[9]。而AlCl3显色法其反应原理是黄酮母核上有3-OH和或5-OH,B环上有邻位二经基时(这是黄酮类化合物的典型结构),AlCl3可与之生成黄色的黄酮铝配合物[10],从而进行显色定量。AlCl3显色法测定时芦丁、桑色素等黄酮类物质反应强烈,而对酚酸、原花色素的反应很小,因此该法对黄酮类化合物的专属性较强,适于白芷总黄酮的测定[11]。
本实验白芷醇提液中总黄酮并未经过纯化处理,可能这些杂质能与Al(NO3)3络合从而干扰测定。另外Al(NO3)3络合法使用了强碱NaOH溶液,提取液中可能含有天然色素,这些色素会在碱液显色,从而造成测定结果产生偏差[11]。而相对影响AlCl3显色法的因素较少,测定结果偏差较小。两种方法的结果分析结果相近,分别为58.6mg、60.0mg。因此采用影响因素较少的AlCl3显色法测定结果较准确。
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2005:89.
[2]张富强,聂红,韦艺,等.白芷的化学与药理研究进展[J].南京中医药大学学报(自然科学版),2002,18(3):190
[3]Manach C,Donovan J L.Pharmacokinetics and metabolism of dietaryflavonoids in humans[J].Free Radical Research,2004,38(8):771-785.
[4]Cherng J M,Chiang W,Chi L C.angImmunomodulatory activities of common vegetables and spices of Umbelliferae and its related coumarins and flavonoids[J].Food Chemistry,2008,106(3):944-950.
[5]李宏宇,戴跃进,张海波,等.不同商品白芷中香豆素的薄层扫描法测定含量[J].华西药学杂志,1990,5(3):165
[6]李宏宇,戴跃进,谢成科.川白芷中香豆素类成分的反相高效液相色谱分析[J].华西药学杂志,1990,5(4):231
[7]马逾英,钟世红,贾敏如,等.紫外分光光度法测定川白芷中总香豆素类成分的含量[J].华西药学杂志,2005,20(2):159-160.
[8]Yi Chen,Guorong Fan,Bin Chen,et al.Separation and quantitative analysis of coumarin compounds from Angelica dahurica(Fisch.ex Hoffm)Benth.et Hook.F by pressurized capillary electrochromatography[J].J Pharmacut Biomed,2006,41(1):105-116.
[9]胡冠时,姜淑琴,杨进黄酮化合物的邻位二羟基显色反应的探讨[J].药学通报,1980,15(5):2-3.
[10]中国科学院上海药物研究所.黄酮体化合物鉴定手册[M].北京:北京科学出版社,1981.
[11]徐宝才,丁霄霖.苦荞黄酮的测定方法[J].江苏:无锡轻工大学学报,2003,22(2):98-101.

