土霉素菌渣热解液的理化特性及成分分析
陈 昆,郭 斌,2,3,贡丽鹏,宋汉宁
(1.河北科技大学环境科学与工程学院,河北石家庄 050018;2.河北省固体废物资源化工程技术研究中心,河北石家庄 050018;3.河北省污染防治生物技术实验室,河北石家庄 050018)
土霉素菌渣是抗生素生产过程中产生的固体废物,截止2009年,中国抗生素原料药的生产企业有181家,产生的抗生素菌丝体废物约为130万t[1-4]。石家庄市是全国抗生素生产基地之一。由于抗生素菌丝体废物做饲料“一是容易引起耐药性,二是由于未做安全性试验,存在各种安全隐患”,因此农业部在2002年将其列入《禁止在饲料和动物饮用水中使用的药物品种目录》,菌丝体废物的处理成为一个难题。
目前国内外对菌渣的传统处置方式主要是焚烧处置、垃圾场填埋等方式。但是传统的处置方式会污染环境。热解技术[5]的研究起步较晚,大多停留在实验室阶段,还没真正达到工业化阶段。在固体废物处理中,热解技术多用于污泥处置,如SHIBATA首次阐明了污泥热解装置及热解工艺,20世纪70年代,德国的科学家KUTUBUDDIN和BAYER对污泥热解进行了深入研究,开发了污泥低温热解工艺[6-8]。
土霉素菌渣热解是一个复杂的物理化学过程,涉及到传热、传质、化学反应、物理变化等方面。课题组分别采用固定床和移动床对菌渣进行了热解技术处理,初步研究表明通过热解可以得到活性炭和副产物热解液[9],目前国内外有关对菌渣热解液特性及成分分析的研究尚未见报道。为更好地资源化利用热解液,本文对其进行了理化特性和成分分析研究。
1 实验部分
1.1 实验原料
实验所选用土霉素菌渣样品取自石家庄市某制药厂。土霉素菌丝体热解过程:将一定量土霉素菌丝体置入固定床(管式加热炉)中,在流量为100 mL/min的N2保护下加热热解,在升温速率为10 ℃/min下,热解温度为300~600 ℃,保温2 h,制得系列热解液。
1.2 实验方法
1.2.1 元素分析
元素分析采用美国利曼-徕伯斯公司生产的Vario EL CUBE 元素分析仪。实验过程中,称取热解液2 mg,精确至0.001 mg,测量时间为45 s左右,氧化炉温度为1 050 ℃,热岛检测器与色谱柱温度为110 ℃,载气压力为75 kPa,载气流量为120 mL/min,加氧量为25 mL,氧气压力为45 kPa。
1.2.2 含水率的测定
热解液中水分测定参照石油产品水分测定的国家标准(GB/T 260—1977)。
1.2.3 密度的测定
热解液密度的测定参照原油和液体石油产品密度的实验室测定液体密度计法(BS EN ISO 3675—1998)。
1.2.4 粘度的测定
热解液粘度的测定参照石油产品粘度测定的国家标准(GB/T 265—1988)。
1.2.5 热值的测定
热值分析采用北京北信科仪分析仪器有限公司生产的XRY-1B氧弹热值仪进行测定。其热量是根据石油产品热值测定法(GB/T 384—1981)进行计算。
1.2.6 成分分析
本实验采用美国Clarus500GC/MS (PerkinElmer),Agilent4890D气相色谱仪。实验条件如下。
1)气相色谱条件 色谱柱:HP-5(Crosslinked 5% PH ME Siloxane),30 m×0.25 mm×0.25 μm;升温程序:以4 ℃/min的升温速度,从50 ℃升到250 ℃,用时5 min;载气He流速为1 mL/min;进样口温度为270 ℃;FID检测器温度为270 ℃;H2流速为40 mL/min,空气流速为400 mL/min;分流比为30︰1;进样量为1 μL。
2)质谱条件 电离源EI;源温度为200 ℃;电子轰击能量为70 eV;倍增器电压为311 V;接口温度为270 ℃;质谱扫描范围为40~380 amu;溶剂延迟时间为2 min。
2 结果与讨论
不同温度热解液油相与水相产率见表1。
2.1 热解液元素分析
在热解终温450 ℃时产生的热解液理化性质最好,而且油品最具代表性,因此元素分析以450 ℃热解液为研究对象,常温下,450 ℃热解液自然分层,其中油相体积占51.89%、水相占 48.11%。土霉素菌渣热解液元素分析结果详见表2。

表1 不同温度下热解液各成分体积分数Tab.1 Different temperature pyrolysis liquid yield of each component

表2 土霉素菌渣热解液元素分析结果Tab.2 Analytical results of oxytetracycline residue pyrolysis liquid element
由表2可以看出热解液油相中C元素质量分数(下同)高于50%,说明热解液油相中存在大量有机物,热解液中油相C元素(56.44%)远高于水相C元素(37.50%),水相中仍含有少量有机物。热解液油相O元素(29.94%)与水相O元素(36.27%)质量分数高会使得热解液粘度偏高,且热解液的O元素质量分数高会影响热解液储存的稳定性。由于菌渣成分含有较多蛋白质致使热解液油相N元素(6.91%)与水相N元素(21.14%)质量分数较高。热解液油相与水相中均不含S元素,含有由C,H,O,N组成的各种有机物。
2.2 土霉素菌渣热解液的理化特性
土霉素菌渣热解液油相、水相的含水率、热值、粘度、密度等理化特性见表3、表4。

表3 土霉素菌渣热解液油相理化特性Tab.3 Characteristics of oxytetracycline residue pyrolysis oil phase
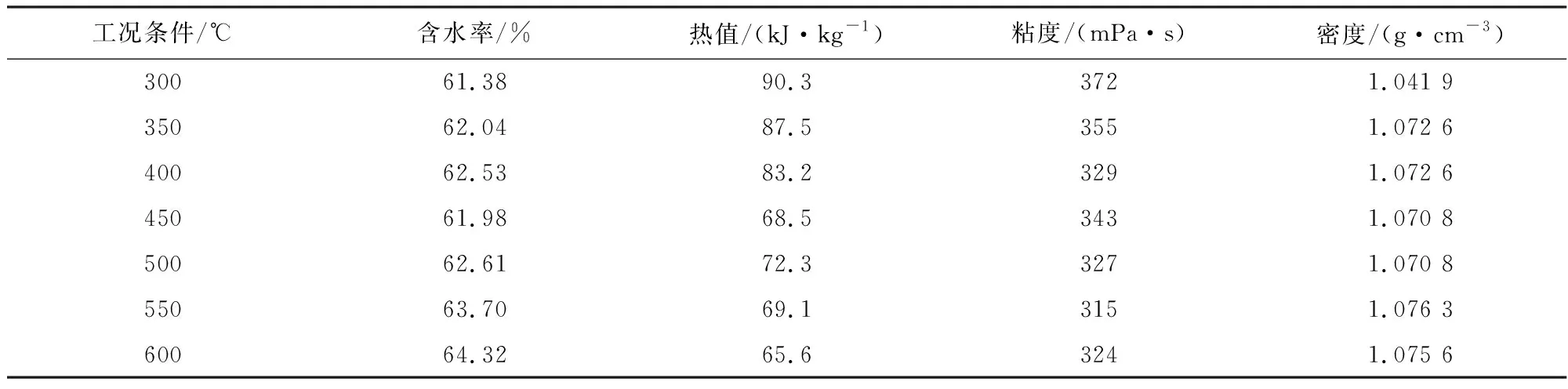
表4 土霉素菌渣热解液水相理化特性Tab.4 Physicochemical properties of oxytetracycline residue pyrolysis liquid phase

图1 不同温度下土霉素菌渣热解液含水率Fig.1 Moisture content of oxytetracycline residue pyrolysis under different temperature
2.2.1 含水率分析
热解液油相与水相含水率随着温度变化见表3和表4及图1。从热解液油相变化曲线可以看出随着温度从300 ℃升高到600 ℃,热解液油相含水率(体积分数,下同)从13.47%降到了9.56%,在300~350 ℃范围内,含水率变化缓慢,大于350 ℃后随着温度升高含水率开始变小。水相含水率随着温度升高而升高,在300~600 ℃范围内,其含水率从61.38%增加到64.32%。可能是由于温度低,热解液中水合物脱水反应尚未开始,达到一定温度后,随着温度的增加,水合物脱水反应加剧,热解液油相中的水转移至水相所致。水分会影响燃料油的燃烧性能,同时水分的增加也会降低油的粘度。
2.2.2 热值分析
由不同温度下土霉素菌渣热解液热值结果(见表3和表4)可知,热解液油相热值比水相热值高很多, 这说明油相中的有机物比水相中的多。热值越高,利用价值越高。从变化曲线(见图2)可以看出热解液油相热值变化趋势比较平缓,随着温度从300 ℃升高到600 ℃,油相热值从30.93 MJ/kg增加到33.91 MJ/kg,增幅较少;水相热值随温度增高而减少,当热解温度由300 ℃升高到600 ℃时,水相热值从90.3 kJ/kg减至65.6 kJ/kg。这主要是因为温度的升高油相水分减少,致使油相热值增大,水相水分增多使得其热值减少。
2.2.3 粘度分析
由热解液油相与水相粘度随着温度变化情况(表3、表4及图3)可以看出,随着温度从300 ℃升高到600 ℃,热解液油相粘度从6 980 mPa·s增加到8 913 mPa·s,这可能是因为脱水反应使得油相水分减小,有机物的比重增大。从曲线图(图3)可以看出从400 ℃开始粘度急剧增大这是由于反应较剧烈,但是550 ℃后粘度几乎不再变化这可能是因为反应趋于平衡。热解液水相粘度随着热解温度的升高,水相粘度从372 mPa·s减少到324 mPa·s。分析原因主要是由于热解液水相含水率随热解温度升高而增加,致使粘度随之降低。粘度反映了油品的流动性。
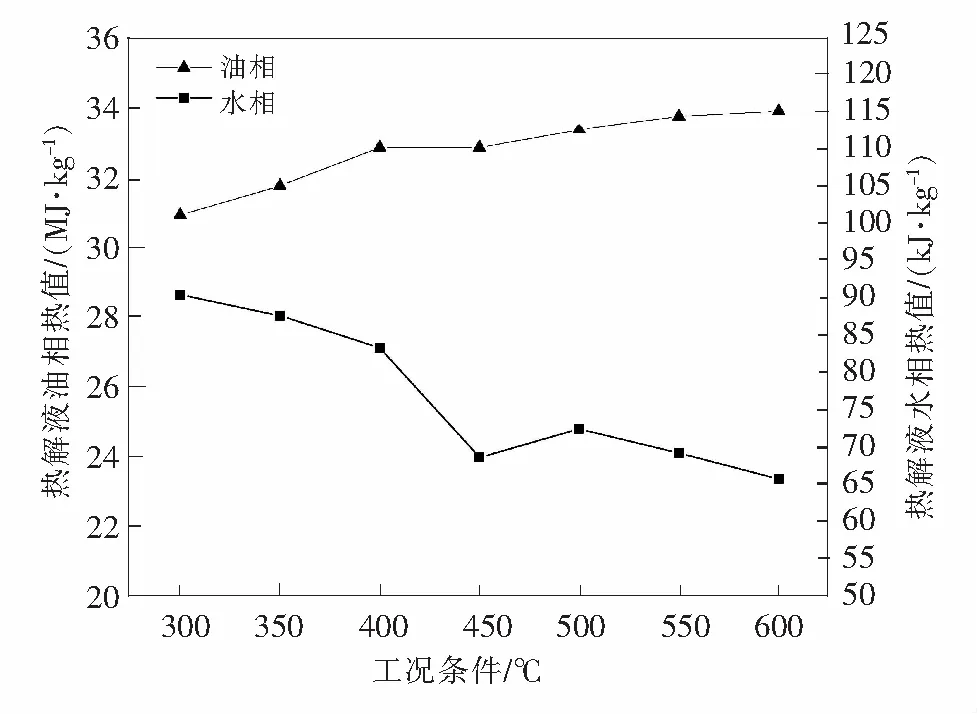
图2 不同温度下土霉素菌渣热解液热值Fig.2 Calorific value of oxytetracycline residue pyrolysis oil phase and water phase value under different temperature

图3 不同温度下土霉素菌渣热解液油相与水相粘度Fig.3 Oxytetracycline residue pyrolysis oil and aqueous phase viscosity under different temperature
2.2.4 密度分析

图4 不同温度下土霉素菌渣热解液油相与水相密度Fig.4 Oxytetracycline residue pyrolysis oil and water phase density under different temperature
由热解液油相密度与水相密度变化曲线(见图4)可以看出,热解液油相密度随热解温度的增加而增加,当热解温度从300 ℃升高到600 ℃时,热解液油相密度从1.089 8 g/cm3增加到1.127 9 g/cm3;在300~600 ℃的热解温度范围内,水相密度随着温度的变化不明显,热解液水相密度在1.041 9~ 1.075 6 g/cm3之间。热解液密度对于热解液的储存、输送及应用是一个重要的参数。
2.3 土霉素菌渣的热解液成分分析
表5和表6给出了热解液的主要组成及各组分理化性质(如分子量和沸点)及相对质量分数。结果显示,热解液油相和水相均为C,H,O,N组成的有机物,不含有S,与元素分析结果一致。其中氮化物含量较高,氮化物的存在影响热解液储存的稳定性。由表7、表8看出,热解液中的氮化物主要为腈化合物、碱性氮化物、非碱性氮化物。
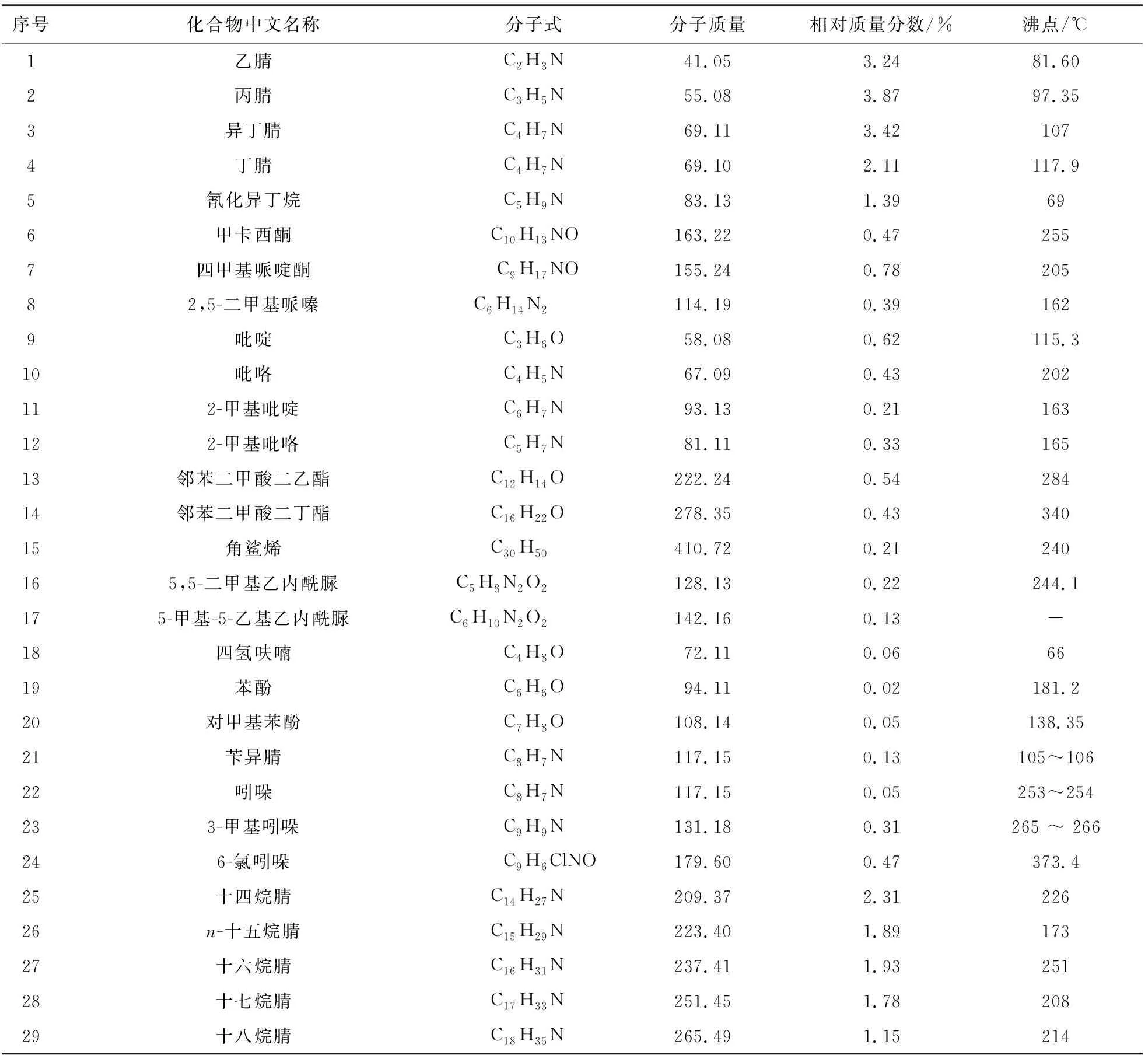
表5 热解液油相成分列表Tab.5 Composition analysis of pyrolysis liquid oil phase
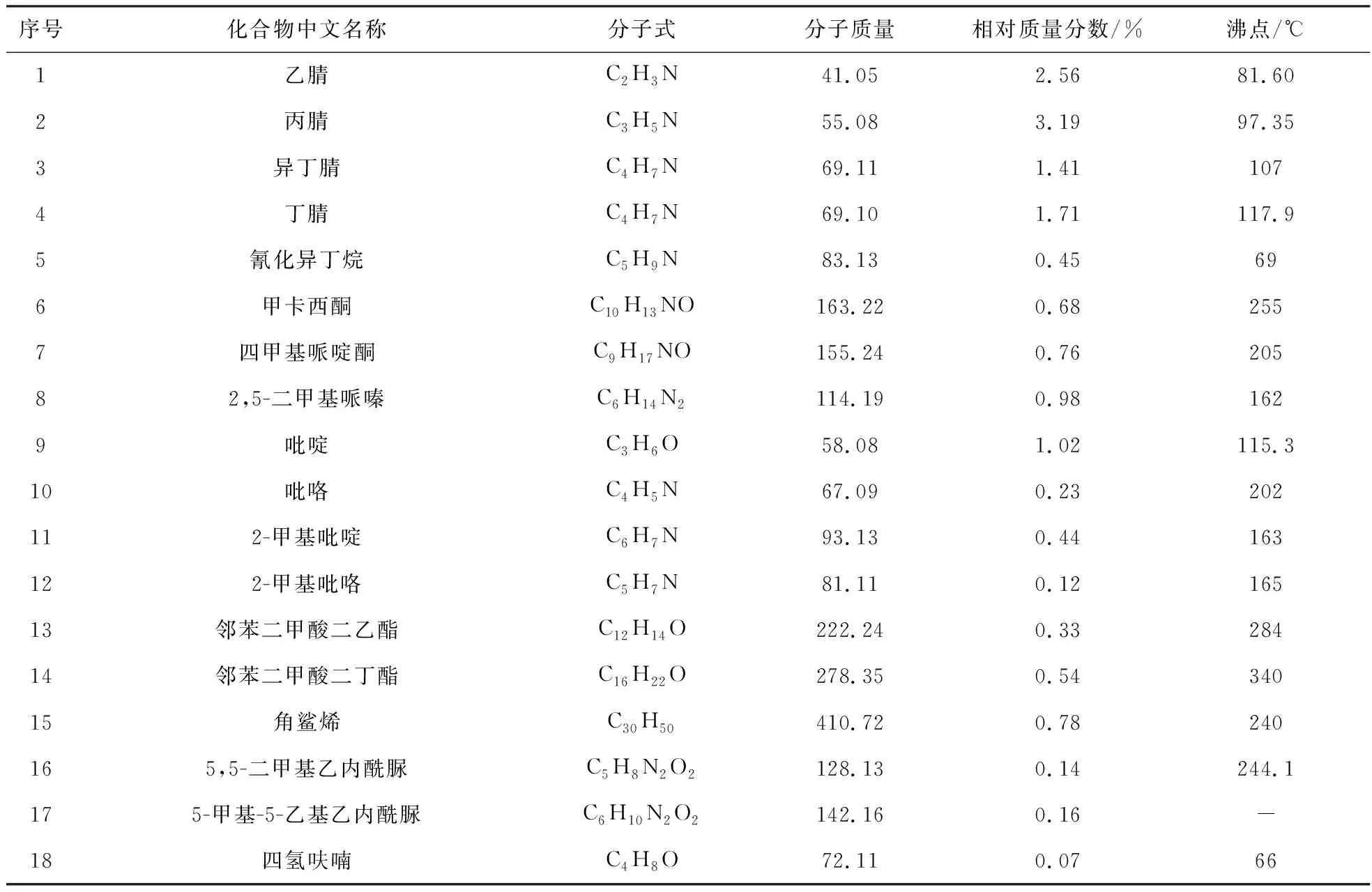
表6 热解液水相成分列表Tab.6 Composition analysis of pyrolysis liquid liquid aqueous phase

表7 热解液油相有机物比例Tab.7 Organic matter ratio of pyrolysis oil phase %

表8 热解液水相有机物比例Tab.8 Organic matter ratio of pyrolysis liquid phase %
2.3.1 腈化合物
腈化合物[10]是一类含腈基功能团的化学物质(R—CN),是一种重要的合成原料。由腈化合物出发可以获得酰胺、酸、酯等价值更高、应用范围更广的一类化合物,它们被广泛应用于化工原料、医药中间体、维生素的前体[11]。腈化合物在油相与水相所占质量分数较高(油相23.69%,水相9.32%),而且腈化合物种类很多,可以分离出腈类物质再进行精制。
2.3.2 碱性氮化物
碱性氮化物[12]对油品的危害主要表现在以下3个方面,即造成具有酸活性中心的催化剂活性降低,油品颜色加深和安定性降低及大气污染。碱性氮化物能使FCC催化剂中毒,在催化重整反应中原料油中的碱性氮化物会生成氨,进而生成氯化铵,使催化剂的酸性中心功能减弱而失活[13],从表7和表8可以看出热解液油相与水相碱性氮化物质量分数较少(油相0.83%,水相1.46%),油相和水相中的碱性氮化物均为吡啶、2-甲基吡啶。
2.3.3 非碱性氮化物
在一定的条件下原料中的非碱性氮化物[14]可以转化生成碱性氮化物,例如,在加氢的条件下吡咯(非碱性氮)可以转化生成二氢吡咯和吡咯烷(碱性氮), 吲哚、咔唑(非碱性氮)加氢时也可转化生成碱性的二氢吲哚、四氢咔唑;催化裂化柴油中的非碱性氮化物单独存在时可使柴油颜色变深[15]。从表7和表8可以看出非碱性氮化物质量分数较小(油相1.56%,水相0.35%)。油相非碱性氮化物为吡咯、2-甲基吡咯、吲哚、3-甲基吲哚、6-氯吲哚;水相非碱性氮化物为吡咯、2-甲基吡咯。
3 结 论
土霉素菌渣在300~600 ℃的热解温度范围内,产生的热解液中油相和水相含水率、热值、粘度和密度随着温度变化的趋势如下。油相含水率随着温度升高降低,从13.47%降到9.56%;热值、粘度和密度随着温度升高而增大,分别从30.93 MJ/kg到33.91 MJ/kg、从6 980 mPa·s到8 913 mPa·s从1.089 8 g/cm3到1.127 9 g/cm3。水相含水率从61.38%升到64.32%;热值、粘度随温度升高而下降,分别从90.3 kJ/kg,372/mPa·s下降到65.6 kJ/kg,324 mPa·s;密度随温度变化不大,在1.041 9~1.075 6 g/cm3之间。
热解液油相成分种类比较多,检测到29种有机物,其中氮化物有23种;氮化物中腈化合物质量分数较高,达23.69%(11种),碱性氮化物2种,非碱性氮化物5种,其他氮化物5种。水相碱性氮化物2种,非碱性氮化物2种,腈化合物5种,其他化合物5 种。
热解液中含氮有机物质量分数较高(约25%以上)将会直接影响到热解液的燃料应用(燃料中氮含量一般为10-6级),下一步应重点研究热解液分离技术,回收热解液中高附加值的化学物质,或采用加氢精制及其他方法脱去热解液中氮以便于燃料和溶剂的利用。
参考文献/References:
[1] 保 澎.固体废物的处理与应用[M].北京:冶金工业出版社,1999.
BAO Peng. Solid Waste Treatment and Recycling[M]. Beijing:Metallurgical Industry Press,1999.
[2] 周保华, 高 勤, 王洪华,等.青霉素、土霉素菌渣研究利用现状及特性分析[J].河北工业科技,2011,28(5):291-294.
ZHOU Baohua, GAO Qin, WANG Honghua, et al. Study on slag bacteria using oxytetracycline penicillin, analysis of the status quo and characteristics[J]. Hebei Journal of Industrial Science and Technology,2011,28(5):291-294.
[3] 贡丽鹏,郭 斌,任爱玲,等.抗生素菌渣理化特性[J]. 河北科技大学学报,2012,33(2):190-196.
GONG Lipeng, GUO Bin, REN Ailing, et al. Physical and chemical properties of antibiotics residue[J].Journal of Hebei University of Science and Technology, 2012,33(2):190-196.
[4] 李再兴,田宝阔,左剑恶,等. 抗生素菌渣处理处置技术进展[J].环境工程,2012,30(2):72-75.
LI Zaixing,TIAN Baokuo,ZUO Jian′e, et al. Antibiotic bacteria slag disposal technology progress[J]. Environment Engineering, 2012,30(2):72-75.
[5] 刘守新,张世润. 生物质的快速热解[J]. 林产化学与工业, 2004, 24(3):95-101.
LIU Shouxin,ZHANG Shirun. Fast pyrolysis of biomass[J]. Chemistry and Industry of Forest Products,2004,24(3):95-101.
[6] 韩晓芳,顾建新,李 燕.污泥处置现状及新技术探讨[J].国外建材科技,2006,27(5):43-46.
HAN Xiaofang, GU Jianxin,LI Yan. Discussion on sludge disposal status and new technology[J]. Technology of Foreign Building Materials, 2006,27(5):43-46.
[7] 赖艳华, 吕明新, 马春元, 等. 秸秆类生物质热解特性及其动力学研究[J]. 太阳能学报, 2002, 23 (2) : 203-206.
LAI Yanhua,LYU Mingxin,MA Chunyuan,et al. Study on the characteristic and dynamics of pyrolysis process agricultural residues[J] . Acta Energiae Solaris Sinica,2002,23 (2) : 203-206.
[8] 王 群,邹 鹏. 污水污泥的热解处理[J]. 再生资源研究,2004(4):28-41.
WANG Qun,ZOU Peng. Pyrolysis of sewage sludge[J]. Research on Renewable Resources,2004(4):28-41.
[9] 贡丽鹏.土霉素菌渣热解技术的研究[D].石家庄:河北科技大学,2012.
GONG Lipeng. Study on Oxytetracycline Residue Pyrolysis Technology[D].Shijiazhuang: Hebei University of Science and Technology,2012.
[10] 刘 鑫,游 松,苏 昕.微生物酶催化腈类化合物的研究进展[J].沈阳药科大学学报,2012,29(6):485-490.
LIU Xin,YOU Song,SU Xin.Development of microbial enzyme-catalyzed reaction of nitrile compounds[J]. Journal of Shenyang Phamaceutical University,2012,29(6):485-490.
[11] 徐建妙,郑裕国,沈寅初.腈水解酶的来源、结构、作用机制及其应用[J].微生物学通报, 2005,32(5):142-146.
XU Jianmiao,ZHENG Yuguo,SHEN Yinchu. The source, structure, working mechanism and application of nitrilase[J]. Microbiology,2005,32(5):142-146.
[12] 赵训志,隋芝宇,李 佳,等. 碱性氮化物对油品的危害及脱除研究进展[J].工业催化,2009(17):60-62.
ZHAO Xunzhi,SUI Zhiyu,LI Jia,et al. Research progress of damage to oil and the removal of basic nitrogen[J]. Industrial Catalysis,2009(17):60-62.
[13] 马 骏,王海彦,张少华,等.吸附法脱除催化轻汽油中碱性氮化物[J].石油化工高等学校学报,2001,14(2):11-14.
MA Jun,WANG Haiyan,ZHANG Shaohua,et al. Removal of basic nitrogen compounds from light FCC gasoline by adsorption[J]. Journal of Petrochemical University,2001,14(2):11-14.
[14] 张会成,颜涌捷,齐邦峰,等. 渣油加氢处理过程中氮分布与脱除规律的研究[J]. 石油炼制与化工,2007,38(4):43-46.
ZHANG Huicheng,YAN Yongjie,QI Bangfeng,et al. Study on the nitrogen distribution and removal during residue hydrotreating [J]. Petroleum Processing and Petrochemicals, 2007,38(4):43-46.
[15] 耿敬远,刘淑琴,张会成,等. 渣油在加氢处理中的氮分布和氮类型变化[J]. 当代化工,2011,40(6):551-553.
GENG Jingyuan, LIU Shuqin, ZHANG Huicheng,et al. Changes of nitrogen distribution and type in residue during hydrotreating[J]. Contemporary Chemical Industry, 2011,40(6):551-553.

