α-羟基酸立体选择性制备方法研究
黄 净,张晓芳,张虎波,杨毅华,刘守信
(河北科技大学化学与制药工程学院,河北石家庄 050018)
结构简单的光学纯α-羟基酸在自然界的各种植物中广泛存在,而且许多α-羟基酸在有机合成中是有用的合成砌块[1-2]。近年来,文献报道了α-羟基酸作为手性配体应用于有机锌试剂与醛的加成反应,获得高ee值结果[3]。此外,α-羟基酸也作为一种常见的添加剂广泛用于化妆品工业[4-5]。尽管L-α-羟基酸可通过不同方法来合成[6-9], 但最直接、廉价、可靠的合成方法是通过L-α-氨基酸重氮化反应[10],获得高光学纯的产品[11]。但文献所述方法在操作过程中易出现寡聚而导致产率不理想的问题,本文在研究环肽酯[12-13]的合成中,对其进行了改进,收到良好的效果。
本研究选择4种天然氨基酸为原料进行重氮化反应,即L-亮氨酸、L-缬氨酸、L-苯丙氨酸和L-异亮氨酸,立体选择性地制备了(S)-2-羟基-4-甲基戊酸、(S)-2-羟基-3-甲基丁酸、(S)-2-羟基-3-苯基丙酸和(2S, 3S)-2-羟基-3-甲基戊酸,产物结构都经过1H NMR表征,比旋光值与文献报道基本一致。本实验主要在冰盐浴下进行,通过控制NaNO2水溶液的滴加速度,确保反应混合液始终保持温度为0 ~ 5 ℃,考察了NaNO2用量和硫酸浓度对重氮化反应的影响。反应合成路线如图1所示。

图1 L-α-羟基酸的合成路线Fig.1 Synthetic route of L-α-hydroxyl acid
1 实验部分
1.1 主要仪器与试剂
Bruker AV-500 MHz 型核磁共振谱仪,Anton Paar MCP 200 型旋光仪,X4数字显微熔点测定仪。
L-氨基酸,购自河北冀荣氨基酸有限公司;其余所用试剂均为分析纯或化学纯。
1.2 合成方法
取装有温度计的两口圆底烧瓶,在磁力搅拌下加入化学计量的稀硫酸10 mmol (0.5 mol/L,20 mL)和L-氨基酸(10 mmol),待氨基酸全部溶解后置于冰盐浴。于0 ℃条件下,通过恒压滴液漏斗加入NaNO2水溶液20 mmol(2.0 mol/L,10 mL),维持反应温度,直至NaNO2溶液滴加完毕,继续反应8 h。随后撤除冰盐浴,反应液温度自然升至室温并搅拌过夜。用乙酸乙酯反复多次萃取反应液,并用少量蒸馏水洗涤有机相,后经无水Na2SO4干燥、过滤、浓缩即得粗产物。用正己烷-乙酸乙酯进行重结晶,即可获得白色固体。
1.2.1 (L)-2-羟基-3-苯基丙酸(化合物Ⅰ)
氨基酸:L-苯丙氨酸,产率为70.1%(文献值为65%[3]),熔点为124~126 ℃(文献值为123~124 ℃[3])。
1.2.2 (L)-2-羟基-3-甲基丁酸(化合物Ⅱ)
氨基酸:L-缬氨酸,产率为45.5%(文献值为31%[3]),熔点为64~65 ℃(文献值为62~63 ℃[3])。

1.2.3 (2S, 3S)-2-羟基-3-甲基戊酸(化合物Ⅲ)
氨基酸:L-异亮氨酸,产率为46.3%(文献值为52%[3]),熔点为56~57 ℃(文献值为52~54 ℃[3])。

1.2.4 (L)-2-羟基-4-甲基戊酸(化合物Ⅳ)
氨基酸:L-亮氨酸,产率为60.7%(文献值为40%[3]),熔点为83~85 ℃(文献值为78~80 ℃[3])。

2 结果与讨论
2.1 立体选择性反应原理
L-α-氨基酸与亚硝酸反应,首先生成重氮盐,然后羧基氧作为亲核试剂进攻重氮基的碳,发生分子内的双分子亲核取代反应(SN2反应),释放氮气的同时形成α-内酯[14]。随后α-内酯与水再次发生SN2反应,生成L-羟基酸。连续2次SN2反应使原来的构型得以保持[15]。
可能的反应机理如图2所示。
重氮化是整体转化的关键反应。氨基酸与脂肪胺的重氮化反应相似,所用无机酸包括盐酸、硫酸、过氯酸和氟硼酸等。但只有使用共轭碱亲核性差的酸才有利于重氮盐后续反应转化为羟基化物,硫酸是首选。其次,酸的用量和NaNO2用量也是影响反应的主要因素。
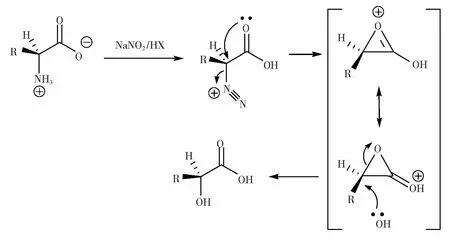
图2 反应机理Fig.2 Reaction mechanism
2.2 NaNO2用量对重氮化反应的影响
实验中通过改变NaNO2的用量来考察对重氮化反应的影响,在其他反应条件不变的前提下,NaNO2的用量对产率的影响见表1。

表1 NaNO2的用量对产率的影响Tab.1 Effect of NaNO2 quantity on the reaction yields
表1数据显示,NaNO2用量增大时,产率保持增大的趋势,说明重氮化反应中使用过量的NaNO2对反应是有利的,但过量达到2倍后,基本保持不变。
2.3 硫酸浓度对重氮化反应的影响
实验中通过改变硫酸的浓度来考察对重氮化反应的影响,在其他反应条件不变的前提下,硫酸浓度对产率的影响见表2。

表2 硫酸浓度的影响Tab.2 Effect of sulfuric acid concentration
由表2可知,当增大硫酸浓度时,反应效果并不理想,所以硫酸浓度以2.0 mol/L较为理想。
2.4 比旋光值
依据反应通法合成的不同化合物,考察立体选择性。比旋光数据显示,所有产物的数据与文献值基本相符,数据见表3。可见,本方法具有较高的立体选择性。
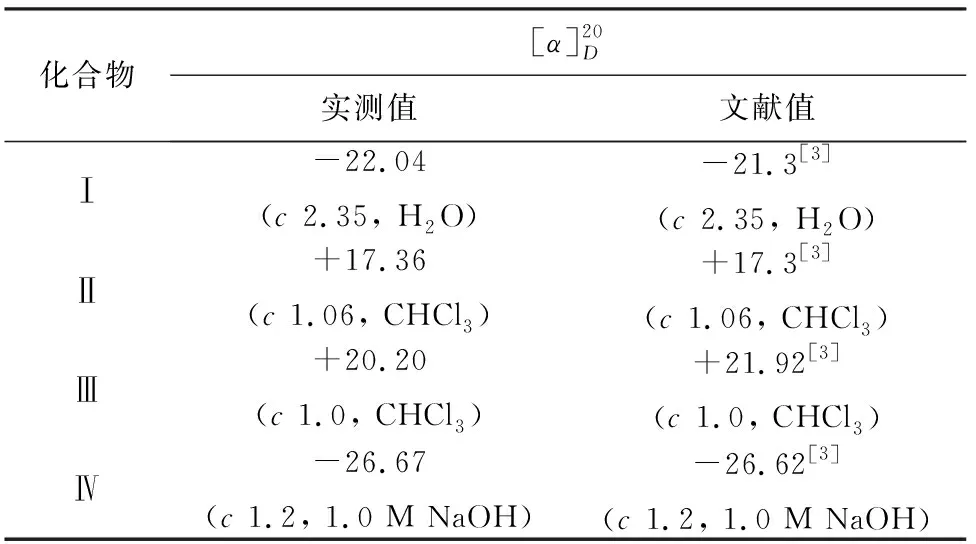
表3 化合物的比旋光值Tab.3 Specific rotation of compounds
3 结 语
以L-亮氨酸、L-缬氨酸、L-苯丙氨酸、L-异亮氨酸、NaNO2和H2SO4为原料,经重氮化反应,立体选择性地制备了相应的α-羟基酸,产率较文献值有明显提高。
参考文献/References:
[1] SHIN I, LEE M, LEE J, et al. Synthesis of optically active phthaloyl d-aminooxy acids fromL-amino acids orL-hydroxy acids as building blocks for the preparation of aminooxy peptide[J]. J Org Chem,2000, 65: 7667-7675.
[2] FRINGUELLI F, PIZZO F, RUCCI M, et al. First one-pot copper-catalyzed synthesis ofα-hydrxy-β-amino acids in water[J]. J Org Chem, 2003, 68: 7041-7045.
[3] BAUER T, GAJEWIAK J.α-Hydroxy carboxylic acids as ligands for enantioselective diethylzinc additions to aromatic and aliphatic aldehydes[J]. Tetrahedron, 2004, 60: 9163-9170.
[4] NAOMI C A, ABRAHAM J D, KATZHENDLER J. New biocompatible polyesters derived fromα-amino acids: Hydrolytic degradation behavior[J]. Polymers, 2010(2): 418-439.
[5] 杨艳伟, 朱 英, 董 兵. 化妆品中α-羟基酸的使用情况分析[J]. 中国卫生检验杂志, 2008, 18(1): 133-134.
YANG Yanwei, ZHU Ying, DONG Bing. Analysis of use ofα-hydroxy acid in cosmetics[J]. Chinese Journal of Health Laboratory Technology, 2008, 18(1): 133-134.
[6] POTERALA M, PLENKIEWICZ J. Synthesis of new chiral ionic liquids fromα-hydroxycarboxylic acids[J]. Tetrahedron Asymmetry, 2011, 22: 294-299.
[7] 葛军英. 手性α-羟基酸的合成[J]. 湖北农业科学, 2011, 50(18):3834-3835.
GE Junying. Synthesis of chiarlα-hydroxy acid[J]. Hubei Agricultural Sciences, 2011, 50(18): 3834-3835.
[8] 吕丹青, 张朝晖, 陈振明.α-羟基酸类物质的酶法还原[J]. 杭州师范大学学报, 2012, 11(1): 33-36.
LYU Danqing, ZHANG Zhaohui, CHEN Zhenming. Enzymatic reduction ofα-hydroxy acids[J]. Journal of Hangzhou Normal University, 2012, 11(1): 33-36.
[9] 赵艳芳, 赵 亮, 张红丽, 等. 以铜(Ⅱ)-L-羟基脯氨酸配合物为手性选择剂的配体交换毛细管区带电泳拆分α-羟基酸[J]. 分析测试学报, 2007, 26(1): 97-99.
ZHAO Yanfang, ZHAO Liang, ZHANG Hongli, et al. Enantiomeric separation ofα-hydroxy acids by Cu(Ⅱ)-L-hydroxy-proline ligand exchange capillary zone electrophoresis[J]. Journal of Instrumental Analysis, 2007, 26(1): 97-99.
[10] AOYAGI Y, JAIN R P, WILLIAMS R M. Stereocontrolled asymmetric synthesis ofα-hydroxy-β-amino acids[J]. J Am Chem Soc,2001, 123: 3472-3477.
[11] MORI K. Synthesis of optically active forms of ipsenol, the pheromone of ips bark beetles[J]. Tetrahedron, 1976, 32: 1101-1106.
[12] SONG H H, LEE H S, LEE C. A new cytotoxic cyclic pentadepsipeptide, neo-N-methylsansalvamide produced byFusariumSolaniKCCM90040, isolated from potato[J]. Food Chemistry, 2011, 126: 472-478.
[13] LIU Shouxin, GU Wenxin, DENISE L.N-methylsansalvamide a peptide analogues, potent new antitumor agents[J]. J Med Chem, 2005, 48: 3630-3638.
[14] DEGERBECK F, FRANSSON B, GREHN L, et al. Synthesis of15N-labelled chiral boc-amino acids from triflates: Enantiomers of leucine and phenylalanine[J]. J Chem Soc,1993(1):11-14.
[15] BREWSTER P, HUGHES E D, INGOLD C K, et al. Configuration of carbohydrates, hydroxy-acids and amino-acids[J]. Nature, 1950, 166:178-179.

