白藜芦醇和紫檀芪体外抗肿瘤转移作用
郭丹丹,陈 姬,于拔萃,张 波,郑秋生
(1.石河子大学药学院药理系,新疆石河子,832002;2.新疆特种植物药资源教育部重点实验室,新疆石河子,832002)
浸润和转移是恶性肿瘤的一个重要特征,也是导致肿瘤患者死亡的主要原因。近年来,恶性黑色素瘤的发病率在世界范围内具有逐步增高的趋势。在我国,虽然恶性黑色素瘤的发病率较低,但预后较差,且极易发生远处转移[1]。因此,在治疗过程中,控制其转移是关键。芪类(stilbenes)物质是一类植物苯丙素次生代谢途径的主要产物,由于其广泛的生物学活性,近年来吸引了众多研究者的关注。白藜芦醇(resveratrol)具有抗菌、抗癌、抗炎、抗过敏、降血脂和抗氧化等多方面的药理活性[2],近年来其抗肿瘤活性受到关注[3-5]。白藜芦醇不仅可以抑制多发性骨髓瘤和宫颈癌等恶性肿瘤细胞基质金属蛋白酶(matrix metalloproteinase,MMP)的表达[6],还可通过激动过氧化物酶体增殖物激活受体减少细胞外MMP诱导因子的表达,抑制肿瘤细胞转移[7]。紫檀芪(pterostilbene)作为白藜芦醇的甲基化衍生物近年来也受到关注,紫檀芪具有和白藜芦醇相似的抗肿瘤活性[8-9]。本研究观察这两种芪类化合物抗肿瘤转移作用并进行比较。
1 材料与方法
1.1 细胞、药物、主要试剂和仪器
小鼠黑色素瘤细胞B16F1和内皮细胞ECV304购于上海生命科学院细胞资源中心。白藜芦醇和紫檀芪(纯度分别为98%和97%)以及胰蛋白酶、磺基罗丹明B和DMSO均购自Sigma公司。RPMI 1640和DMEM细胞培养基购于Gibco公司;新生牛血清和胎牛血清购于杭州四季青生物工程有限公司;Matrigel胶购于美国 BD公司;MMP-2 ELISA试剂盒购于武汉博士德生物工程有限公司;Thermo3131型CO2培养箱和Thermo 3001型多功能酶标仪,美国Thermo公司;ZHJH-112B型超净工作台,上海智诚分析仪器有限公司;MIC00266型荧光倒置显微镜,德国Zeiss公司;H.H.S精密恒温水浴锅,江苏金坛市医疗仪器厂;TGL20M台式高速冷冻离心机,湖南凯达科学仪器有限公司。
1.2 药物配制
以DMSO溶解白藜芦醇和紫檀芪,用无血清RPMI 1640培养基配制白藜芦醇 0.44 mmol·L-1和紫檀芪 0.39 mmol·L-1的贮存液,-4℃避光保存备用。处理细胞时再用RPMI 1640培养液稀释为工作浓度,其中DMSO终浓度小于0.01%。
1.3 磺基罗丹明B染色法测定细胞增殖
取对数生长期的细胞,调整细胞为5×107L-1,按每孔100 μl加于96孔培养板中,于恒温培养箱中孵育24 h。细胞贴壁约80%,每孔分别加入预先配置好的白藜芦醇和紫檀芪溶液100 μl,终浓度均为0,5,10,20,30,40 和50 μmol·L-1,对照组加入等体积含0.01%DMSO的RPMI 1640培养液,每个浓度设6个复孔,继续培养48 h,弃上清,4℃固定1 h,纯水洗涤,每孔加入100 μl磺基罗丹明B染液,静置 20 min,1%乙酸洗涤,每孔再加入DMSO 150 μl,在摇床上震荡混匀,用酶标仪于波长490 nm处检测各孔吸光度(A)值。细胞增殖抑制率(%)=(A对照组-A给药组)/A对照组×100%。
1.4 划痕实验测定细胞迁移能力
白藜芦醇和紫檀芪 10 μmol·L-1对细胞增殖无明显影响。为此选择该浓度观察其抗肿瘤转移和抑制血管新生的作用。划痕后培养基中不含血清,细胞基本不增殖,划痕愈合完全靠细胞的迁移运动,愈合面积代表肿瘤细胞的迁移运动能力。按照Fishman等[10]方法,取对数生长期 B16F1 和ECV304细胞,接种于48孔培养板,至细胞长到90% 融合度,以200 μl Tip头均匀划痕,用含0.1%小牛血清的培养液轻轻洗去脱落细胞,分别加入白藜芦醇和紫檀芪溶液,终浓度为 10 μmol·L-1,5%CO2,37℃孵育48 h至正常组划痕基本愈合。用Zeiss倒置显微镜拍照并分析。以划痕面积为基准,愈合后取与划痕区域相同面积,采用Photoshop 6.0软件分别测定划痕愈合前后的划痕区域灰度值,计算划痕愈合率。划痕愈合率(%)=(0 h划痕区灰度值-48 h划痕区灰度值)/0 h划痕区灰度值×100%。
1.5 明胶酶活性测定法测定MMP-2活性
按照 Lalu等[11]方法测定。取对数生长期B16F1细胞,计数后以相同细胞数接种于培养瓶中,在培养箱中培养24 h,加入预先用无血清RPMI 1640培养基配制的白藜芦醇和紫檀芪溶液,终浓度均为10 μmol·L-1,培养 48 h 后,收集上清液,用考马斯亮蓝法测定上清液中蛋白质浓度,将每组样品稀释至相同蛋白质浓度。制备聚丙烯酰胺凝胶,加样20 μl,于浓缩胶(60 V,40 min)和分离胶(80 V,150 min)电泳。分离胶中约含明胶0.1%。电泳结束后,室温洗涤复性2 h。再于37℃摇床上孵育36 h。孵育结束后,用考马斯亮蓝染色液染色30 min,脱色液脱色至胶条呈蓝色均一背景,亮白色条带。拍照,并用Gel-PRO Analyzer软件(Media Cybernetics,USA)分析相同面积区域的积分灰度值。MMP-2活性用与对照组比较灰度值的百分比表示。
1.6 ELISA测定MMP-2蛋白表达
用MMP-2 ELISA试剂盒测定MMP-2蛋白表达。取对数生长期B16F1细胞,计数后以相同细胞数接种于培养瓶中,在培养箱中培养24 h,加入预先用无血清RPMI 1640培养基配制的白藜芦醇和紫檀芪溶液,终浓度均为 10 μmol·L-1,培养 48 h后,收集上清液,按照试剂盒说明操作,每样品设6个复孔,结果用A450nm表示。
1.7 重建基底膜法测定内皮细胞拟管腔形成
参照 Mezentsev 等[12]方法,将 Matrigel胶 4℃过夜溶解,将 Matrigel胶与预冷的无血清 RPMI 1640培养基1∶5(V/V)混合,用预冷的枪头混匀,加入到24孔培养板,每孔200 μl,置37℃培养箱中30 min促凝,用无血清 RPMI 1640培养液将ECV304 细胞调至1.0 ×105L-1,每孔1.0 ml接种于Matrigel胶层,37℃孵育1 h,用无血清 RPMI 1640培养液洗涤除去未贴壁细胞,加入用无血清RPMI 1640培养基配制的白藜芦醇和紫檀芪溶液,终浓度为10 μmol·L-1,每浓度设 2 个复孔,共同孵育20 h。显微镜观察管腔状结构形成情况并拍照。
1.8 统计学分析
2 结果
2.1 白藜芦醇和紫檀芪对B16F1和ECV304细胞增殖的影响
由图1看出,白藜芦醇与紫檀芪可抑制B16F1和 ECV304 细胞增殖,在 20~50 μmol·L-1浓度范围内紫檀芪对B16F1和ECV304细胞增殖的抑制率高于白藜芦醇(P<0.05,P<0.01)。经计算,作用48 h,白藜芦醇和紫檀芪抑制B16F1细胞增殖的 IC50分别为 119.7 μmol·L-1和 37.3 μmol·L-1,抑制 ECV304 细胞增殖的 IC50分别为72.2 μmol·L-1和37.2 μmol·L-1。
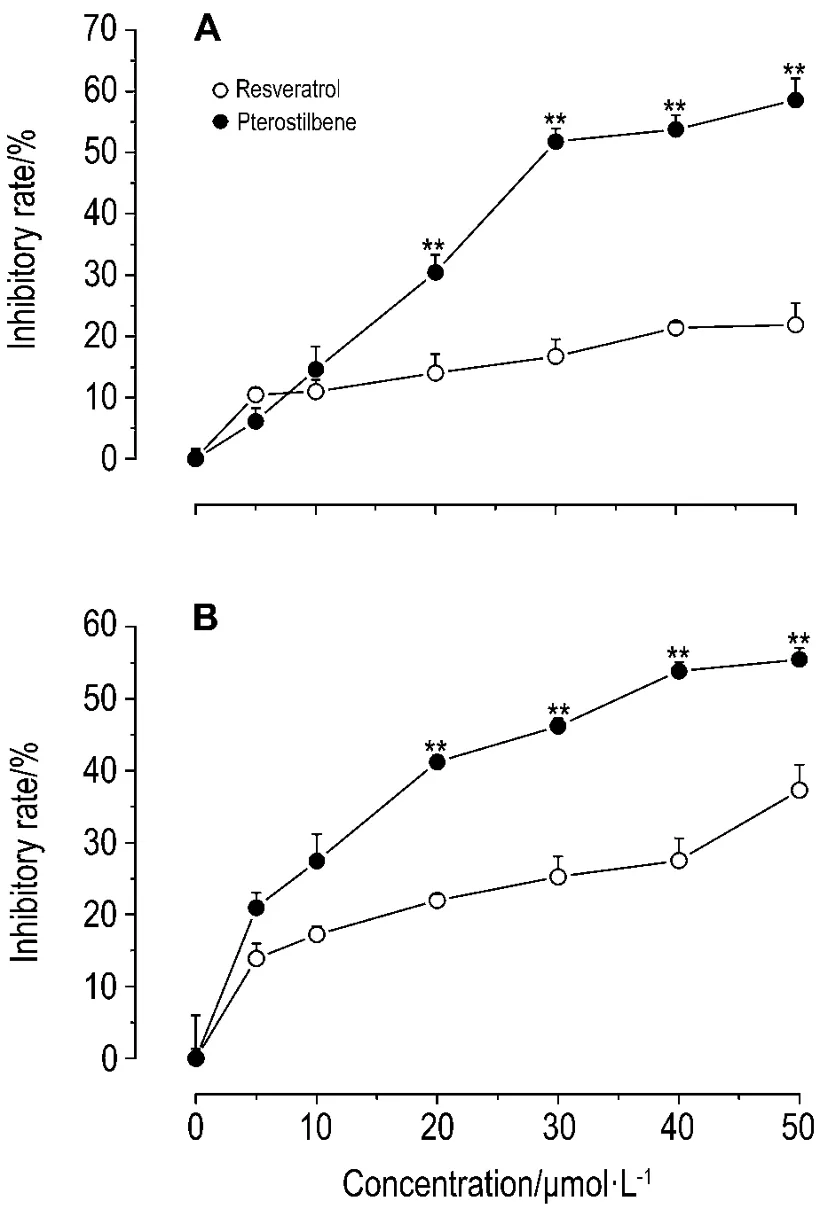
Fig.1 Effect of resveratrol and pterostilbene on proliferation of B16F1(A)and ECV304 cells(B).B16F1 and ECV304 cells were incubated with resveratrol and pterostilbene for 48 h, respectively. The cell proliferation was determined by sulforhodamine B assay.Inhibitory rate(%)=(A490 nmof control group-A490 nmof control group)/A490 nmof control group×100%.±s,n=6.*P<0.05,**P<0.01,compared with the same concentration of resveratrol group.
2.2 白藜芦醇和紫檀芪对B16F1和ECV304细胞迁移能力的影响
与正常对照组相比,白藜芦醇和紫檀芪10 μmol·L-1均可降低 B16F1 和ECV304 细胞的划痕愈合率(P<0.05,P<0.01);对于同一种细胞,紫檀芪的抑制作用强于白藜芦醇(P<0.01)。图2和图3结果表明,白藜芦醇和紫檀芪均可降低B16F1和ECV304细胞的体外迁移能力,而且同浓度下紫檀芪抑制细胞迁移的能力明显强于白藜芦醇。
2.3 白藜芦醇和紫檀芪对B16F1细胞MMP-2活性的影响

Fig.2 Inhibition of resveratrol and pterostilbene on migration of B16F1 cells in vitro.A:confluent monolayers of cells were wounded with a uniform scratch,rinsed to remove debris,and incubated with resveratrol or pterostilbene 10 μmol·L -1for 48 h.Photographs were monitored by ZEISS microscope(×100).a1,a2 and a3:normal control,resveratrol and pterostilbene groups before incubation;a4,a5 and a6:normal control,resveratrol and pterostilbene groups incubated for 48 h.B:semi-quantitative result of wound closure ability.Relative wound closure ability was determined by measuring the greyscale of the wounds.Wound closure rate(%)=(wound district grey value at 0 hwound district grey value at 48 h)/wound district grey value at 0 h×100%.±s,n=6.**P<0.01,compared with normal control group;##P<0.01,compared with resveratrol group.
图4 结果显示,与正常对照组比较,白藜芦醇和紫檀芪 10 μmol·L-1与 B16F1 细 胞 作 用 48 h MMP-2活性明显降低(P<0.01),紫檀芪比白藜芦醇降低更为明显(P<0.01),表明白藜芦醇和紫檀芪可降低B16F1细胞分泌MMP-2的活性,且紫檀芪明显强于白藜芦醇。

Fig.3 Inhibition of resveratrol and pterostilbene on migration of ECV304 cells in vitro.See Fig.2 for the cell treatment.a1,a2 and a3:normal control,resveratrol and pterostilbene groups before incubation;a4,a5 and a6:normal control,resveratrol and pterostilbene groups incubated for 48 h.±s,n=6.*P<0.05,**P<0.01,compared with normal control group;##P<0.01,compared with resveratrol group.
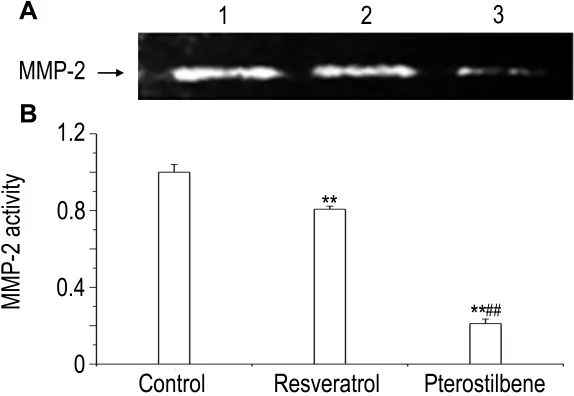
Fig.4 Effect of resveratrol and pterostilbene on matrix metalloproteinase-2(MMP-2)activity of B16F1 cells.See Fig.2 for the cell treatment.MMP-2 activity was determined by gelatin zymography(A).Lane 1:control group;lane 2:reveratrol group;lane 3:pterostilbene group.B was the semi-quantitative result of A.MMP-2 activity was expressed as the percentage of grey value to the control group(B).±s,n=6.**P<0.01,compared with normal control group;##P<0.01,compared with resveratrol group.
2.4 白藜芦醇和紫檀芪对B16F1细胞MMP-2表达的影响
MMP-2 ELISA检测结果(图5)表明,与正常对照组比较,白藜芦醇和紫檀芪 10 μmol·L-1可降低B16F1细胞MMP-2表达(P<0.01),紫檀芪的作用强于白藜芦醇(P<0.01)。
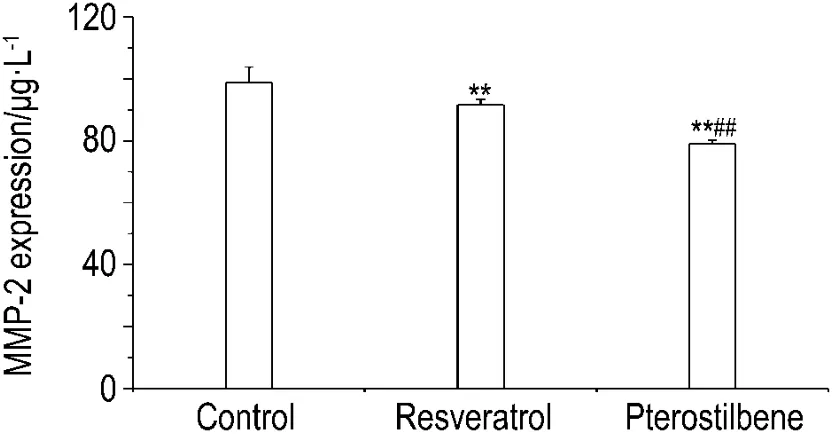
Fig.5 Effect of resveratrol and pterostilbene on MMP-2 expression of B16F1 cells.See Fig.2 for the cell treatment.MMP-2 expression was detected by ELISA kit.±s,n=6.**P<0.01,compared with normal control group;##P<0.01,compared with resveratrol group.
2.5 紫檀芪和白藜芦醇对ECV304细胞拟管腔结构形成的影响

Fig.6 Effect of resveratrol and pterostilbene on tube formation of ECV304 cells in vitro(40×).A:control group;B:resveratrol 10 μmol·L-1for 24 h;C:pterostilbene 10 μmol·L-1for 24 h.
图6 结果表明,正常对照组内皮细胞ECV304可在Matrigel胶重建的基底膜上形成完整的拟管腔状结构(图6A);白藜芦醇 10 μmol·L-1组 ECV304 细胞拉伸程度降低,彼此间连接缝隙变大,部分管腔状结构的完整性被破坏(图 6B);紫檀芪 10 μmol·L-1组ECV304细胞连接处已经逐渐变圆,管腔状结构已经完全被破坏(图6C)。表明白藜芦醇和紫檀芪均能有效抑制内皮细胞拟管腔样结构的形成,且紫檀芪的抑制强于白藜芦醇。
3 讨论
本研究结果表明,白藜芦醇与紫檀芪20~50 μmol·L-1作用 48 h 可抑制 B16F1 和 ECV304细胞增殖。在相同浓度条件下,紫檀芪对B16F1和ECV304细胞增殖的抑制率高于白藜芦醇。
浸润和侵袭是恶性肿瘤转移的前提,MMP是肿瘤细胞降解基底膜的重要成分,高侵袭转移潜能的肿瘤细胞其MMP mRNA和蛋白均高水平表达,而且高转移肿瘤细胞诱导宿主间质细胞产生MMP的能力远远大于低转移肿瘤细胞,在参与破坏基底膜的MMP中,相对分子质量为72×103的MMP-2与肿瘤细胞的侵袭和转移关系密切,MMP-2表达增加能促进细胞的侵袭能力[13]。明胶酶谱法和ELISA实验结果表明,白藜芦醇和紫檀芪可降低肿瘤细胞分泌的MMP-2活性和表达。划痕实验发现,处理后的肿瘤细胞迁移能力也明显受到抑制。由此提示,白藜芦醇和紫檀芪均具有明显抑制B16F1和ECV304细胞迁移的能力,提示芪类物质有潜在的抗肿瘤转移活性成分。
另一方面,肿瘤转移过程,不单单是肿瘤细胞自身特性发生变化,还依赖于肿瘤细胞与间质细胞以及细胞微环境之间的相互作用。除了肿瘤细胞本身的运动性,还有肿瘤细胞与毛细血管内皮细胞等因素均可影响肿瘤细胞转移。越来越多的研究表明,血管新生不仅在肿瘤生长和转移中发挥重要作用,而且肿瘤内新生血管也能成为判断肿瘤预后的独立指标[14-15]。白藜芦醇和紫檀芪均能抑制内皮细胞的生长和迁移,同时对内皮细胞拟管腔结构形成有抑制作用,且紫檀芪的作用优于白藜芦醇。上述结果提示,白藜芦醇和紫檀芪具有抗肿瘤转移作用,相同浓度条件下紫檀芪的作用高于白藜芦醇。
[1]O'Day SJ,Kim CJ,Reintgen DS.Metastatic melanoma:chemotherapy to biochemotherapy[J].Cancer Control,2002,9(1):31-38.
[2]Baur JA,Sinclair DA.Therapeutic potential of resveratrol:the in vivo evidence[J].Nat Rev Drug Discov,2006,5(6):493-506.
[3]Burns J,Yokota T,Ashihara H,Lean ME,Crozier A.Plant foods and herbal sources of resveratrol[J].J Agric Food Chem,2002,50(11):3337-3340.
[4]Jang M,Cai L,Udeani GO,Slowing KV,Thomas CF,Beecher CW,et al.Cancer chemopreventive activity of resveratrol,a natural product derived from grapes[J].Science,1997,275(5297):218-220.
[5]Clément MV,Hirpara JL,Chawdhury SH,Pervaiz S.Chemopreventive agent resveratrol,a natural product derived from grapes,triggers CD95 signaling-dependent apoptosis in human tumor cells[J].Blood,1998,92(3):996-1002.
[6]Woo JH,Lim JH,Kim YH,Suh SI,Min DS,Chang JS,et al.Resveratrol inhibits phorbol myristate acetate-induced matrix metalloproteinase-9 expression by inhibiting JNK and PKC delta signal transduction[J].Oncogene,2004,23(10):1845-1853.
[7]Tang Y,Kesavan P,Nakada MT,Yan L.Tumor-stroma interaction:positive feedback regulation of extracellular matrix metalloproteinase inducer(EMMPRIN)expression and matrix metalloproteinase-dependent generation of soluble EMMPRIN[J].Mol Cancer Res,2004,2(2):73-80.
[8]Li Z,Zhan W,Wang Z,Zhu B,He Y,Peng J,et al.Inhibition of PRL-3 gene expression in gastric cancer cell line SGC7901 via microRNA suppressed reduces peritoneal metastasis[J].Biochem Biophys Res Commun,2006,348(1):229-237.
[9]Rimando AM,Cuendet M,Desmarchelier C,Mehta RG,Pezzuto JM,Duke SO.Cancer chemopreventive and antioxidant activities of pterostilbene,a naturally occurring analogue of resveratrol[J].J Agric Food Chem,2002,50(12):3453-3457.
[10]Fishman DA, Kearns A, Chilukuri K, Bafetti LM,O'Toole EA,Georgacopoulos J,et al.Metastatic dissemination of human ovarian epithelial carcinoma is promoted by alpha2beta1-integrin-mediated interaction with typeⅠcollagen[J].Invasion Metastasis,1998,18(1):15-26.
[11]Lalu MM,Csonka C,Giricz Z,Csont T,Schulz R,Ferdinandy P.Preconditioning decreases ischemia/reperfusioninduced release and activation of matrix metalloproteinase-2[J].Biochem Biophys Res Commun,2002,296(4):937-941.
[12]Mezentsev A,Seta F,Dunn MW,Ono N,Falck JR,Laniado-Schwartzman M.Eicosanoid regulation of vascular endothelial growth factor expression and angiogenesis in microvessel endothelial cells[J].J Biol Chem,2002,277(21):18670-18676.
[13]Egeblad M,Werb Z.New functions for the matrix metalloproteinases in cancer progression[J].Nat Rev Cancer,2002,2(3):161-174.
[14]Bamias A,Dimopoulos MA.Angiogenesis in human cancer:implications in cancer therapy[J].Eur J Intern Med,2003,14(8):459-469.
[15]Kubota Y,Kleinman HK,Martin GR,Lawley TJ.Role of laminin and basement membrane in the morphological differentiation of human endothelial cells into capillary-like structures[J].J Cell Biol,1988,107(4):1589-1598.

