磷酸二酯酶4B在博来霉素诱导的肺纤维化小鼠肺组织中的表达与作用
李金优,宋顺德,毛连根,曾豆豆,史建蓉,陈季强,李子刚,汤慧芳
(浙江大学医学院1.浙江省呼吸药物研究实验室,2.国家理科基地,浙江杭州 310058;3.附属儿童医院,浙江杭州 310003;4.附属妇产科医院,浙江杭州 310000)
特发性肺纤维化以弥漫性肺泡炎和肺泡结构紊乱导致肺间质纤维化为特征,这种实质病变具有不可逆性和严重的致死率,曾被认为是一种慢性炎症过程。但目前研究表明,纤维化的反应是由异常激活的肺泡上皮细胞驱动,这些细胞产生的介质通过肺部间质细胞的增殖,诱导成纤维细胞和成肌纤维细胞灶形成,吸引循环纤维细胞,诱导上皮间质转化。成纤维细胞和肌成纤维细胞灶分泌过量的细胞外基质,以胶原纤维为主,造成瘢痕和肺结构的破坏[1]。目前尚无有效的治疗手段阻止或逆转纤维化的过程。因此,寻找在上皮损伤过度修复过程中发挥作用的药物,成为探索阻止和逆转肺纤维化过程的关键。
磷酸二酯酶(phosphodiesterases,PDE)是细胞内第二信使cAMP和cGMP的水解酶,可维持细胞内第二信使浓度平衡,在信号传递过程中发挥重要作用。在肺部疾病中,PDE4是目前关注较多的一个亚型,PDE4有A,B,C和D 4个亚型,其中PDE4B亚型因在炎症细胞和组织中表达较广泛而倍受关注[2-3]。据报道,PDE4抑制剂对博来霉素(bleomycin)诱导的肺纤维化模型小鼠有治疗作用[4-5],但由于目前PDE4抑制剂的亚型选择性不强,究竟是何种PDE4亚型在起作用尚不清楚。本研究采用博来霉素诱导的肺纤维化小鼠模型,研究PDE4B mRNA和蛋白表达在纤维化形成不同时期的变化,同时检测转化 生 长 因 子 β1(transforming growth factor-β1,TGF-β1)、白细胞介素 6(interleukin-6,IL-6)、巨噬细胞炎症蛋白2(macrophage inflammatory protein 2,MIP-2)和IL-1β等的分泌,以期阐明PDE4B亚型在肺纤维化过程中所发挥的作用,为临床治疗提供依据。
1 材料与方法
1.1 动物、药品、试剂和仪器
C57BL/6J小鼠,雄性,7~8周,体质量20~22 g,由浙江大学动物实验中心提供,动物合格证号:2007000526749。博来霉素,日本化药株式会社;实时PCR相关试剂包括dNTP混合物、Oligo(dT)18引物、RNA酶抑制剂、M-MLV逆转录酶和 SYBR Rremix Ex TaqTM,宝生物工程(大连)有限公司;胶原含量测定试剂盒,英国Biocolor公司;小鼠TGF-β1和MIP-2 ELISA试剂盒,武汉博士德生物工程有限公司;髓过氧化物酶(myeloperoxidase,MPO)活性测定试剂盒,南京建成生物工程有限公司;小鼠β肌动蛋白和PDE4B引物,上海生工生物工程有限公司合成;IL-6和 IL-1β ELISA试剂盒,美国 R&D Systems公司。CFX96型荧光定量PCR仪,Bio-Rad公司;CM 1850型冰冻切片机,德国Leica公司。
1.2 模型制备和分组
采用4%水合氯醛280 mg·kg-1麻醉小鼠,有创气道给药法滴入生理盐水配制的博来霉素2.5 mg·kg-1。正常对照组滴入等体积的生理盐水。给予博来霉素后第3,7,14,21和28天处死小鼠,分不同批次进行支气管肺泡灌洗,留取肺泡灌洗液(bronchoalveolar lavage fluid,BALF)并留取肺组织。
1.3 肺组织病理学观察
小鼠股动脉放血处死后,留取肺组织用4%甲醛固定,制备石蜡切片,进行Masson染色,观察肺组织纤维化改变,以确定造模是否成功。Masson染色呈蓝色的即沉积的胶原纤维。
1.4 BALF收集和处理
取1 ml生理盐水灌洗肺组织得到BALF,混匀后取50 μl用于白细胞计数,余下以500×g离心5 min,取上清液分装,冻存于 -80℃,余下30 μl小心吹匀沉积细胞,均匀涂片,晾干并固定,瑞氏吉姆萨染色,高倍镜下计数200个白细胞中中性粒细胞、巨噬细胞和淋巴细胞的数目。
1.5 ELISA测定BALF中炎症因子含量
取BALF上清液按照ELISA试剂盒说明书测定 TGF-β1,IL-6 和 MIP-2 含量。
1.6 肺组织MPO活性和胶原蛋白含量测定
右肺组织用生理盐水制备成10%的组织匀浆,取450 μl测定 MPO活性,剩余匀浆于12000×g离心10 min取上清,按照试剂盒说明书测定胶原含量,并取5 μl上清液进行总蛋白含量测定。MPO和胶原含量测定结果皆为上清液每克总蛋白中的MPO活性和胶原含量。
1.7 实时荧光定量PCR测定肺组织中PDE4B mRNA表达
取液氮固定的左肺组织加入1 ml Trizol于冰浴中匀浆,提取总RNA,逆转录合成cDNA,于-20℃保存。以cDNA为模板,用PDE4B引物进行实时荧光定量PCR扩增,内参照为β肌动蛋白。小鼠 β肌动蛋白引物,上游(5'-3'):GATTACTGCTCTGGCTCCTAGC;下游(5'-3'):GACTCATCGTACTCCTGCTTGC。小鼠 PDE4B引物,上游(5'-3'):CCAGTTCCTGTTATCTTC;下游(5'-3'):TCGCAACATGGTACACTG。扩增条件为:95℃10 s,48.9℃30 s,72℃45 s,40 个循环。以β肌动蛋白作为内参照,目的基因的表达用相对定量法计算,即目的基因2-ΔCt/β 肌动蛋白2-ΔCt,其中Ct值是PCR扩增过程中荧光信号强度达到阈值所需要的循环数,可通过GeneAmp5700基因序列分析软件读出并计算,ΔCt=Ct的平均值-中间值。
1.8 免疫组化法检测PDE4B蛋白分布
冰冻组织包埋后,切成4 μm切片,室温30 min后用丙酮固定10 min,PBS清洗,用3%H2O2去除内源性过氧化氢酶。用PBS小心洗5次后使用兔抗PDE4B多克隆抗体4℃孵育过夜,阴性对照组用PBS代替一抗。PBS清洗5次去除抗体,5%BSA封闭10 min。PBS清洗后加入二抗,室温孵育30 min,PBS清洗后加入DAB显色10 min,清洗后加入苏木精染色5 min,PBS清洗后浸入无水乙醇脱水,二甲苯透明,中性树脂封片,于显微镜下观察并拍片,PDE4B阳性部分显色为棕色。应用Image-Pro Plus图像分析软件进行分析,选择测量积分吸光度(integrated absorbance,IA)。每组6张切片,每张切片随机选取10个区域,每个高倍镜视野测5个IA,每组有300个平均IA值。
1.9 统计学分析
2 结果
2.1 博来霉素刺激后肺组织的病理变化
图1显示博来霉素诱导致肺组织气道重塑和纤维化过程。正常对照组小鼠肺组织肺泡结构清晰且完整,无炎症细胞浸润(图1A)。模型组小鼠在纤维化早期(第7天),主要表现为炎症细胞浸润,气道上皮细胞排列不规则并脱落,肺泡结构少量破坏(图1C);第14天胶原开始形成,并沉积于气道附近(图1D);在纤维化后期(第21天和第28天),间质细胞大量增殖,胶原大量沉积,肺泡组织结构被严重破坏,间隔消失形成空洞(图1E,F)。上述变化提示肺纤维化模型制备成功。
2.2 博来霉素刺激后小鼠肺组织BALF中白细胞总数和分类的变化
表1为博来霉素刺激后第3,7,14,21和28天小鼠BALF中白细胞总数及中性粒细胞、淋巴细胞和巨噬细胞数目。可以看出,博来霉素刺激后第3天白细胞总数及中性粒细胞、淋巴细胞和巨噬细胞数目均达到峰值,随后逐渐回落。
2.3 博来霉素刺激后BALF中炎症因子MIP-2,IL-6,IL-1β和 TGF-β1含量的变化
由表2看出,与正常对照组比较,IL-1β在博来霉素刺激后快速升高(P<0.01),第3天达到峰值,之后逐渐回落接近正常水平;IL-6也快速升高(P<0.01),在第3天达到峰值,随后快速回落;MIP-2则随着时间延长逐渐增加,第28天是对照组的173%(P<0.01);TGF-β1在第7天达峰值之后逐渐回落。
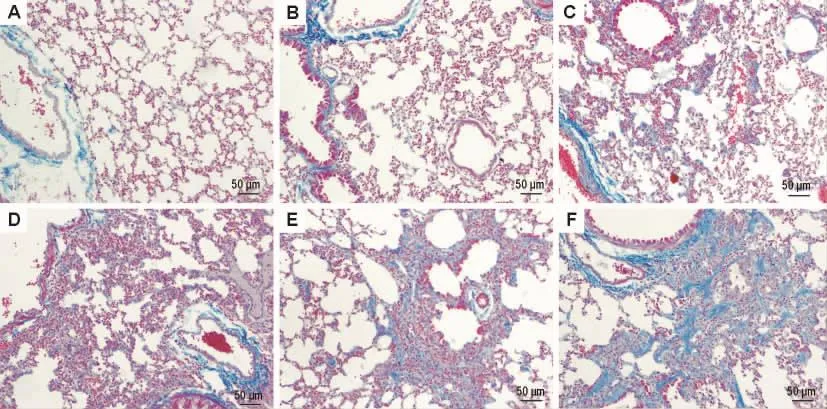
Fig.1 Bleomycin-induced histopathological changes in lung tissue of mice(Masson staining).On the 3rd,7th,14th,21st and 28th days after the mice were intratracheal instillated bleomycin 2.5 mg·kg -1,the histopathological changes in lung tissue were observed to evaluate lung injury.A:normal group;B -F:3,7,14,21 and 28 d groups,respectively.

Tab.1 Bleomycin-induced changes of total leukocyte and differential cell counts in bronchoalveolar lavage fluid(BALF)of mice
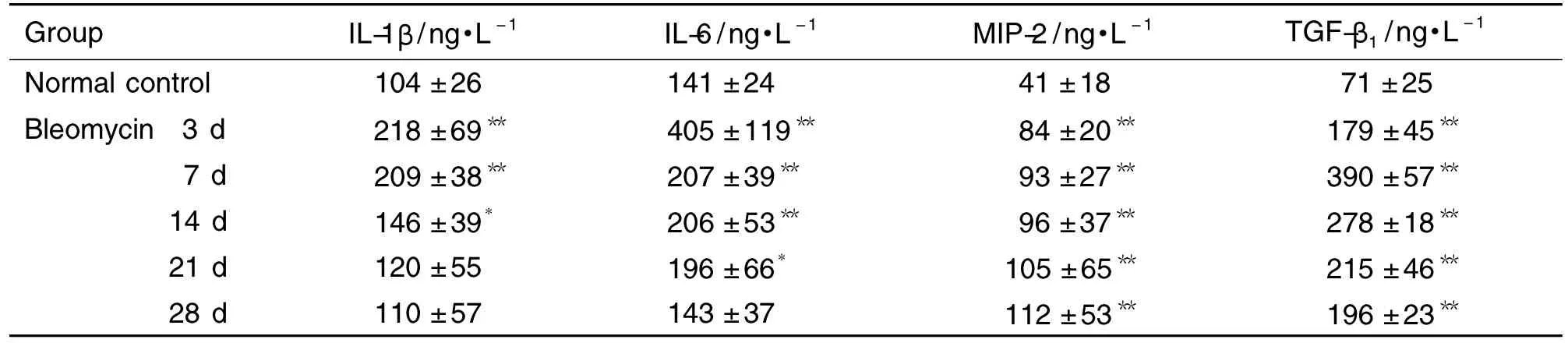
Tab.2 Bleomycin-induced changes of interleukin-1β (IL-1β),IL-6,macrophage inflammatory protein-2(MIP-2)and transforming growth factor-β1(TGF-β1)in BALF of mice
2.4 博来霉素刺激后肺组织MPO活性和胶原蛋白含量的变化
由表3看出,与正常对照组比较,博来霉素刺激后肺组织胶原蛋白含量第3天即开始升高(P<0.05),第28天达峰值;肺组织中MPO活性在第3天亦快速升高(P<0.01),第14天达峰值,随后下降,第28天下降至正常水平。
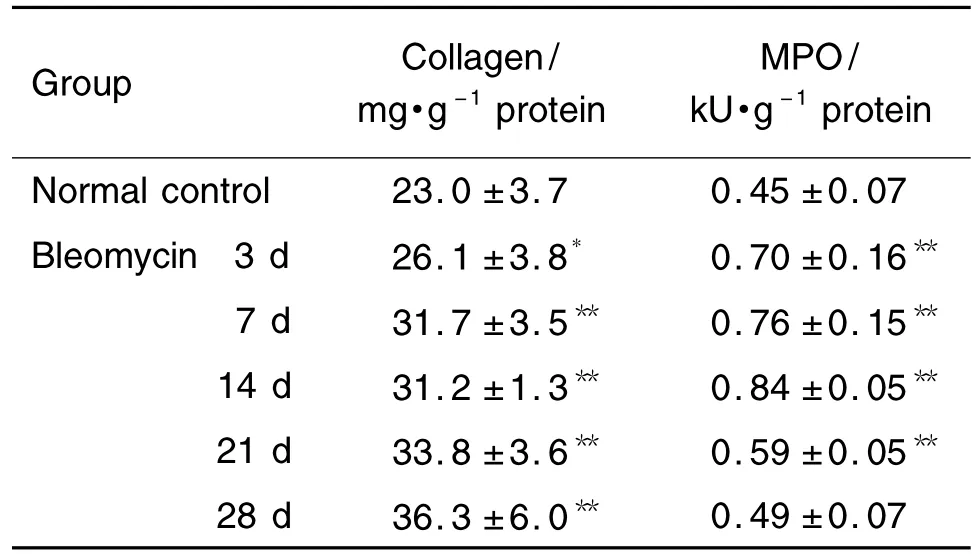
Tab.3 Bleomycin-induced changes of myeloperoxidase(MPO)activity and collagen level in lung tissue of mice
2.5 博来霉素刺激后肺组织中PDE4B mRNA表达的变化
由表4看出,博来霉素刺激后第14天肺组织中PDE4B mRNA表达与正常对照组比较明显增加(P<0.05),第28天达峰值(P<0.01)。与肺纤维化的发展趋势相符。
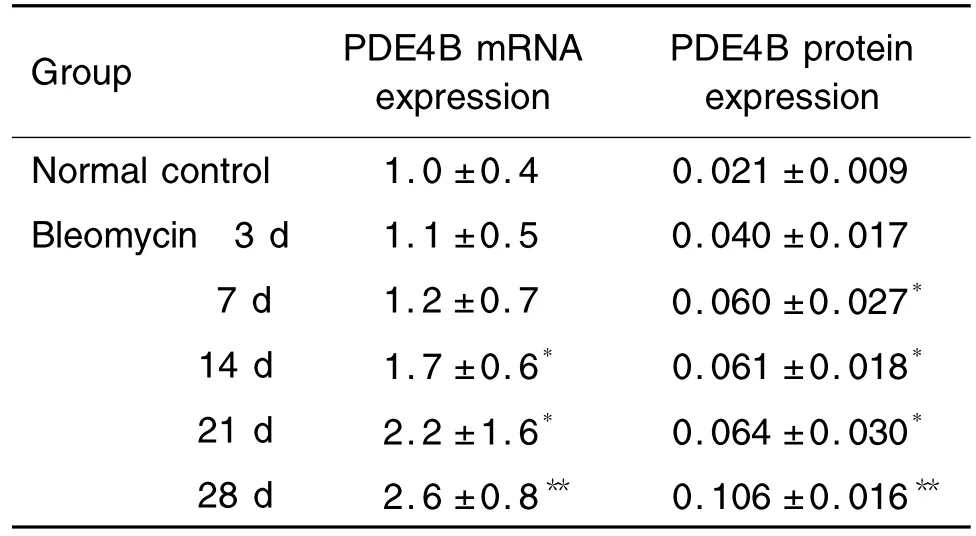
Tab.4 Bleomycin-induced changes of phosphodiesterase 4B(PDE4B)mRNA and protein expression in lung tissue of mice
2.6 博来霉素刺激后肺组织中PDE4B蛋白表达的变化和分布
PDE4B主要在炎症细胞的胞浆内表达。由图2看出,正常对照组小鼠肺中中性粒细胞和巨噬细胞等炎症细胞较少(图2A);博来霉素刺激后第3天小鼠肺中表达PDE4B的炎症细胞明显增多(图2B),第7和14天炎症细胞进一步聚集,并且肺泡上皮细胞中PDE4B也开始表达(图2C,D)。随着纤维化程度加深,这一趋势明显增加。第21和28天肺内炎症细胞减少,但肺间质表达增加(图2E,F),提示PDE4B不仅在肺纤维早期的炎症细胞表达,在后期纤维化肺间质也有大量表达。PDE4B蛋白表达增高的趋势与mRNA表达趋势相符。由表4看出,与正常对照组比较,博来霉素刺激后第7天PDE4B蛋白表达明显增加(P<0.05),第28天增加更为明显 (P<0.01)。
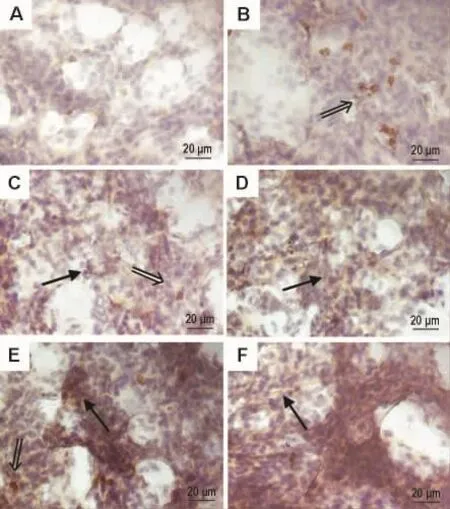
Fig.2 Changes of PDE4B protein expression induced by bleomycin in lung tissue of mice(Immunostaining).SeeFig.1 for the mouse treatments.A:normal group;B - F:3,7,14,21 and 28 d groups,respectively.⇑:inflammatory cells;↑:lung interstitial cells.
3 讨论
PDE4B是主要的 PDE4形式[6],存在于人单核细胞和中性粒细胞,可由脂多糖特异性的诱导表达[7],涉及Toll受体信号、脂多糖诱导的单核细胞和巨噬细胞肿瘤坏死因子的分泌、T细胞的活化及Th2细胞因子的产生[8-10]。博来霉素诱导的纤维化与特发性肺纤维化的病理变化相似,是目前应用最广泛的肺纤维化模型,博来霉素用药后第14~28天形成肺纤维化[11]。据报道,PDE4抑制剂可以减轻博来霉素导致的肺纤维化[4-5]。但有趣的是罗氟司特可以降低胶原Ⅰ型的转录,而西洛司特则不能。这是由PDE4抑制剂对亚型的选择性差异所致。因此,研究此模型PDE4亚型的表达有重要意义。
本研究发现,博来霉素刺激后第7天,肺组织内聚集大量炎症细胞,肺泡结构少量破坏;第14天肺泡炎症细胞浸润,大量巨噬细胞和淋巴细胞聚集并释放到肺泡腔,胶原沉积于肺泡间质,表明本研究肺纤维化模型制备成功。BALF中白细胞总数及中性粒细胞、淋巴细胞和巨噬细胞数目在博来霉素刺激后第3天达到峰值,之后逐渐减少,其中以巨噬细胞为主。在这个过程中,大量的信号因子被释放出来,诱导肺泡上皮细胞的迁移与增殖。本研究显示多种细胞因子参与此过程,IL-1β和IL-6在给药后第3天达峰值,TGF-β1在给药后第7天达峰值,而MIP-2则呈持续性增长。其中IL-1β主要源于巨噬细胞、单核细胞和上皮细胞,是导致纤维化的主要前炎症因子之一,IL-1β导致肺泡损伤,促进间质损伤的修复导致的肺损伤和肺纤维化过程中有重要作用,参与 MIP-1α 等多种细胞因子的应答[13]。TGF-β1是主要导致纤维化的细胞因子,可直接作用于成纤维细胞,主要由巨噬细胞分泌[14]。而MIP-2与肺纤维化的形成和血管形成有关[15]。
本研究发现,PDE4B表达在小鼠肺纤维化形成过程中有逐渐升高的趋势。博来霉素刺激后第14天PDE4B mRNA表达增加,第28天达最高值。PDE4B在前期炎症反应中主要在炎症细胞中表达增加,第14天后炎症细胞进一步聚集,并且肺泡上皮细胞中PDE4B也开始表达,随着纤维化程度加深,这一趋势明显增加。在博来霉素引起的肺纤维化过程中,PDE4B mRNA表达的变化趋势与肺纤维化程度加深相符,与胶原蛋白沉积和BALF中MIP-2含量的升高等的变化趋势一致。由此提示,PDE4B的表达增加不仅在肺纤维早期炎症反应的信号通路中发挥重要作用,在肺纤维化过程后期也可能扮演着重要角色。
综上所述,PDE4B在博来霉素诱导的小鼠纤维化肺组织中高表达,提示其可能是一个较好的抗肺纤维化药物的研究靶点。
[1]King TE Jr,Pardo A,Selman M.Idiopathic pulmonary fibrosis[J].Lancet,2011,378(9807):1949-1961.
[2]Conti M,Beavo J.Biochemistry and physiology of cyclic nucleotide phosphodiesterases:essential components in cyclic nucleotide signaling[J].Annu Rev Biochem,2007,76:481-511.
[3]Spina D. PDE4 inhibitors:current status[J].Br J Pharmacol,2008,155(3):308-315.
[4]Cortijo J,Iranzo A,Milara X,Mata M,Cerdá-Nicolás M,Ruiz-Saurí A,et al.Roflumilast,a phosphodiesterase 4 inhibitor,alleviates bleomycin-induced lung injury[J].Br J Pharmacol,2009,156(3):534-544.
[5]Udalov S,Dumitrascu R,Pullamsetti SS,Al-tamari HM,Weissmann N,Ghofrani HA,et al.Effects of phosphodiesterase 4 inhibition on bleomycin-induced pulmonary fibrosis in mice[J].BMC Pulm Med,2010,10:26.
[6]Wang P,Wu P,Ohleth KM,Egan RW,Billah MM.Phosphodiesterase 4B2 is the predominant phosphodiesterase species and undergoes differential regulation of gene expression in human monocytes and neutrophils[J].Mol Pharmacol,1999,56(1):170-174.
[7]Ma D,Wu P,Egan RW,Billah MM,Wang P.Phosphodiesterase 4B gene transcription is activated by lipopolysaccharide and inhibited by interleukin-10 in human monocytes[J].Mol Pharmacol,1999,55(1):50-57.
[8]Jin SL, Conti M. Induction ofthe cyclic nucleotide phosphodiesterase PDE4B is essential for LPS-activated TNF-alpha responses[J].Proc Natl Acad Sci USA,2002,99(11):7628-7633.
[9]Jin SL,Goya S,Nakae S,Wang D,Bruss M,Hou C,et al.Phosphodiesterase 4B is essential for T(H)2-cell function and development of airway hyperresponsiveness in allergic asthma[J].J Allergy Clin Immunol,2010,126(6):1252-1259.e12.
[10]Ariga M,Neitzert B,Nakae S,Mottin G,Bertrand C,Pruniaux MP,et al.Nonredundant function of phosphodiesterases 4D and 4B in neutrophil recruitment to the site of inflammation[J].J Immunol,2004,173(12):7531-7538.
[11]Moore BB,Hogaboam CM.Murine models of pulmonary fibrosis[J].Am J Physiol Lung Cell Mol Physiol,2008,294(2):L152-L160.
[12]Wilson MS,Madala SK,Ramalingam TR,Gochuico BR,Rosas IO,Cheever AW,et al.Bleomycin and IL-1betamediated pulmonary fibrosis is IL-17A dependent[J].J Exp Med,2010,207(3):535-552.
[13]Saito F,Tasaka S,Inoue K,Miyamoto K,Nakano Y,Ogawa Y,et al.Role of interleukin-6 in bleomycin-induced lung inflammatory changes in mice[J].Am J Respir Cell Mol Biol,2008,38(5):566-571.
[14]Coker RK,Laurent GJ.Pulmonary fibrosis:cytokines in the balance[J].Eur Respir J,1998,11(6):1218-1221.
[15]Keane MP,Belperio JA,Moore TA,Moore BB,Arenberg DA,Smith RE,et al.Neutralization of the CXC chemokine,macrophage inflammatory protein-2,attenuates bleomycin-induced pulmonary fibrosis[J].J Immunol,1999,162(9):5511-5518.

