白藜芦醇通过上调小鼠胚胎干细胞过氧化物酶体增殖激活受体γ共激活子1α表达促进其分化为心肌细胞
方海琴,赵 君,崔亚雄,袁海涛,杨 嵘,荣 靖,赵增明,何 俊,彭双清
(1.军事医学科学院疾病预防控制研究所毒理学评价研究中心,北京 100071;2.国家食品安全风险评估中心卫生部食品安全风险评估重点实验室,北京 100021)
胚胎干细胞(embryonic stem cells,ESC)是一类源于囊胚时期内细胞团的特定细胞群,具有分化为体内3个胚层来源的各种类型组织细胞的潜能。近年来,ESC定向诱导分化为心肌细胞研究成为国内外研究人员共同关注的热点之一,获得足量、均一、高纯度、不引起免疫排斥反应且具有再生能力的心肌细胞为心脏疾病的治疗带来了新的希望。动物实验证实,ESC源的心肌细胞能代替缺失或受损的心肌细胞以恢复和改善心脏功能[1-2]。
研究发现,小鼠ESC能够通过悬浮培养形成胚体(embryonicbody,EB),这些EB可进一步分化为心肌细胞,通过光学显微镜即可观察到这些由ESC分化而来的心肌细胞的自发性收缩。进一步研究显示,这一体外分化过程再现了心脏发生和心肌收缩发育的过程[3]。基于化合物对ESC的细胞毒性与对ESC分化为心肌细胞的抑制能力的测试,2001年欧洲替代方法验证中心(European Centre for the Validation of Alternative Methods,ECVAM)接受并批准小鼠ESC实验(embryonic stem cell test,EST)用于化合物胚胎发育毒性评价,ECVAM的EST操作流程也成为目前ESC分化为心肌细胞的标准操作规程[4-5]。但此操作规程是在ESC细胞自发分化的基础上制订,并未探讨如何获得足量、均一、高纯度的心肌细胞。因此,按照EST的操作规程,ESC自发向心肌细胞分化的效率并不高,且ESC细胞分化为心肌细胞是一个渐进和复杂的过程,目前对于ESC诱导分化准确的调控机制尚不清楚。为了提高 ESC 的心肌分化效率,人们纷纷采用改变分化培养条件,在不同时间点添加不同药物等方法,但只有准确掌握其诱导分化的机制,才有可能在分子水平上精确诱导ESC分化为所需的心肌细胞,消除一些不利因素[6]。
有研究表明,线粒体的生物合成对ESC向心肌细胞分化起正向促进作用[7-8]。线粒体生物合成是指在一个细胞的生命周期中线粒体的增殖,以及线粒体的系统合成和个体合成过程。在未分化ESC中线粒体的数目以及嵴都较贫乏,而分化的ESC发生急剧变化,表现为嵴丰富,数目增加,形成网络化[9-10]。过氧化物酶体增殖物激活受体 γ(peroxisome proliferator activated receptorγ,PPARγ)共激活子1α(PPARγ coactivator 1α,PGC-1α)是线粒体生物合成的关键调控因子[11]。
白黎芦醇是一类含有芪类结构的非黄酮类多酚化合物,主要存在于葡萄、百合科、寥科、豆科、花生和虎杖等食用或药用植物,具有抗动脉粥样硬化、抗炎、抗癌、抗氧化和抗血小板聚集等作用。另外,白藜芦醇可降低血循环中的低密度脂蛋白和胆固醇,增加心肌细胞功能,其对冠心病显著的预防与治疗作用引起人们关注[12],且白藜芦醇对PPARγ有激活作用[13]。本研究将针对白藜芦醇是否在ESC分化为心肌细胞中所起到的干预作用与分子调节机制进行探讨。
1 材料与方法
1.1 细胞、试剂和主要仪器
小鼠ESC D3细胞购自中国科学院上海生物细胞研究所。白藜芦醇购自上海融禾公司(纯度>95%)。knockout-DMEM 培养基(Dulbecco modified Eagle medium)、高糖DMEM、胎牛血清(fetal bovine serum,FBS),β-巯基乙醇、非必需氨基酸(NEAA)、N-2-羟乙基哌嗪-N-2-乙磺酸(HEPES)、L-谷氨酰胺,青链霉素双抗和 Trizol均购自德国Invitrogen Gibco公司;四甲基偶氮唑蓝(MTT)、二甲亚砜(DMSO)和明胶购自德国Sigma公司。小鼠白血病抑制因子(murine leukemia inhibitory factor,mLIF)购自美国 CHEMICON公司。PPARγ、PGC-1α、α 肌动蛋白和 GAPDH 一抗购自美国Abcam公司,HRP标记的二抗(山羊抗兔和山羊抗小鼠IgG抗体)购自中杉金桥生物技术公司,RT-PCR试剂盒购自加拿大 Fermentas公司,SYBG试剂盒购自日本TaKaRa公司,引物(表1)α-肌球蛋白重链(α-myosin heavy chain,α-MHC)、PPARγ、PGC-1α、核呼吸因子-1(nuclear respiratory factor-1,NRF-1)、线粒体转录因子 A(mitochondrial transcription factorA,mtTFA)和线粒体呼吸链复合体Ⅳ(mitochondrial respiratory chaincomplexⅣ,COXⅣ)由北京赛百盛公司合成。Bio-Rad Real-Time PCR 仪(美国伯乐公司),透射电镜(日本Hitachi公司)。

Tab.1 Primer sequence and length of amplified fragments
1.2 细胞培养及白藜芦醇给药干预
自液氮中取出一支冻存的小鼠ESC,复苏后接种于自制备用的小鼠胚胎成纤维细胞 (mouse embryonic fibroblast,MEF)滋养层,加入 ESC完全培养基 (15%FBS,84%knockout-DMEM,1%HEPES,1%NEAA ,1% 双抗,0.1% β-巯基乙醇,mLIF 1×107U·L-1)维持培养。ESC集落达60%~70%融合时,进行传代。0.25%胰酶(含EDTA)消化处于对数生长期的ESC,用差速贴壁的方法除去MEF滋养层细胞,培养基中不再添加mLIF。消化后的ESC单细胞悬液进行计数,取细胞3.75×104L-1悬滴培养于10 cm的细菌培养皿盖板上,每滴20 μl,悬滴3 d后,倒置显微镜下可见每个悬滴中一个EB,将EB移入60 cm悬浮培养皿,加入10 ml无mLIF的ESC培养基(FBS 20%,其余成分同 ESC完全培养基),放入37℃,5%CO2培养箱中悬浮培养2d后,将EB接种于事先铺被1%明胶的24孔板内。每孔内一个EB,加入无mLIF的ESC分化培养基,轻摇使EB移至孔中央,放入37℃,5%CO2培养箱中培养,每日倒置显微镜下观察,1 d后可见EB外层细胞分化。
ESC形成EB贴壁后24 h,分别加入白藜芦醇0.44,4.4 和 44 μmol·L-1培养,进行后续实验。
1.3 ESC分化为心肌细胞的相关指标的检测
EB贴壁培养5 d(白藜芦醇干预96 h)后,光学显微镜下观察24孔板内EB自发分化为有自发收缩能力的心肌细胞的发生率,取分化后的细胞进行实时PCR和Western印迹实验,检测心肌特异性基因α-MHC和心肌细胞标志性蛋白α辅肌动蛋白(α-actinin)的表达。
1.4 透射电子显微镜观察分化ESC内线粒体结构
用细胞刮刀将正常对照组和白藜芦醇4.4 μmo·lL-1组细胞刮下,200×g离心5 min,将细胞迅速放入装有预冷固定液(2%多聚甲醛和2.5%戊二醛)的尖头EP管中固定,二甲砷酸钠缓冲液0.1 mo·lL-1冲洗后,再采用1%锇酸(OsO4)固定2 h。细胞固定后进行乙醇梯度脱水,环氧丙烷置换,环氧树脂包埋,切片,切片厚度为50~80 nm。样品干燥后,置于铜网上,采用 Philips EM208s型透射电子显微镜观察,摄片。每组细胞采用3张切片,先在低倍镜下进行全面细致的观察,然后6000倍放大倍数下定量拍照。在选定的每张切片上随机拍摄细胞内照片各5张。
1.5 实时荧光定量 PCR 法测定 α-MHC,NRF-1,mtTFA和COXⅣ基因表达
用细胞铲刮取每组24个EB,每组加入1 ml Trizol,冰浴超声破碎,按Trizol试剂盒说明书要求提取胚胎中总RNA。260 nm紫外吸收法检测RNA含量。各组取1 μl RNA逆转录合成第一链cDNA。以 cDNA进行扩增反应,加入 α-MHC,PGC-1α,PPARγ,NRF-1,mtTFA 和 COXⅣ等基因的上下游引物各10 pmol,反应体系总体积25 μl。反应条件设置为:预变性95℃ 1 min;95℃/30 s,58℃/15 s,72℃/15 s,共 40个循环。以 GAPDH为内参,进行半定量分析。目的基因的相对表达水平 用 2-ΔΔCt表 示,ΔCt=Ct目标基因- CtGAPDH,ΔΔCt=ΔCt药物组-ΔCt对照组。
1.6 Western印迹法测定分化 ESC内 PPARγ、PGC-1α和α辅肌动蛋白表达
白藜芦醇干预96 h后,各组取1~2块24孔板内分化培养的ESC,RIPA法提取细胞蛋白,BCA法测定总蛋白浓度,根据蛋白质浓度确定合适的上样量。蛋白电泳完毕后,采用湿法将蛋白质电转印至PVDF膜。根据预染蛋白标记剪取目的蛋白条带,PPAR γ、PGC-1α、α 辅肌动蛋白及 GAPDH 所用一抗的稀释比例为1∶1000。一抗孵育完成后,用TBST洗膜,HRP标记的二抗室温温育1 h;使用LumiGLO®Chemiluminescent Substrate(KPL)进行发光底物孵育,根据目的蛋白的不同,采用不同的曝光时间。使用Quantity ONE软件对目的蛋白进行积分吸光度(integrated absorbance,IA)光密度分析,以GAPDH为内参蛋白。目的蛋白相对表达水平=IA目的蛋白/IAGAPDH。实验重复3次。
1.7 统计学分析
2 结果
2.1 白藜芦醇对ESC分化为心肌细胞的影响
小鼠ESC在MEF上生长良好(图1A),消化传代时,按悬滴悬浮法制备 EB并诱导分化(图1B),分化10 d的细胞外围可见多种类型细胞,部分克隆可见心肌自发性节律收缩。
Fig.1 Differentiation of embryonic stem cells(ESC)to cardiomyocytes(original magnification ×200).A:arrows pointed undifferentiated murine ESC;B:arrow pointed differentiated murine ESC.
显微镜下计数观察发生心肌细胞搏动的EB数量,结果显示(表2),在ESC分化第10天,与正常对照组相比,白藜芦醇 0.44 与 4.4 μmol·L-1组自发搏动的EB数明显增加(P<0.05)。

Tab.2 Effect of resveratrol on numbers of EB containing contracting myocardial cells in 24-well plates
2.2 白藜芦醇对分化的ESC内线粒体结构的影响
透射电镜结果显示(图2),与正常对照组分化的 ESC 细胞相比(图 2A),白藜芦醇 4.4 μmol·L-1干预96 h,其细胞内线粒体更加丰富,结构完整,提示白藜芦醇可以上调ESC在细胞分化过程中的线粒体生成(图2B)。

Fig.2 Effectofresveratrolon ultrastructure of mitochondria in differentiated ESCs(×6000).A:normal control group;B:resveratrol 4.4 μmol·L -1for 96 h group.Arrows pointed mitochondria in the differentiated murine ESC.
2.3 白藜芦醇对分化的ESC内α-MHC,PPARγ,PGC-1α,NRF-1,mtTFA和COXⅣ基因表达的影响
如图3 所示,白藜芦醇0.44,4.4 与44 μmol·L-1培养96 h后,与正常对照组ESC相比,各组ESC内心肌细胞特异基因α-MHC表达显著增加,分别为466%,271%和59%;PGC-1α基因表达分别增加了163%,321%和28%,PGC-1α基因表达分别增加了405%,530%和165%,NRF-1基因表达分别增加了270%,159%和72%,mtTFA的基因表达分别增加了45%,125%和17%,线粒体生成的标志因子COXⅣ基因表达分别增加 52%,266%和22%。除 44 μmol·L-1组的 mtTFA 和 COXⅣ基因表达外,其他差异均具有统计学意义(P<0.05)。
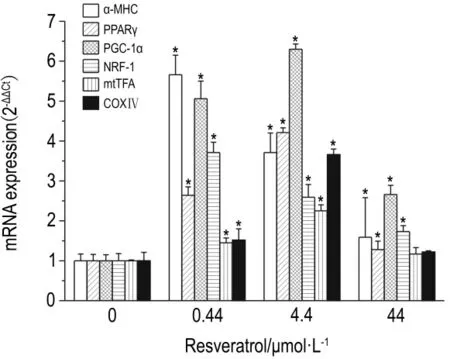
Fig.3 Effect of resveratrol on mRNA expression of α-MHC,PPARγ,PGC-1α,NRF-1,mtTFA and COXⅣ in differentiated murine ESCs.Differentiated ESC were treated with resveratrol 0,0.44,4.4 and 44 μmol·L -1for 96 h.±s,n=3.*P<0.05,compared with normal control group.
2.4 白藜芦醇对分化的ESCα辅肌动蛋白、PPARγ和PGC-1α蛋白表达的影响
如图4所示,与正常对照组ESC相比,白藜芦醇干预96 h后,各剂量组心肌细胞标志蛋白α辅肌动蛋白表达增加,分别增加了65%,101%和21%;PPARγ蛋白表达分别增加了 69%,176%和153%;PGC-1α蛋白表达分别增加了121%,149%和27%。除白藜芦醇 44 μmol·L-1组的 α 辅肌动蛋白和PGC-1α蛋白表达外,其余差异均具有统计学意义(P<0.05)。
3 讨论
按照ECVAM推荐的ESC分化为心肌细胞的观察指标,本研究结果发现,在白藜芦醇干预96 h后,有自发搏动的EB数较对照组明显增加,提示白藜芦醇可以促进ESC向心肌细胞的分化。但ESC分化为心肌细胞是一个渐进和复杂的过程,包括心肌特异基因的转录、结构蛋白的表达以及离子通道的形成等关键步骤。心肌分化启动首先是心肌特异性转录因子与心肌特异性基因的表达,在整个心肌发育过程中心脏特异性基因α-MHC表达相对较早,肌小节蛋白的表达标志心肌细胞分化到成熟阶段[14-15]。
为了进一步明确白藜芦醇是否有促进ESC向心肌细胞分化的作用,本研究挑选心肌细胞特异性基因α-MHC与心肌细胞标识蛋白α辅肌动蛋白为分子标志物,进一步对分化细胞中心肌细胞特异性成分进行半定量分析。α-MHC基因在ESC分化为心肌细胞的早期即有表达并持续,而α辅肌动蛋白的表达则对应着心肌细胞分化成熟阶段[3]。通过对α-MHC进行实时 PCR以及α辅肌动蛋白进行Western印迹检测结果发现,白藜芦醇可以上调分化ESC中心肌细胞特定基因和标志蛋白的表达,尤其在浓度 4.4 μmol·L-1时,白藜芦醇的诱导作用最强,提示白藜芦醇增强转录因子α-MHC的表达,继而增强了α辅肌动蛋白表达,证实白藜芦醇可以促进ESC向心肌细胞分化。
用透射电镜观察分化的ESC细胞内超微结构,发现白藜芦醇 4.4 μmol·L-1给药 96 h,细胞内线粒体数量更为丰富,嵴结构完整,提示白藜芦醇在促进ESC向心肌细胞分化的同时伴随着线粒体生成的增加。
楼宜嘉等[16-17]在以淫羊藿诱导小鼠 ESC向心肌细胞分化的过程中,活性氧簇(reactive oxygen species,ROS)表达上调,激活 p38MAPK以及PGC-1α 和 PPARα。已有充分证据表明,PGC-1α是一个重要的线粒体生物合成调节子[11],提示在ESC分化过程中,PGC-1α介导的线粒体生物合成可能在诱导ESC分化为心肌细胞中发挥作用。PGC-1α有助于协调有氧代谢相关基因的表达,且PGC-1α的表达受很多因素影响。业已明确,PGC-1α可以与大多数核激素受体包括PPARγ在内的超家族成员,以不同的方式与其发生分子对接,进而调控其生物学功能[18]。
很多研究表明,白藜芦醇对PPARγ受体起激动作用。葛恒等[13]在自身不表达 PPARγ蛋白的U937细胞中电穿孔共转染PPARγ表达质粒和其报告质粒,从而构建PPARγ激动剂筛选模型的方法证实,白藜芦醇为PPARγ受体的激动剂。李晓寒等[19-20]证实,白藜芦醇通过调节 PPARγ 的细胞信号转导途径,防御高脂饮食大鼠血脂的升高,并拮抗心肌组织PPARγmRNA的低表达,在心血管疾病发生发展中起保护作用。本研究实时PCR实验结果与Western印迹实验结果显示,白藜芦醇上调了分化的ESC细胞内PPARγ与PGC-1α的基因和蛋白表达。由此推测,白藜芦醇激动PPARγ受体,同时上调了其辅因子PGC-1α的表达。
很多核基因编码的线粒体酶类对PGC-1α产生应答,例如NRF-1和NRF-2,它们触发编码呼吸链多肽及mtDNA转录和复制蛋白的核基因的表达。NRF-1和NRF-2是转录调节子,作用于编码氧化磷酸化系统亚基组分的核基因的表达。同时,在核内它们通过绑定氧化磷酸化基因启动子的共有序列调节其他与mtDNA复制有关的基因的表达[21]。mtTFA 是一个转录因子,与 mtDNA D-loop区的启动子作用,调节线粒体基因组的复制和转录[22]。导致分化的ESC线粒体丰度和线粒体功能的变化依赖于线粒体及mtDNA的质量。当细胞具有优质的亲本线粒体和mtDNA时,将导致线粒体丰度和mtDNA分子的增加,最终由于增加了线粒体而使能量供应增加。本研究发现,白藜芦醇干预后,均不同程度地上调了上述信号因子的基因表达。
COXⅣ是由核编码的线粒体蛋白,被认为是线粒体和核基因之间转录、翻译及调节等作用的典型,能够对线粒体的生物合成给予最快速的应答。因此,本研究选用COXⅣ作为线粒体生物合成的指标。实时PCR结果显示,白藜芦醇在激活分化ESC内线粒体生物合成的信号通路后,最终上调了COXⅣ基因的表达。结合线粒体的形态学指标透射电镜超微结构观察发现,经白藜芦醇4.4 μmol·L-1干预96 h,分化后的ESC细胞内线粒体数量更为丰富,嵴结构完整。至此,本研究初步证实了白藜芦醇对ESC向心肌细胞分化的调控作用是通过上调线粒体生成发挥的。
线粒体生物合成增多说明由一种相对较低的活动状态向较高的呼吸功能转化,预示着胞内较高的能量要求,在ESC分化过程中此变化类似于胚胎发育中的线粒体受到体内环境的影响,线粒体的活性和分布状况会随着胚胎发育时期的不同而改变[23]。研究证实,ESC细胞向心肌细胞分化过程中,能量代谢和供应方式从糖酵解向有氧代谢转变,因此需要线粒体的数量与功能的增加来维持分化[9]。
综上所述,白藜芦醇激活PPARγ受体,进而上调 PGC-1α 的表达,激活 NRF-1 和 mtTFA,使得ESC内线粒体的生物合成增加,线粒体功能增强,线粒体数量与质量的循环改善,进而为ESC分化为心肌细胞提供足够的能量,以及良好地适应分化过程中代谢方式转变的需求,最终表现为促进ESC分化心肌细胞。
[1]Guan K,Rohwedel J,Wobus AM.Embryonic stem cell differentiation models:cardiogenesis,myogenesis,neurogenesis,epithelial and vascular smooth muscle cell differentiation in vitro[J].Cytotechnology,1999,30(1-3):211-226.
[2]Singla DK,Hacker TA,Ma L,Douglas PS,Sullivan R,Lyons GE,et al.Transplantation of embryonic stem cells into the infarcted mouse heart:formation of multiple cell types[J].J Mol Cell Cardiol,2006,40(1):195-200.
[3]Rolletschek A,Blyszczuk P,Wobus AM.Embryonic stem cell-derived cardiac, neuronal and pancreatic cells as model systems to study toxicological effects[J].Toxicol Lett,2004,149(1-3):361-369.
[4]Genschow E,Spielmann H,Scholz G,Seiler A,Brown N,Piersma A,et al.The ECVAM international validation study on in vitro embryotoxicity tests:results of the definitive phase and evaluation of prediction models.European Centre for the Validation of Alternative Methods[J].Altern Lab Anim,2002,30(2):151-176.
[5]Riebeling C,Pirow R,Becker K,Buesen R,Eikel D,Kaltenhäuser J,et al.The embryonic stem cell test as tool to assess structure-dependent teratogenicity:the case of valproic acid[J].Toxicol Sci,2011,120(2):360-370.
[6]Heng BC,Haider HKh,Sim EK,Cao T,Ng SC.Strategies for directing the differentiation of stem cells into the cardiomyogenic lineage in vitro[J].Cardiovasc Res,2004,62(1):34-42.
[7]St John JC,Ramalho-Santos J,Gray HL,Petrosko P,Rawe VY,Navara CS,et al.The expression of mitochondrial DNA transcription factors during early cardiomyocyte in vitro differentiation from human embryonic stem cells[J].Cloning Stem Cells,2005,7(3):141-153.
[8]Chung S,Dzeja PP,Faustino RS,Perez-Terzic C,Behfar A,Terzic A.Mitochondrial oxidative metabolism is required for the cardiac differentiation of stem cells[J].Nat Clin Pract Cardiovasc Med,2007,4(Suppl 1):S60-S67.
[9]Prigione A,Adjaye J.Modulation of mitochondrial biogenesis and bioenergetic metabolism upon in vitro and in vivo differentiation of human ES and iPS cells[J].Int J Dev Biol,2010,54(11-12):1729-1741.
[10]Mandal S,Lindgren AG,Srivastava AS,Clark AT,Banerjee U.Mitochondrial function controls proliferation and early differentiation potential of embryonic stem cells[J].Stem Cells,2011,29(3):486-495.
[11]Wu Z,Puigserver P,Andersson U,Zhang C,Adelmant G,Mootha V,et al.Mechanisms controlling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1[J].Cell,1999,98(1):115-124.
[12]Baur JA,Sinclair DA.Therapeutic potential of resveratrol:the in vivo evidence[J].Nat Rev Drug Discov,2006,5(6):493-506.
[13]Ge H,Zhang JF,Wang BY,Wang CQ.Agitation effect of resteratrol on PPAR-γ[J].Chin Pharm J(中国药学杂志),2005,40(12):905-908.
[14]Zaffran S,Frasch M.Early signals in cardiac development[J].Circ Res,2002,91(6):457-469.
[15]Lyons GE,Schiaffino S,Sassoon D,Barton P,Buckingham M.Developmental regulation of myosin gene expression in mouse cardiac muscle[J].J Cell Biol,1990,111(6 Pt 1):2427-2436.
[16]Ding L, Liang XG, Zhu DY, Lou YJ.Icariin promotes expression ofPGC-1alpha, PPARalpha, andNRF-1 during cardiomyocyte differentiation of murine embryonic stem cells in vitro[J].Acta Pharmacol Sin,2007,28(10):1541-1549.
[17]Fragomeni G,Merola A,De Franciscis S,Amato F.A haemodynamic model of the venous network of the lower limbs[J].Conf Proc IEEE Eng Med Biol Soc,2007,2007:1002-1005.
[18]Puigserver P, Spiegelman BM. Peroxisome proliferatoractivated receptor-gamma coactivator 1 alpha(PGC-1 alpha):transcriptional coactivator and metabolic regulator[J].Endocr Rev,2003,24(1):78-90.
[19]Li XH,Yin RL,Song M,Zhang D,Cheng NL,Tan XT.Effects of resveratrol on PPAR gamma mRNA expression in heart of hyperlipidemia rats[J].Acta Nutr Sin(营养学报),2009 ,31(1):91-93.
[20]Li XH,Song M,Yin RL,Tan XT.Effects of resveratrol on PPARγ /AP-1 in heart of rats with high-fat diet[J].Chin J Public Health(中国公共卫生),2011,27(5):589-590.
[21]Evans MJ, Scarpulla RC. NRF-1:a trans-activator of nuclear-encoded respiratory genes in animal cells[J].Genes Dev,1990,4(6):1023-1034.
[22]Virbasius JV,Scarpulla RC.Activation of the human mitochondrial transcription factor A gene by nuclear respiratory factors:a potential regulatory link between nuclear and mitochondrial gene expression in organelle biogenesis[J].Proc Natl Acad Sci USA,1994,91(4):1309-1313.
[23]Van Blerkom J,Davis P,Alexander S.Differential mitochondrial distribution in human pronuclear embryos leads to disproportionate inheritance between blastomeres:relationship to microtubular organization,ATP content and competence[J].Hum Reprod,2000,15(12):2621-2633.

