曲尼司特对糖尿病大鼠肾单核细胞趋化蛋白1表达的抑制作用
闫 睿,符丽娟,王 婧
(辽宁医学院药理学教研室,辽宁锦州 121001)
肾间质纤维化是各种原因引起的肾疾病进入慢性肾衰竭的共同途径。糖尿病性肾病是引起终末期肾衰竭的主要原因之一,是糖尿病患者死亡的主要慢性并发症之一。近年来,随着对糖尿病的研究深入,如何防治其严重并发症成为首要任务。糖尿病性肾病是由代谢紊乱引起的复杂性疾病,病理特征为早期肾小球肥大,进展至基底膜增厚及系膜扩张,肾小球细胞外基质(extracellular matrix,ECM)积聚、肾小球硬化及间质纤维化。近年研究发现炎性因子单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)参与ECM 的积聚,进而加重糖尿病性肾病进展。MCP-1是一种特异的趋化因子,有着很强的单核细胞趋化激活作用。研究发现,正常的肾组织可分泌微量的MCP-1,而当肾组织受到刺激后其MCP-1 mRNA及蛋白质表达明显高于正常组织,并与肾损害程度成正相关[1]。而肥大细胞分化增殖活化,从分泌颗粒释放细胞因子、化学趋化因子和生长因子等炎性介质。曲尼司特(tranilast)可以稳定肥大细胞和嗜碱性细胞的细胞膜,抑制过敏性物质的释放。它的作用随着时间的推移被逐渐挖掘,从最先的抗过敏,治疗哮喘,到如今成为焦点的抗纤维化作用,其对皮肤和眼的纤维增殖性疾病的抗纤维化已被证实。但对肾间质纤维化的研究尚不明确。本研究通过建立糖尿病大鼠模型,应用曲尼司特干预观察MCP-1在糖尿病肾纤维化发生、发展中的作用,同时探讨其对糖尿病肾纤维化的作用及机制,为寻求抗肾纤维化的靶点和延缓肾间质纤维化的方法和制剂提供理论与实验依据。
1 材料与方法
1.1 药物、试剂及仪器
链脲佐菌素(streptozotocin,STZ),货号:H1027S,美国Sigma公司。曲尼司特,批号:国药准字H1093017-5,中国药科大学制药有限公司。MCP-1试剂盒,编号:SX01094,上海森雄科技实业有限公司。S-P9002免疫组化试剂盒购自北京中山金桥公司。碱性磷酸酶标记的山羊抗兔抗体和β肌动蛋白和NBT/BCIP显色液购自碧云天试剂公司。三诺安稳血糖仪,长沙三诺生物有限公司。
1.2 动物、模型制备及分组
SD大鼠,40只,♂,体质量230~270 g,2月龄,由辽宁医学院实验动物中心提供,动物许可证号SCXK(辽)2009-0007。适应性饲养 1周后,将40只大鼠随机分为正常对照、模型、曲尼司特100和200 mg·kg-1组,每组10只。除正常对照组注射等容积 0.1 mmol·L-1枸橼酸缓冲液外,其余各组一次性尾静脉注射 STZ 30 mg·kg-1[2],72 h后非同日连续3次测定血糖均≥16.7 mmol·L-1为造模成功大鼠。按照分组ig给予曲尼司特每天1次,连续12周,正常对照组和模型组ig给予等量生理盐水。
1.3 肾指数测定、生化指标检测及标本采集
给药第12周末,用代谢笼准确收集24 h尿标本,记录尿量测定24 h尿蛋白,禁食12 h后称质量。检测空腹血糖。ip给予20%乌拉坦(5 ml·kg-1)大鼠麻醉,颈总动脉取血2 ml,3000×g离心10 min,分离血清检测BUN。处死大鼠,肾以冰生理盐水冲洗干净,用滤纸吸干水分后称重,计算肾指数=右肾质量(mg)/体质量(g)×100,以冰生理盐水冲洗干净,左肾冻存于-80℃ 冰箱中备用,右肾以10%中性甲醛溶液固定,PBS洗,石蜡包埋 ,制成4 μm切片备用进行病理、免疫组化检查。
1.4 Masson染色观察肾组织病理变化
取肾组织,用10%甲醛溶液固定,常规石蜡包埋,切片,Masson染色观察肾脏胶原纤维增生情况。各组随机选取5只大鼠,每只大鼠随机取5张切片,每张切片在统一放大倍数下(×400)随机选取10个视野,镜下观察肾组织病理形态学变化及测算胶原容积分数(CVF),CVF(%)=胶原面积/总面积×100。
1.5 免疫组织化学法检测肾组织MCP-1蛋白表达
取肾组织,常规石蜡包埋,切片厚2 μm脱蜡至水;含3%H2O2的甲醇室温孵育25 min,阻断内源性过氧化物酶;微波修复抗原;加入1∶100稀释的兔抗鼠单克隆抗体(一抗),置湿盒中4℃过夜;1∶100稀释生物素化山羊抗兔 IgG(二抗),37℃孵育25 min;DAB显色:1 ml蒸馏水加入试剂盒中A,B,C试剂各1滴,混匀后加至切片,室温显色,镜下控制反应时间5 min,阳性细胞于细胞质出现棕黄色颗粒;苏木精轻度复染细胞核;脱水、透明、中性树胶封片,镜下观察。
1.6 Western印迹法检测肾组织MCP-1蛋白表达
取约100 mg肾组织,立即放入预冷的Tris缓冲液中〔TBS(mmol·L-1):1%Triton,0.1%SDS,0.5%去氧胆酸,EDTA 1,Tris 20(pH 7.4),NaCl 150,NaF 10〕,4℃超声粉碎后,12000 ×g 离心30 min,取上清,用Lowry等[3]法测定蛋白质含量,以牛血清白蛋白(bovine serum albumin,BSA)为标准品,将蛋白浓度调成一致。用10%~12%SDS-PAGE分离蛋白质,每个泳道蛋白上样量为20~50 μg。为了准确判断目的蛋白带的位置,一个泳道加Seeblue plus 2预染蛋白标志物。电泳后将PAGE凝胶中的蛋白质电转移至聚偏氟乙烯膜上,取出后将膜放入3%BSA阻断缓冲液中,封闭60 min,再用 TBS〔Tris 10 mmol·L-1(pH 8.0),NaCl 150 mmol·L-1〕洗膜 3 次,每次 10 min。将膜放入一抗中(所有一抗均1∶500稀释),4℃过夜。TBS冲洗后,将膜放入碱性磷酸酶标记的山羊抗兔二抗中(二抗均1∶500稀释),室温孵育1~2 h,然后用TBS洗膜3次,每次10 min,NBT/BCIP显色液中避光显色,直至出现,终止反应。对MCP-1进行测定。测定β肌动蛋白,以保证蛋白上样量的一致性。将蛋白印迹显像图扫描,利用凝胶自动分析成像软件Chem Image 5500对蛋白带进行积分吸光度值(integrated absorbance,IA)分析,以β肌动蛋白为参照,计算二者IA比值表示MCP-1的表达。
1.7 统计学分析
2 结果
2.1 曲尼司特对糖尿病大鼠一般情况、肾指数及生化指标的影响
糖尿病大鼠模型组大鼠造模成功后,开始出现明显的多饮、多食、多尿,逐渐消瘦,精神萎靡,至实验结束时死亡2只;模型组大鼠体质量增加缓慢,曲尼司特100 和200 mg·kg-1组大鼠增长较快(P<0.05),两组之间体质量差异无统计学意义,但均较正常对照组体质量明显减轻(P<0.05)。实验过程中,曲尼司特100 mg·kg-1组因灌胃窒息大鼠死亡1只。表1结果显示,与正常对照组相比,模型组、曲尼司特100和200 mg·kg-1组血糖、24 h 尿蛋白、血 BUN 均明显升高(P<0.01);模型组、曲尼司特100 mg·kg-1组肾指数明显升高(P<0.05),曲尼司特200 mg·kg-1组肾指数与正常对照组相比无统计学差异;与模型组比较,曲尼司特100和200 mg·kg-1能明显降低糖尿病大鼠肾指数、24 h尿蛋白、血BUN(P<0.01),但曲尼司特治疗后24 h尿蛋白、血BUN均未恢复至正常对照组水平(P<0.05)。
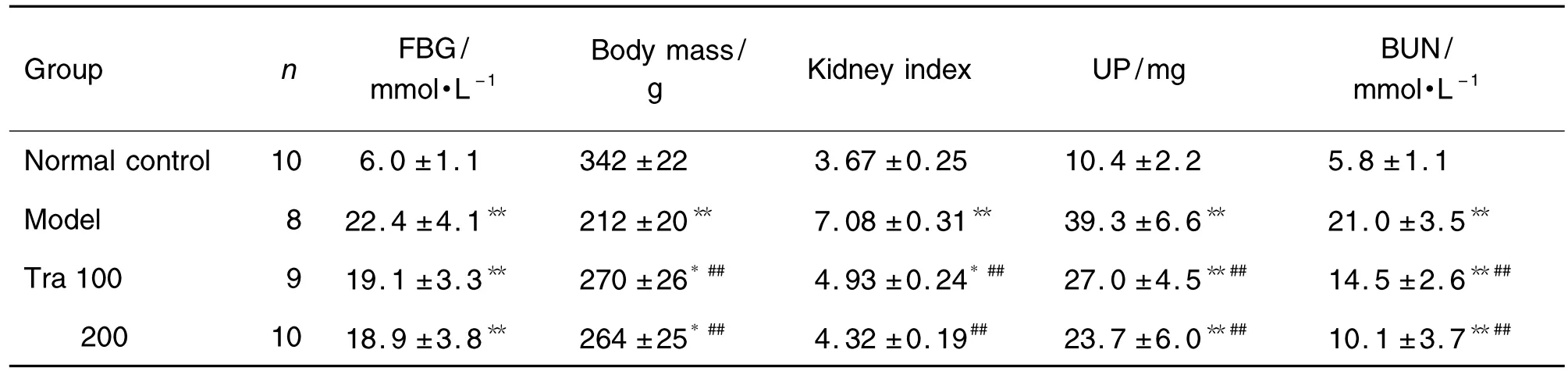
Tab.1 Effect of tranilast(Tra)on levels of fasting blood glucose(FBG),body mass and kidney index,urinary protein(UP),and blood urea nitrogen(BUN)of diabetic model rats
2.2 曲尼司特对糖尿病大鼠肾形态的影响
由图1可见,Masson染色在正常对照组的胶原染色主要位于肾小球基底膜、Bowman囊、系膜区和肾小管周围血管,胶原容积分数(3.50±0.52)%,肾小球毛细血管襻开放良好,未见肾小球节段硬化,肾小管上皮细胞排列整齐(图1A);模型组可见肾间质内大量胶原纤维增生,间质胶原呈现蓝染,间质纤维化呈灶状分布,可见肾小球局灶性节段性硬化(图1B),胶原容积分数为(7.05±1.49)%;曲尼司特 100 和 200 mg·kg-1组肾小球轻度肿胀,肾小管上皮细胞变性,间质纤维增生(图1C,D),胶原容积分数分别为(5.72±1.28)%和(4.94±1.06)%。上述改变较模型组均有减轻,具有统计学差异(P<0.05),曲尼司特200 mg·kg-1组更为显著(P<0.01),但都未恢复至正常对照组水平(P<0.05)。
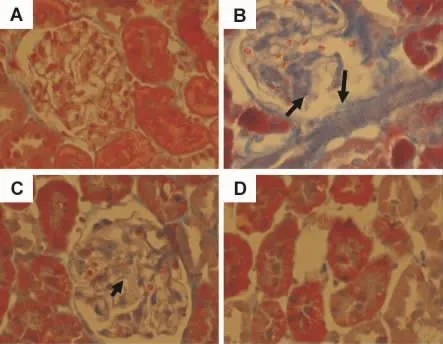
Fig.1 Effect of tranilast on pathological changes in renal tissue of diabetic rats(Masson staining,×400).See Tab.1 for the rat treatments.A:normal control group;B:model group;C:Tra 100 mg·kg-1;D:Tra 200 mg·kg-1.Arrows show the collagen fiber.
2.3 曲尼司特对糖尿病大鼠肾组织MCP-1表达影响
2.3.1 免疫组化结果
由图2可见,正常对照组肾小球内皮细胞、系膜细胞,肾小管及间质无明显染色,肾组织少量表达MCP-1(图2A)。模型对照组肾组织着色广泛、浓集,MCP-1表达扩大及增强(图2B)。与模型组比较,曲尼司特100和200 mg·kg-1组肾小管上皮细胞有弱着色,MCP-1表达程度减轻(图2C,D),提示曲尼司特可以减少糖尿病性肾病大鼠肾组织内MCP-1的表达。
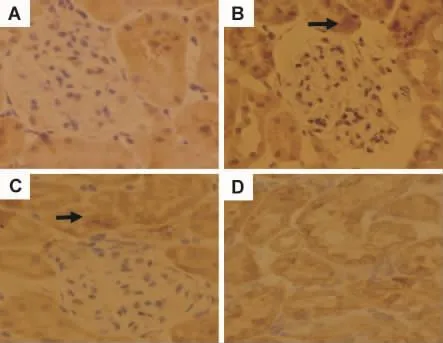
Fig.2 Effect of tranilast on expression of monocyte chemcoattractant protein-1(MCP-1)in the kidneys of diabetic rats(Immunohistochemistry × 400).See Tab.1 for rat treatments.A:normal group;B:model group;C and D:tranilast 100 and 200 mg·kg-1groups.Arrows show positive cells.
2.3.2 Western印迹结果
由图3及其半定量结果可见,与正常对照组(0.264±0.012)相比,模型组肾组织 MCP-1 蛋白表达水平(0.675±0.059)显著增加(n=3,P<0.01)。与模型组相比,曲尼司特100和200 mg·kg-1组MCP-1蛋白表达水平明显减弱(n=3,P<0.05),分别为0.511±0.040 和0.404±0.075,其中曲尼司特200 mg·kg-1作用更加明显(n=3,P<0.01),但都未恢复至正常对照组水平(P<0.05)。
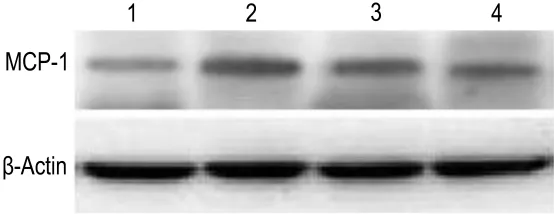
Fig.3 Effect of tranilast on expression of MCP-1 in the kidneys of diabetic model rats by Western blotting.See Tab.1 for rat treatments.Lane 1:control group;lane 2:model group;lane 3:Tra 100 mg·kg -1;lane 4:Tra 200 mg·kg -1.
3 讨论
MCP-1是单核巨噬细胞的特异性趋化因子,可由体内多种细胞产生,包括内皮细胞、单核细胞、平滑肌细胞、系膜细胞和肾小管上皮细胞等。已有研究发现,正常肾组织多种细胞均能分泌微量MCP-1,当肾组织受到刺激后,其MCP-1 mRNA及蛋白质的表达明显高于正常组织,并与肾损害程度成正相关。本实验中病程12周时,糖尿病大鼠血糖、BUN和24 h UP水平明显高于健康对照组,肾毛细血管基底膜增厚、结构模糊;足突破坏、融合消失;系膜基质增多、系膜细胞肿胀,表明此时糖尿病大鼠已有糖尿病性肾病的改变。糖尿病性肾病组MCP-1表达量明显高于健康对照组,而曲尼司特干预组,肾功能以及肾脏病理改变有明显改善,且MCP-1的表达量也明显降低。胡长军等[4]研究也提示糖尿病大鼠组MCP-1表达较正常大鼠显著上调。Ha等[5]研究发现高血糖和高糖基化血红蛋白可刺激系膜细胞MCP-1 mRNA及MCP-1表达加强。还有研究发现,db/db糖尿病大鼠模型持续高血糖、肾小球免疫复合物沉积能刺激肾产生MCP-1,导致肾进行性损伤[6]。Morii等[7]也发现 MCP-1 通过趋化单核巨噬细胞在肾小管间质聚集,介导肾间质炎症、肾小管萎缩和间质纤维化而促进糖尿病性肾病的发展。上述研究提示MCP-1的过表达在糖尿病性肾病发生、发展中可能起到重要作用。其机制可能与以下因素有关:①肾疾病中MCP-1水平的升高能增强多种细胞因子和黏附分子的表达和合成,加重肾损害;②MCP-1能激活单核细胞中的溶酶体酶等炎症介质的释放,并可引发氧化应激,激活蛋白水解酶,增加氧自由基的生成,直接损伤肾脏血管内皮细胞[8-9]。
曲尼司特可稳定肥大细胞和嗜碱性粒细胞的细胞膜,抑制过敏性物质的释放。Mifsud等[10]研究发现,糖尿病性肾病大鼠模型每天给予曲尼司特(400 mg·kg-1,从第8周到第16周)干预,不影响血压和血糖,但可改善肾小管纤维化和萎缩,降低肾小球硬化和蛋白尿。本研究结果表明,曲尼司特干预12周,糖尿病大鼠肾组织病理改变减轻,说明其可以抑制糖尿病模型大鼠肾小球基底膜增厚、系膜基质增多及肾间质纤维增生。同时曲尼司特干预使大鼠BUN、肾指数和24 h UP水平明显降低,提示曲尼司特对糖尿病大鼠肾脏具有保护作用。此外,曲尼司特治疗后,糖尿病大鼠肾MCP-1表达明显降低,提示曲尼司特可以通过降低MCP-1表达,延缓糖尿病肾病变,起到肾保护作用。刘雪梅等[11]在狼疮肾炎、IgA肾病、慢性肾小球肾炎等多种类型的肾活检标本研究观察了肥大细胞的数量与肾间质损害程度的关系,发现肾间质损害程度不同的各组肾小球肾炎比较,肥大细胞数有统计学差异,且与间质纤维化及肾功能衰竭呈明显正相关,说明肥大细胞与间质纤维化有密切关系。而曲尼司特为肥大细胞的细胞膜稳定剂,具体作用有待于进一步研究。
综上所述,MCP-1的过表达在糖尿病性肾病发生、发展中起重要作用,曲尼司特可阻止肥大细胞脱颗粒释放炎症介质MCP-1,从而延缓肾间质纤维化的发展。
[1]Tesch GH.MCP-1/CCL2:a new diagnostic marker and therapeutic target for progressive renal injury in diabetic nephropathy[J].Am J Physiol Renal Physiol,2008,294(4):F697-F701.
[2]Thomas G,Ramwell PW.Streptozotocin:a nitric oxide carrying molecule and its effect on vasodilation[J].Eur J Pharmacol,1989,161(2-3):279-280.
[3]Lowry OH,Rosebrough NJ,Farr AL,Randall RJ.Protein measurement with the Folin phenol reagent[J].J Biol Chem,1951,193(1):265-275.
[4]Hu CJ,Lu WP,Wu QM,Zhao YF.Significance of monocyte chemotactic peptide-1 expression in diabetes in rats[J].Acta Univ Med Nanjing(Nat Sci)〔南京医科大学学报(自然科学版)〕,2005,4:246-248.
[5]Ha H,Yu MR,Choi YJ,Kitamura M,Lee HB.Role of high glucose-induced nuclear factor-kappaB activation in monocyte chemoattractant protein-1 expression by mesangial cells[J].J Am Soc Nephrol,2002,13(4):894-902.
[6]Chow F,Ozols E,Nikolic-Paterson DJ,Atkins RC,Tesch GH.Macrophages in mouse type 2 diabetic nephropathy:correlation with diabetic state and progressive renal injury[J].Kidney Int,2004,65(1):116-128.
[7]Morii T,Fujita H,Narita T,Shimotomai T,Fujishima H,Yoshioka N,et al.Association of monocyte chemoattractant protein-1 with renal tubular damage in diabetic nephropathy[J].J Diabetes Complications,2003,17(1):11-15.
[8]Giunti S, Tesch GH, Pinach S,Burt DJ,Cooper ME,Cavallo-Perin P,et al.Monocyte chemoattractant protein-1 has prosclerotic effects both in a mouse model of experimental diabetes and in vitro in human mesangial cells[J].Diabetologia,2008,51(1):198-207.
[9]Wada T,Furuichi K,Sakai N,Iwata Y,Kitagawa K,Ishida Y,et al.Gene therapy via blockade of monocyte chemoattractant protein-1 for renal fibrosis[J].J Am Soc Nephrol,2004,15(4):940-948.
[10]Mifsud S,Kelly DJ,Qi W,Zhang Y,Pollock CA,Wilkinson-Berka JL,et al.Intervention with tranilast attenuates renal pathology and albuminuria in advanced experimental diabetic nephropathy[J].Nephron Physiol,2003,95(4):83-91.
[11]Liu XM,Zhu ZH,Deng AG,Zhang C,Zhu HY.Relationship between mast cells and tubulointerstitial lesions in chronic glomerulonephritides[J].Chin J Nephrol(中华肾脏病杂志),2003,19(5):286-291.

