慢性不可预知应激诱导的抑郁大鼠血清中神经递质含量的动态变化
郭秉荣,杨 岚,刘佳丽,秦雪梅,高晓霞
(山西大学1.中医药现代研究中心,2.化学化工学院,山西太原 030006)
抑郁症是由多种因素引起的情感障碍性疾病,具有高发病率、高死亡率和高致残率的特点。目前,临床对抑郁症的诊断主要是使用量表结合临床进行评定,如汉密顿抑郁量表(Hamilton depression scale,HAMD)和抑郁自评量表(self-rating depression scale,SDS)等,但尚缺乏客观、可量化的抑郁症诊断方法和标准。很多学者对抑郁症患者的脑[1]及外周血[2-3]进行研究,发现神经递质的异常与抑郁程度有密切关系,且外周血的神经递质可反映脑中神经递质的状态,外周血神经递质的变化可作为抑郁症评定的重要参考指标。因此,探寻与抑郁症发生发展密切相关的血液中的神经递质将有望为抑郁症的客观准确诊断提供有效手段。
在动物实验中,慢性不可预知应激(chronic unpredictable stress,CUS)模型是一种被广泛采用的大鼠抑郁模型,它不仅模拟了人类抑郁的核心症状,即快感缺乏,同时也模拟了重症抑郁障碍的其他症状表现,如运动能力及社会交往能力下降、探索行为能力下降、侵犯攻击能力缺陷、性行为能力下降等等[4]。目前对抑郁模型是否成功建立的判断标准,多使用旷场数据或者糖水消耗数据[5-6],也有学者通过对抑郁造模过程中不同天数的糖水偏爱及旷场数据进行了统计和研究。这也只是模拟了临床上对抑郁症判定时的评价量表,需要找到更客观、更具体、更易量化的指标来评价抑郁症。抑郁症单胺假说以及其他学者的研究发现,抑郁大鼠脑内的神经递质有显著变化[7],有学者研究了大鼠抑郁样过程中大鼠海马组织神经递质的动态变化[8],但未见对大鼠抑郁样过程中大鼠血清神经递质动态变化的研究。本实验室前期运用代谢组学的方法发现抑郁大鼠氨基酸代谢异常[9-10],依据前期工作和相关文献,本研究观察CUS造模过程中不同时间血清中10种内源性成分的含量变化规律及其与抑郁症的相关性,以期用客观的指标描述CUS造模过程,寻找潜在临床诊断指标。
1 材料与方法
1.1 仪器和试剂
Agilent 1200型高效液相色谱仪和荧光检测器,美国安捷伦公司。去甲肾上腺素(norepinephrine, NE),批 号 169-9402,5-羟 色 胺 (5-hydroxytryptamine,5-HT),批号111656-200401,多巴胺(dopamine,DA),批号100070-200405,均中国药品生物制品检定所;高香草酸(homovanillic acid,HVA);3,4-二羟基苯乙酸(3,4-dihydroxyphenylacetic acid,DOPAC)均 Alfa Aesar;肾上腺素(epinephrine,E);5-羟基吲哚乙酸(5-hydroxyindole-3-acetic acid,5-HIAA)均 Sigma;左旋多巴(levodopa,L-DOPA),生工生物;酪氨酸(tyrosine,Tyr),色氨酸 (tryptophan,Trp)均日本Solarbio。醋酸钠,分析纯,天津光复科技发展有限公司;柠檬酸,分析纯,天津市大茂化学试剂厂;乙二胺四乙铵二钠,分析纯,天津市登峰化学试剂厂;辛烷磺酸钠,高纯试剂,华北地区特种化学试剂开发中心;娃哈哈纯净水,杭州娃哈哈集团有限公司。
1.2 动物及分组与造模
16只Sprague-Dawley(SD)成年雄性健康大鼠,清洁级,体质量(200±20)g(±s),北京维通利华实验动物技术有限公司提供。动物许可证号:SCKX-2006-0008。动物适应环境1周,置于自然昼夜节律光照条件下,自由进食、饮水,每日触摸动物以适应实验人员的操作。光照:12 h光/黑暗循环,早8:00开灯,晚8:00关灯。根据体质量将大鼠随机分为正常对照组(n=8)和模型组(n=8)。
根据本实验室前期实验的经验[9],模型组采用CUS配合孤养的造模方法(表1)。刺激方法包括:①禁食24 h;②禁水24 h;③4℃冰水游泳5 min;④50℃热应激5 min;⑤夹尾1 min(于距离大鼠尾根部2 cm处);⑥电击足底(电压为22 V,每隔30 s刺激1次,持续10 s,共15次);⑦ 潮湿垫料和倾斜45°(12 h);⑧束缚4 h(以矿泉水瓶作为束缚装置,使大鼠头部在矿泉水瓶的开口端,不影响其呼吸为宜);⑨陌生物品(如塑料片、瓶盖、碎布等,12 h);⑩ 噪声刺激(60 Hz,1 h)。模型组从第1天开始孤养,且每天上午8:00给予一种刺激,顺序随机,使动物不能预料刺激的发生,应激持续21 d。正常对照组群养且不给于任何刺激。
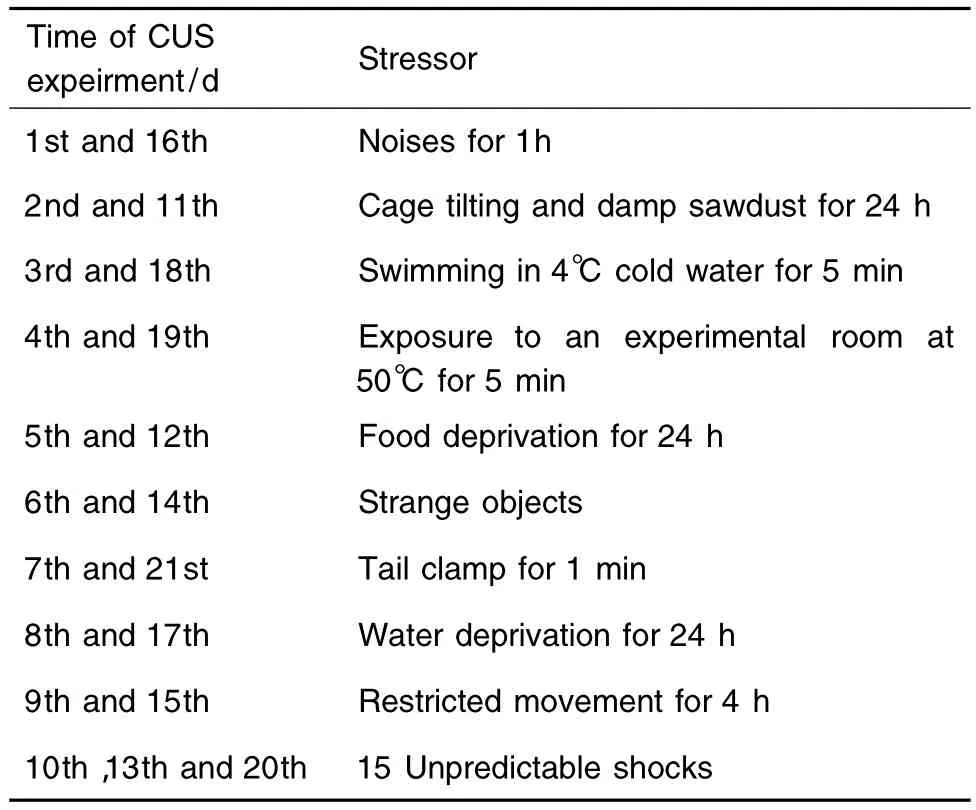
Tab.1 Schedule ofchronic unpredictable stress(CUS)items
1.3 大鼠体质量、旷场和糖水偏爱率的检测[10]
分别于造模前(d0)、造模d7,d14和d22,称大鼠体质量,进行旷场实验和糖水偏爱实验。
1.3.1 旷场实验
将单只大鼠置于长宽各100 cm、高50 cm光洁敞箱中央,敞箱底面划分为25个等边方格,内面用黑漆涂满,观测大鼠5 min内的活动情况:观察指标包括中央格停留时间(自大鼠被放入中央格至其三爪跨离该格的时间,以s计)、水平穿越格数(以穿越底面方格数为其水平得分,穿越1格为1分)、直立次数(两前肢离地或爬墙壁)、理毛时间。并在彻底清洁敞箱后再进行下一只大鼠的得分测定。
1.3.2 糖水偏爱实验
实验前2 d对所有大鼠进行1%蔗糖水训练实验(即先糖水喂养48 h),接着禁水24 h,每只大鼠准备糖水和自来水,称质量。通过测定饮水瓶的总量来计算4 h糖水消耗量和自来水消耗量,计算糖水偏爱率。糖水消耗偏爱率(%)=糖水消耗/总水消耗量(糖水+自来水)×100%。
1.4 HPLC-FD检测神经递质
1.4.1 血清样品的采集、处理
分别于造模d0,d6,d9,d12,d15早晨给予刺激前和d22同一时间,采用眼眶取血的方式采集血液 0.5 ml,置于 EP 管中,静置 30 min,4℃15100×g离心10 min,分离血清,储存于-80℃冰箱中保存备用。实验时,取100 μl血清样品,置2 ml EP管中,加入100 μl 6%高氯酸溶液,涡旋,4℃15100×g离心10 min,取上清,进行高效液相色谱仪分析。
1.4.2 标准溶液的配制
分别 称 取 5-HT,NE,E,DA,L-DOPA,5-HIAA,HVA,DOPAC,Tyr和Trp标准品适量,精密称定,以高氯酸 0.1 mol·L-1和 EDTA-2Na 0.2 mmo·lL-1混合溶液配制成浓度分别为2.36,3.55,10.04,4.50,12.53,8.32,5.98,14.15,11.42 和 11.65 mmol·L-1标准储备液,贮存于-20℃冰箱内。测定时配制成浓度分别为4.31,57.33,5.46,5.42,0.81,1.15,64.28,1.25,30.41 和 34.62 μmol·L-1的混标溶液,摇匀,进行高效液相色谱仪分析。
1.4.3 色谱条件
色谱柱:Agilent SB-C18(4.6 mm ×250 mm,5 μm);流动相(mmol·L-1):甲醇∶缓冲液(含醋酸钠40、柠檬酸30、EDTA-2Na 0.2、辛烷磺酸钠0.4,pH 3.8)=14∶86(V/V),流速:1.0 m·lmin-1;柱温25℃;荧光检测波长:λex=300 nm,λem=330 nm;进样量:20 μl。
1.5 统计学分析
2 结果
2.1 应激对大鼠体质量、旷场和糖水偏爱率的影响
如表2所示,与正常对照组相比,在造模前(d0)与造模期间d7,模型组大鼠的体质量、糖水偏爱率、旷场实验均无显著差异;在造模期间d14后,直立次数有显著降低(P<0.05);在造模期间d22时,与正常对照组相比,模型组大鼠的体质量、穿格数、直立次数和糖水偏爱率显著降低(P<0.05),说明21 d造模成功。
2.2 应激对大鼠血清中神经递质含量的影响
由表3可知,与正常对照组相比,模型组大鼠血清中NE的含量在造模d9显著降低(P<0.05),HVA和5-HT的含量在造模d15显著降低(P<0.05);模型组大鼠血清中5-HIAA的含量在 d6,d15和d22显著降低(P<0.05),在造模d9和d12显著差异消失,模型组大鼠血清中Tyr的含量只在造模d6出现显著差异(P<0.05),在造模d9~d22显著差异消失;模型组大鼠血清中Trp,L-DOPA,DA,DOPAC和E的含量均未出现显著差异。由结果可知,5-HIAA和Tyr较敏感,大鼠在受到急性刺激后即改变明显,且受到急性刺激后的改变是可以自愈的,但在慢性应激持续到15 d后,5-HIAA仍会出现显著降低,而且降低的程度逐渐增大。因此,5-HIAA和Tyr作为比较敏感的两个指标,可以在行为学指标尚未出现显著差异时就显示出模型组大鼠和正常对照组大鼠的区别。在造模过程中与正常对照组相比,模型组大鼠血清中Trp,L-DOPA,DA,DOPAC和E的含量虽在d22均有降低的趋势,但均无显著差异,因此,这5种内源性成分不能作为抑郁症的判断指标。

Tab.2 Effect of chronic stress on body mass,sucrose preference and open-field activity scores
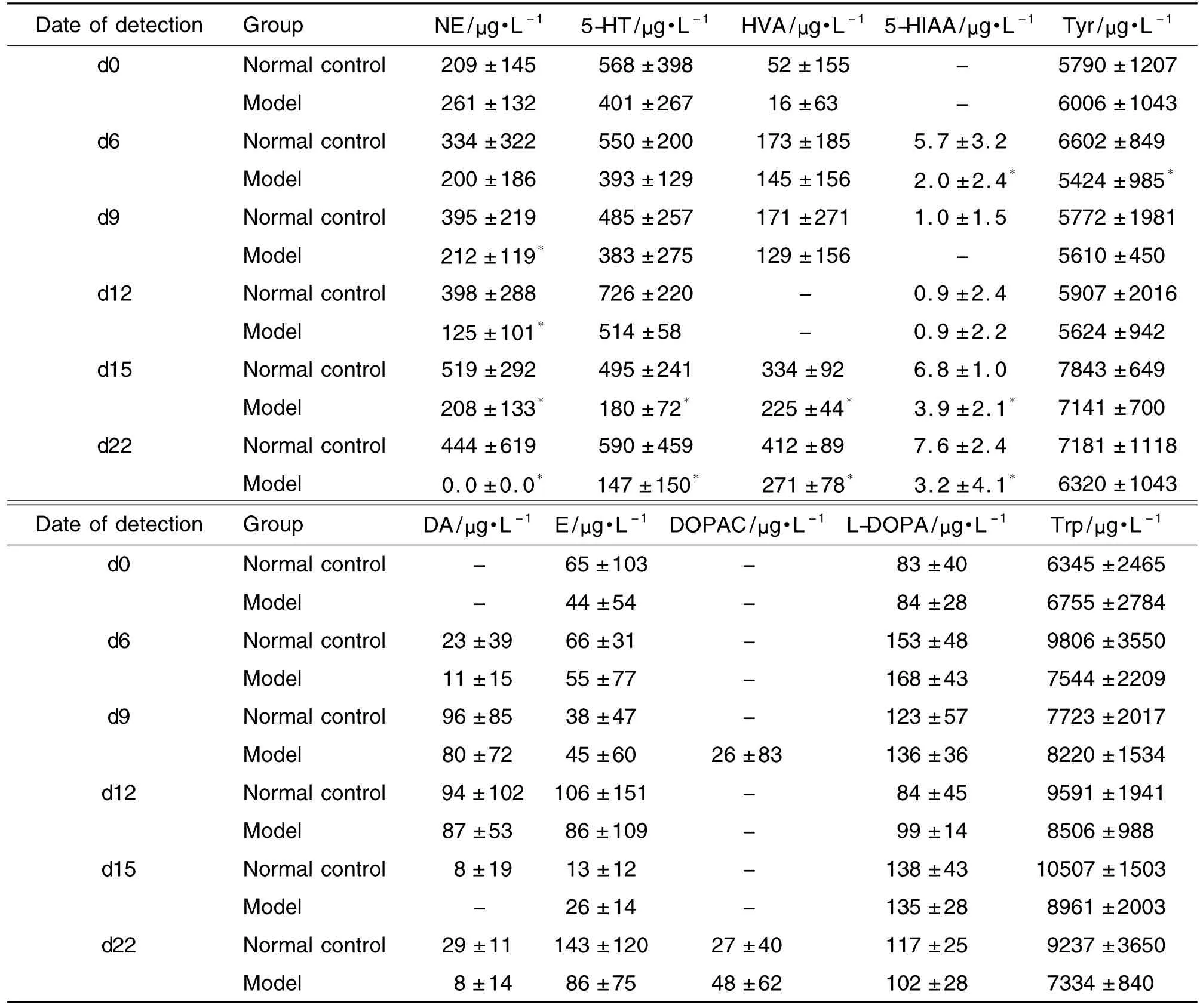
Tab.3 Content of neurotransmitters in serum of UCS model rats
2.3 情志指数的提取及神经递质与其的相关性分析
运用SPSS16.0软件,以模型组中动物行为学指标:大鼠体质量(X1)、直立次数(X3)、糖水偏爱率(X2)和穿格数(X4)4个指标进行主成分分析,找出其综合效应指标,即情志指数(Y1)。分析结果如表4,其中累计贡献率不低于80%且保留特征值大于1的主成分有一个,即情志指数(Y1)。且模型组情志指数与其4个观测指标间的关系式为Y1=-0.919X1+0.907X2+0.958X3+0.879X4。由此可以计算出造模过程中模型组动物的情志指数。
将不同时间模型组神经递质与其情志指数进行相关性分析,找出与情志指数变化相关性较高的神经递质指标,以期用作辅助诊断抑郁症的生化指标。分析结果如表5,其中相关系数大于0.80的有3种,NE,5-HT,HVA与情志指数(Y1)的相关系数分别为0.94(P=0.05),0.88(P=0.11),-0.82(P=0.18),相关性好,且显著性较高。利用相同的计算方法,对正常组动物的行为学与神经递质指标也进行了分析,不存在上述的相关性,在一定程度上可以作为抑郁症诊断与治疗的潜在生物标志物。

Tab.4 Total variance explained on behavior scores of UCS model rats

Tab.5 Correlation coefficient between characteristic index and neurotransmitters of UCS model rats
3 讨论
目前关于抑郁症的发病机制有很多假说,其中单胺类神经递质假说堪称经典。单胺类神经递质主要包括5-HT和儿茶酚胺类神经递质NE,DA,E及它们的代谢产物5-HIAA,HVA,DOPAC等。在本实验室的前期代谢组学的工作中[9]找到的标志物中除了以上神经递质外,还发现Trp与Tyr与抑郁症也有密切的关系。Tyr可在酪氨酸羟化酶的作用下生成L-DOPA,然后通过多巴脱羧酶作用生成DA,DA的侧链β碳原子可再次羟化生成NE,经N-甲基转移酶催化生成E。另外,DA在神经元内还可代谢生成DOPAC和HVA;Trp在色氨酸羟化酶的作用下生成5-羟基色氨酸,再经芳香族氨基酸脱羧酶的作用脱去羧基生成5-HT,在单胺氧化酶作用下生成5-HIAA。
测定神经递质多采用荧光分光光度法[11]、HPLC-FD[12-14]和 HPLC-ECD[15-16],而且同时测定的指标最多为8个。本研究通过考察色谱系统可以同时测定10种物质,所得色谱图中10个峰都达到了基线分离,峰型都很稳定,无杂质干扰峰。本实验室前期已完成了方法学考察研究,线性良好,精密度、稳定性和回收率都符合规定。本研究中DA和DOPAC的含量测定结果标准差较大,可能是DA和DOPAC在血清中的含量低而且大鼠组内个体差异较大造成的。
神经递质之间有错综复杂的关系,现代医学认为[17],大脑神经递质在神经突触间的浓度相对或绝对不足会导致整体精神活动和心理功能的全面性低下状态。罗海鸥等[1]的研究表明,抑郁症患者脑内5-HT和NE的水平降低与抑郁程度有密切关系,丁桂霞等[17]的研究和张媛媛[18]的研究表明大鼠经过慢性应激刺激后,抑郁症模型大鼠皮质、海马、纹状体和下丘脑NE,5-HT和DA及其代谢产物、合成前体的含量明显降低,表明脑组织中神经递质的含量与抑郁症有密切的关系。但是,对脑组织中神经递质测定时需破坏性取样,无法用于临床测定。
肖红等[2]的研究表明,抑郁症患者外周血中神经递质可反映脑中神经递质的状态,杨慧敏等[3]的研究表明,抑郁症患者外周血中5-HT,DA和NE的水平低于正常人。本研究结果表明,抑郁症模型大鼠血液中5-HT,NE和DA含量显著降低,与文献报道[7-8,19]的研究结果一致,且和脑组织的测定结果一致[17-18],说明大鼠血清中单胺类神经递质的浓度与脑组织中神经递质的浓度变化趋势相同,可用血液代替脑组织来监测神经递质的变化。本研究不仅验证了单胺假说,而且揭示了神经递质的动态变化过程。
另外,本实验室前期[20]及近期进行了文拉法辛实时判断和进一步验证,同时对海马和血清进行检测。文拉法辛是5-HT和NE的再摄取抑制剂,是DA的弱抑制剂,是常用的抗抑郁药。结果表明,大鼠经ig给药21 d后,与模型组相比,海马中NE,5-HT含量均显著提高;血清中NE,5-HT和HVA含量均显著提高,DA虽未表现出显著提高,但是其代谢产物HVA的含量显著提高。在一定程度上,可以证明本研究筛选出的指标NE,5-HT和HVA可作为抑郁症诊断评定的重要的潜在生物标志物,与抑郁症关系密切。临床研究表明[21],抑郁症患者经文拉法辛治疗后,血浆中NE和5-HT浓度均显著提高,一定程度上也可以为本研究佐证。
但是,其是否具有代表性、是否是抑郁症特有指标,还需进行进一步药理实验进行验证,给予NE,5-HT和HVA的单体来考察NE,5-HT和HVA是否为抑郁症的特异性标志物,或者从分子药理学的水平考察其影响的酶或基因。
本研究利用CUS配合孤养模型成功建立抑郁大鼠模型,研究了大鼠行为学和血清中10种内源性成分在大鼠抑郁样行为形成过程中的动态变化规律,并对行为学进行主成分分析及它们之间进行了相关性分析。从大鼠行为学的动态变化可以看出造模14 d后大鼠开始出现抑郁状态,造模21 d抑郁模型造模成功;从神经递质的动态变化过程中可以看出5-HIAA和Tyr可作为抑郁症初期判断的重要指标,NE,5-HT和HVA的变化在一定程度上可以定量地反映大鼠的抑郁状态及程度。神经递质的动态变化及相关性分析的结果均证明了5-HT和NE是经典的与抑郁症相关的指标,而且说明了单胺类神经递质的代谢产物也与抑郁症有密切的关系,可作为抑郁症的生物标志物。本研究深入了解CUS配合孤养模型的认识以及为寻找预防和诊断抑郁症的定量指标奠定了基础。
[1]Luo HO,Yang MH,Zhao H,Li SD.Activity of neurotransmitter on encephalofluctuograph in patients with depression[J].J Chin PLA Postgrad Med Sch(军医进修学院学报),2011,32(4):347-348,356.
[2]Xiao H,Yao H,Hou G,Li QJ,Guo SW,Wu RJ.Depression and neurotransmitter metabolites in plasma[J].Nerv Dis Ment Hyg(神经疾病与精神卫生),2002,2(4):209-210.
[3]Yang HM,Li YH,Yang J,Zhao HJ,Xiao S.Relationship between TCM syndrome types and peripheral neurotransmitter of major depression patients[J].Chin J Inf Tradit Chin Med(中国中医药信息杂志),2011,18(4):14-16.
[4]Hong D,Qi YL,Zhang YH,Zhong NT,Zheng XT,Zhou W,et al.The simple and easy to approach's method to building the CUMS depression model of rats[J].China Health Ind(中国卫生产业),2011,8(8):3-4.
[5]Sun Y,Zhang ZJ,Guo YJ,Sui YX,Wang SH,Zhang XB,et al.Effects of the brain-derived neurotrophic factor on the post-stroke depressive behavior[J].Chin J Behav Med Sci(中国行为医学科学),2008,17(5):388-390.
[6]Chang HS,Wang QG,Shi RB,Jin Y.Effects of the active components of sini powder on the behavior and cerebral monoamine neurotransmitters in the rat model of depressive chronic stresss[J].J Beijing Univ Trad Chin Med(北京中医药大学学报),2003,26(5):42-45.
[7]Jia GC,Zheng XY,Zhou YZ,Tian JS,Qin XM.Effect of Xiaoyaosan on chronic unpredictable mild stress model in rats[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2011,17(6):136-140.
[8]Ao LY.Effect of Xiaoyaosan on syndrome of liver depression with spleen insufficiency rat hippocampal(逍遥散对肝郁脾虚模型大鼠海马体内单胺类神经递质及其代谢产物的影响)[D].Beijing:Beijing University of Chinese Medicine,2011.
[9]Xue SY,Zheng XY,Dou CY,Li ZY,Qin XM.Antidepressant mechanism and pharmacodynamic characteristics of venlafaxine and fluxetine based on metabolomics[J].Chin Pharm J(中国药学杂志),2012,47(1):29-33.
[10]Li ZY,Zheng XY,Gao XX,Zhou YZ,Sun HF,Zhang LZ,et al.Study of plasma metabolic profiling and biomarkers of chronic unpredictable mild stress rats based on gas chromatography/mass spectrometry[J].Rapid Commun Mass Spectrom,2010,24(24):3539-3546.
[11]Xiong JY,Zeng N,Zhang CY,Yang J,Liu XS.Effects of Xiaoyao san on chronic unpredictable mild stress model in rats[J].Prog Mod Biomed(现代生物医学进展),2007,7(11):1635-1639.
[12]Chen LP, Wang FW, Duan DM, Zhang YY.Effect of Shuyusan on behavior and concentrations of neurotransmitters in chronic stress depression rats[J].Chin J Inf Tradit Chin Med(中国中医药信息杂志),2009,16(5):37-38.
[13]Wang LL, Ge WH, Fang Y. Determination of catecholamines in urine by high performance liquid chromatography coupled with fluorescence detector[J].China Pharm(中国药师),2009,12(9):1205-1207.
[14]Lu YX,Cui J,Ling XY,Lu ZY.The content determination of the five transmitters in rat brain by RP-HPLC method with fluorescence detector[J].Pharm J Chin PLA(解放军药学学报),2003,19(4):262-263,268.
[15]Wang N,Wu HH,Hou YN.Measurement of monoamine transmitters in discrete rat brain regions by high-performance liquid chromatography coupled to electrochemical detection[J].Med J Nat Defend Forces North China(华北国防医药),2006,18(3):162-165.
[16]Zhao HY,Duan CL,Fan CX,Liu Q,Zhang T,Yang H.A method for simultaneous detection of 8 kinds of monoamine neurotransmitters in biological samples using high perfomance liquid chromatography with electrochemical detection[J].Chin J Anal Chem(分析化学),2009,37(3):330-334.
[17]Ding GX,Hu DJ,Li YT.Research advancement of depressive disorder's pathogenesy[J].Chin Arch Tradit Chin Med(中华中医药学刊),2007,25(4):733-734.
[18]Zhang YY.The research on neurotransmitters'change of depression rat in different encephalic regions(抑郁大鼠不同脑区神经递质变化的研究)[D].Beijing:Chinese PLA General Hospital,2009.
[19]Li SQ,Li XJ,Ma XX,Lu ZM,Gao GJ,Liu J,et al.The detection of neurotransmitters levels in the brain tissue and blood of depressed rats[J].Hebei Med J(河北医药),2008,30(1):15-16.
[20]Cui J,Guo BR,Ren YL,Qin XM,Gao XX.Effects of different extract fractions of Xiaoyaosan on behavior and monoamine transmitters in hippocampus of chronic unpredictable mild stress rats[J].Chin J Pharm(中国医药工业杂志),2012,43(7):584-587.
[21]Yuan YG,Zhang SN.Efficacy of venlafaxine in treatment of selective serotonin reupake inhibitors non-responders with major depressive disorder[J].Chin J Psychiatry(中华精神科杂志),2005,38(1):27-29.

