布地奈德对哮喘小鼠IL-23与 Th17细胞表达的作用研究
闫晓燕 高晓增 逯春洁 许景伟 张俊玲 赵凤珍
支气管哮喘是一种变态反应性疾病,发病机制复杂,Th1/Th2失衡理论仅能部分解释哮喘的发病机制,而最近对Th17细胞的研究则完善并补充了哮喘的具体发病机制[1]。布地奈德作为一种表面激素,是治疗哮喘的主要药物[2,3]。本研究通过建立小鼠哮喘模型,观察布地奈德对小鼠Th17细胞以及白介素-17(IL-17)和白介素-23(IL-23)表达的影响,探讨其治疗哮喘的作用机制。
1 材料与方法
1.1 实验动物与分组 8周龄SPF级雌性Balb/c小鼠30只,平均体重(20.5±1.2)g,河北医科大学实验动物中心提供。随机分为正常组、哮喘组和布地奈德组,每组10只。
1.2 试剂与设备 卵白蛋白 (OVA,美国Sigma);液态铝(上海化学试剂公司);IL-17和IL-23 ELISA检测试剂盒(Bender Medsystem公司);布地奈德雾化吸入混悬液(阿斯利康公司);FACS流式细胞仪、大鼠抗小鼠荧光抗体标记FITC-IL-17、PECD4及红细胞裂解液(购自美国美国BD公司)。
1.3 试验方法
1.3.1 哮喘模型的建立:参照唐配弦的《造血细胞培养技术》进行哮喘模型的制备,于实验的第1、7天腹腔注射致敏原0.2 ml(由0.01%的 OVA 与液态铝各0.1 ml组成)致敏,第14天起给予2.5%OVA溶液雾化吸入,连续激发7 d,并同时给予0.9%氯化钠溶液0.2 ml腹腔注射,每天1次,连续7 d。对照小鼠用等量的0.9%氯化钠溶液代替OVA。布地奈德组于每次激发前30 min给予布地奈德雾化吸入20 min(布地奈德0.2 mg),其他组则用0.9%氯化钠溶液代替。
1.3.2 肺标本制备与支气管肺泡灌洗液(BALF)的收集:于最后次激发后12 h内腹腔注射l%戊巴比妥钠(30 mg/kg)麻醉,迅速剥离肺脏,结扎右肺根,取右肺作为标本,双蒸水冲洗甲醛固定后石蜡包埋切片,进行HE染色并观察病理改变;用静脉留置针行左气管插管并进行灌洗,0.2 ml每次共6次,回收率>90%,离心后经0.9%氯化钠溶液冲洗并调整细胞数为1.0×109/L,然后用细胞计数板计算白细胞总数。
1.3.3 流式细胞检测:摘取小鼠眼球后取血,每只取抗凝全血100 μl,正常对照组另取一管100 μl全血,为空白对照,加红细胞裂解液充分裂解后,经PBS液洗2次后用PE标记抗小鼠CD4抗体,FITC标记抗小鼠IL-17A抗体及其相匹配的同型对照抗体,避光染色10 min后上机检测。
1.3.4 含量测定:ELISA法测定BALF上清液的IL-17和IL-23含量,操作方法按试剂盒说明书进行。
1.4统计学分析应用SPSS 16.0统计软件,计量资料以±s表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 肺组织切片 与对照组小鼠相比哮喘组小鼠支气管壁明显增厚,气道上皮断裂、脱落,气道内杯状细胞肥大增生,且分泌大量黏液及黏液栓形成,支气管炎细胞浸润明显,布地奈德组小鼠支气管的炎症浸润情况较哮喘组明显改善。见图1。
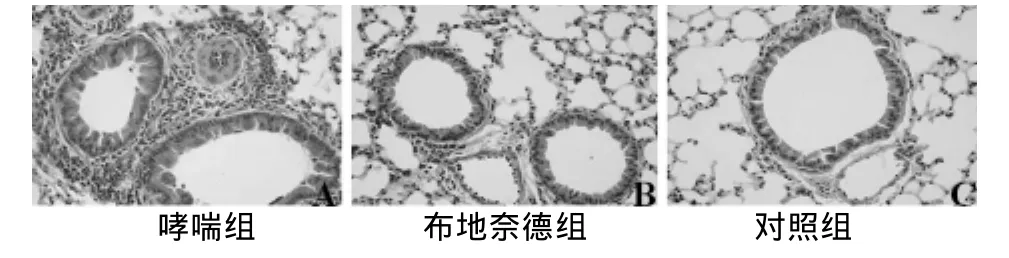
图1 3组小鼠肺组织病理改变(HE×200)
2.2 3组小鼠左肺BALF白细胞总数 对照组BALF中白细胞总数为(1.29±0.16)×105个,哮喘组为(2.05±0.28)×105个,布地奈德组为(1.36 ±0.21)×105个。3组左肺BALF白细胞总数比较,差异有统计学意义(P<0.01),其中哮喘组比正常组、布地奈德组均升高(P<0.05)。
2.3 流式细胞技术检测小鼠Th17细胞 哮喘组、布地奈德组外周血Th17细胞百分比均高于对照组,而BUD组低于哮喘组,差异均有统计学意义(P <0.05)。见图2。
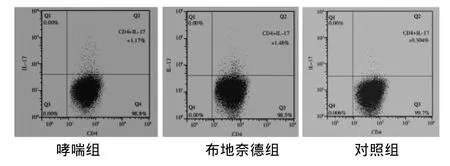
图2 外围血Th17细胞结果
2.4 BALF中IL-17和IL-23的含量 哮喘组、布地奈德组BALF中IL-17和IL-23的含量高于对照组(P <0.05);而布地奈德组低于哮喘组(P <0.05)。见表1。

表1 3组BALF中IL-17和IL-23含量
3 讨论
支气管哮喘是在多因素共同作用下导致的一种变态反应性疾病,其本质是一种由各种炎性细胞参与的慢性气道炎症[4]。布地奈德吸入治疗能有效地减轻气道炎症和治疗哮喘,是目前临床控制哮喘急性期症状和缓解期的重要治疗方法[5]。本研究显示,布地奈德组小鼠支气管及血管周围炎细胞的浸润明显减少,支气管扩张程度明显改善,而且在BALF中白细胞总数也较哮喘组明显减少,表明布地奈德能够有效抑制气道的炎性反应,从而改善通气进并缓解呼吸困进而起到治疗哮喘的作用。Th17细胞是一种不同于Th1/Th2的新细胞亚群[6],它的发现使我们对哮喘的具体发病机制有了更进一步的认识。1L-17被认为是Th17细胞产生的最主要的细胞因子,IL-17可以募集、介导中性粒细胞的局部浸润和组织损伤[7]。本研究结果显示哮喘组小鼠支气管肺泡灌洗液中Th17细胞的比例显著增加,并且通过流式细胞术检测外周血Th17细胞的比例也显示哮喘组小鼠的Th17细胞的比例明显高于其他2组(P<0.05),这提示Thl7细胞一定参与了哮喘的发病过程。而在布地奈德组这一改变并不显著,提示布地奈德的加入减少了Th17细胞的产生,从而降低了IL-17的分泌,进而缓解了哮喘小鼠的炎性反应,从而起到了治疗哮喘的目的。
本实验又选择了IL-23作为检测指标,IL-23是由树突状细胞和其他抗原递呈细胞产生,它的生理学功能主要是通过激活STAT3,在体内对维持Th17细胞分化发挥作用,此外IL-23在Th17细胞的发育、扩增等过程起着关键性的作用[8]。由此可以看出一些与Th17细胞致病性相关的疾病治疗可以将IL-23作为治疗的靶点。本研究结果显示布地奈德组的小鼠的BALF中的IL-23水平明显低于哮喘组,而且在肺组织病理学、外周血Th17细胞计数以及BALF中IL-17水平都与哮喘组存在显著性差异,这就提示布地奈德的干预降低了小鼠IL-23的表达水平,进而抑制了T细胞向Th17细胞分化以及扩增,从而控制了Th17细胞的致病性过程,而大体的表现就是小鼠的哮喘症状得以控制,哮喘的病情得以改善,由此我们推断布地奈德治疗哮喘的机制与降低IL-23的表达水平有关;但是布地奈德组小鼠的检测指标虽然好于哮喘组,但是仍然低于对照组,这就提示我们布地奈德虽然可以从某个靶点对哮喘的进程进行干预,但由于哮喘的具体发病机制并未明了,同时仍然有另外的机制在发挥作用,因此出现了与对照组差异,尤其在BALF中IL-17水平这一指标表现的明显,这为我们的后续研究提供了新的思路。虽然小鼠与人类Th17细胞的分化存在差异[9],小鼠的结果并不能完全等同于人类,但是无论在鼠还是在人类的Th17细胞的分化过程中IL-23都是重要的调控分化因子,故本实验的结果可以为临床上布地奈德治疗哮喘的机制提供重要的依据。
1 Wilson NJ,Boniface K,Chan JR,et al.Development cytokine profile and function of human interleukin 17-producing helper T cells.Nat Immunol,2007,8:950-957.
2 Herold MJ,McPherson KG,Reichardt HM.Glucocorticoids in T cell apoptosis and function.Cell Mol Life Sci,2006,63:60-72.
3 中华医学会儿科学分会呼吸学组《中华儿科杂志》编辑委员会.儿童支气管哮喘诊断与防治指南.中华儿科杂志,2008,46:745-753.
4 Holgate ST,Davies DE.Rethinking the pathogenesis of asthma.Immunity,2009,31:362-367.
5 Kaplan A,Ryan D.The role of budesonide/formoterol for maintenance and relief in the management of asthma.Pulm Pharmacol Ther,2010,23:88-96.
6 Koenders MI,Lubberts E,Oppers-Walgreen B,et al.Blocking of interleukin-17 during reactivation of experimental arthritis prevents joint inflammation and bone erosion by decreasing RANKL and interleukin-1.Am J Pathol,2005,167:141-149.
7 Iwakura Y,Ishigame H,Saijo S,et al.Functional specialization of interleukin-17 family members.Immunity,2011,34:149-162.
8 Bettelli E,Carrier Y,Gao W,et al.Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells.Nature,2006,441:235-238.
9 Chen Z,O’Shea JJ.Regulation of IL-17 production in human lymphocytes.Cytokine,2008,41:71-78.

