光学相干层析成像技术对关节软骨组织解剖分层表现对照研究*
倪艺榕,郭周义,魏华江,刘智明,钟会清
(华南师范大学生物光子学研究院激光生命科学研究所、暨激光生命科学教育部重点实验室,光子中医实验室,广东广州 510631)
0 引言
关节透明软骨组织解剖学的显著特点就是其具有分层结构[1]。在光镜下,依据构成软骨的软骨细胞及基质(软骨的基质由胶原纤维、蛋白多糖和水三种物质组成)中胶原排列为标准,关节软骨可分成4层:浅表层、移行层、辐射层、钙化软骨层[2]。切线层最薄约占软骨厚度的5%~10%,移行层占软骨厚度的40%左右,辐射层是软骨最厚的部分,钙化软骨层为最深层,将软骨和软骨下骨质分开[1]。
软骨细胞、胶原纤维、蛋白多糖和水这四种重要的构成物质在软骨各层中不均匀分布[3]:软骨细胞在切线层近似水平排列,长轴与关节面平行,在移行层软骨细胞近似圆形,散在分布,辐射层的细胞呈柱状排列,钙化软骨层细胞非常少,被周围钙化组织包埋。胶原纤维在表层与关节面平行排列形成致密的网状结构,移行层的胶原纤维呈斜行交错排列,辐射层的胶原纤维对与关节面呈垂直排列。蛋白多糖镶嵌在胶原纤维形成的网架结构内,表层的蛋白多糖含量较低,移行层的蛋白多糖浓度升高,辐射层的蛋白多糖浓度最高,钙化层则不含蛋白多糖。水是关节软骨中含量最丰富的成分,占软骨湿重的65%-80%,水从软骨面到软骨下骨逐层降低[1]。
关节软骨在构成关节形态、维持生物力学特性方面具有重大作用[4]。关节的病变是由软骨基质的改变开始[5],比如骨关节炎(Osteoarthritis,OA)是最易引起关节软骨损伤的原因,该病晚期可致残,严重危害中老年人的身心健康及生活质量[6]。OA病理特征为关节软骨出现原发性或继发性退行性病变。最初的病理变化为软骨细胞功能不全,软骨基质各成分之间的比例失衡,出现软骨面胶原纤维显露,关节面粗糙不平。随着OA病变的进一步发展,骨髓腔开放,新生的结缔组织代替关节软骨面,修复软骨组织。与此同时,炎性介质从滑膜释放入关节腔,促使关节软骨周缘骨赘形成,最终使关节丧失运动功能[7]。因此检测监控软骨各层的改变在关节病变的早期诊断中具有临床意义。
但是在病变早期,以软骨损伤为主的病理改变很难被传统影像学技术发现,因为目前临床常规使用的核磁共振和X片技术不能清晰地呈现软骨组织分层结构[1]。光学相干层析成像(OCT)技术是一种新型的,高分辨率的,非侵入性的检测技术[8]。OCT技术能够利用近红外光产生组织的深度解析图像,由于分辨率高,临床上已经将OCT广泛用于角膜、皮肤组织的活体检测[9]。已有研究提示OCT可以呈现明显的皮肤层次结构,这为关节软骨的分层检测提供了新思路。OCT能否反映软骨组织学上的分层特点?软骨不同层次间的物质构成变化是否能被OCT捕获?为回答这一问题,实验以离体猪膝关节标本为基础,对照分析OCT软骨扫描图像分层表现与组织解剖学分层图像的相关性,为实现OCT运用于临床早期关节软骨病变诊断提供实验依据。
1 材料与方法
1.1 材料
实验用猪离体关节标本10例。关节取材为超市出售的新鲜的(死亡6小时内)猪后腿,猪龄1.5岁,体重平均60公斤,雄性。采用骨钳截取5 mm×5 mm包括骨质的软骨样本,在显微镜下筛选出无隐裂和损伤的关节软骨20例。扫描前用0.9%NaCl溶液浸泡标本,模拟关节滑液。
1.2 OCT图像获取及分析
本实验采用的OCT系统为全光纤维扫描系统[10,11]见图1,中心波长830 nm;带宽40 nm;相干长度10.7μm;系统灵敏度105 dB。在样品表面标记8个点,构成4条直线作为OCT扫描路径,每个样本获得连续的4副图像。将所测的光学深度除以软骨的折射率(1.3975 ± 0.0156)[12],得到实际软骨深度。主要的OCT观察指标一为,OCT对软骨分层的成像能力;二为,OCT对软骨厚度的评估。
1.3 组织学测量
在OCT扫描后依据标记的扫描路径获得软骨组织学样本。10%甲醛固定2 h,脱钙24 h。将组织块用冰冻切片机快速切片,每例标本5张。每张切片均在莱卡(DM2500)的40倍光镜下分别测量软骨组织整体厚度。软骨组织上下界定义为软骨表层至软骨下骨皮质区与软骨深层交界处。
1.4 统计学分析
利用excel2003软件进行数据录入,SPSS 11.0软件对软骨厚度进行方差分析和pearson相关性分析,P<0.05为具有显著性差异。
2 结果与分析
2.1 关节软骨的OCT分层表现
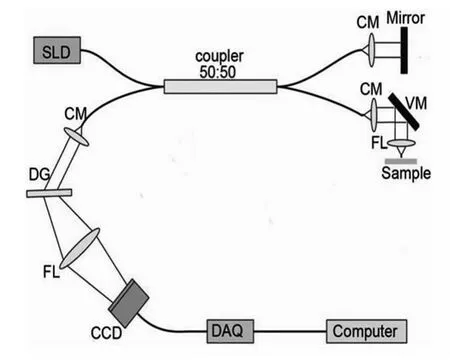
图1 OCT系统示意图:SLD-超辐射发光二极管,C-瞄准仪,DG-衍射光栅,FL-聚焦透镜,DAQ-数据采集系统,VM-振动镜Fig.1 Schematic of spectral domain OCT system:SLD-super luminescent diode,CM-collimator,DG-diffraction grating,FL-focusing lens,DAQ-data acquisition system,VM-vibrating mirror
图2为关节软骨的OCT检测图像。软骨表层呈现强信号带;表层下的移行层信号明显减弱;第三层辐射层为性质均匀的强信号区,该层的厚度最厚;钙化层为一条强信号带。本实验所采用的OCT系统能够对关节软骨的层次进行成像。

图2 关节软骨的OCT图像,显示软骨的四层结构,显示软骨不同层级的不同构象Fig.2 OCT graph of the articular cartilage,showing its four layers,the changes that take place in the formation of the cartilage
2.2 关节软骨的组织学分层表现
组织学依据Ⅱ型胶原排列规律和软骨细胞分布形态可以确定软骨组织分层。第一层为软骨表层,该层胶原纤维致密,按切线方向排列形成致密薄层,亦称为表面切线区;第二层为移行层,胶原纤维细而均匀呈无序状分布,细胞呈平行排列;第三层为辐射层,胶原纤维粗大,胶原纤维呈辐射状排列,胶原细胞纵行排列;第四层为钙化层,其胶原纤维呈网状分布并延伸至皮质骨表面,胶原细胞为球形或柱状。本次组织学研究显示,软骨第一层即表层最薄,第三层辐射层最厚,见图3。
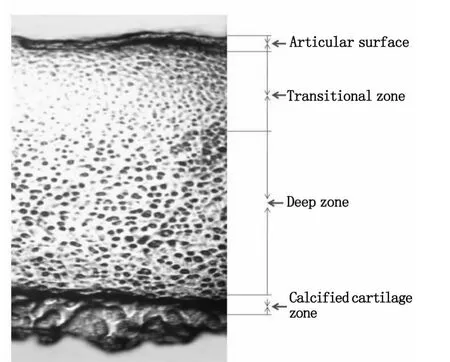
图3 软骨的光学显微镜图像(×40倍),显示软骨的四层结构,显示软骨不同层级的不同构象Fig.3 Photomicrograph of the articular cartilage( ×40),showing its four layers,the changes that take place in the formation of the cartilage
2.3 OCT关节软骨测量厚度与组织学切片测量厚度的相关性
将同一样本的相同部分的OCT图像和组织学图像进行比较。OCT图像可以清晰完整的呈现线形条状带的表层和钙化层的影像,这与组织解剖学结构一致,致密的表层与钙化层都与周围组织有明显的分界线。OCT图像的低信号区同均匀强信号区之间没有明显的分割线而呈现一种渐变的过程,这与组织解剖学的结果也是一致的,解剖图像的移行层同辐射层之间的纤维及细胞的分布改变也是一个渐进的过程,两个层次间没有明显的分隔线。
OCT与解剖切片测量的软骨厚度值(表层至钙化层)见表1。经方差分析,OCT获得的深度值与显微镜测的结果接近,二者之间的差异无显著意义(P>0.05)。即OCT对深度的测量准确性较好,可以对软骨的纵深改变进行评估。

表1 OCT与显微镜测量软骨厚度值比较Tab.1 Comparison between the thickness of cartilage from optical coherence tomography and microscope
3 讨论
3.1 关节软骨组织解剖结构特点
软骨细胞、胶原纤维、蛋白多糖和水这四种重要物质的构成了软骨[13,14]。其中,软骨细胞约占软骨体积的1%-2%,高度分化,但成年软骨增殖能力差,在受到病理刺激后会发生增殖。软骨细胞的主要功能是产生和维持细胞外基质[13,15]。胶原在软骨细胞周围形成纤维网支架结构,主要作用是承重和构形[17]。胶原占软骨干重的50%~60%,其中Ⅱ型胶原占软骨胶原总量的90%~95%[16],Ⅱ型胶原自软骨表面随深度的增加胶原成分逐渐减少。表层的胶原纤维与关节面平行形成的致密的网状结构,可允许小分子(某些离子和葡萄糖)通过,大分子(如蛋白质、透明质酸)不能进入,故其为软骨保护层。移行层的胶原纤维呈斜行交错排列。辐射层的胶原纤维对与关节面呈垂直排列。蛋白多糖镶嵌在胶原纤维形成的网架结构内,由于它是极端亲水分子,故可以吸引大量水分子形成凝胶样,使得关节软骨富含水分,使其富有弹性并减少摩擦力[18]。软骨表层的蛋白多糖含量较低,移行层的蛋白多糖浓度升高,辐射层的蛋白多糖浓度最高,钙化层不含蛋白多糖。水是关节软骨最丰富的成分,占软骨湿重的65%-80%,水从软骨面到软骨下骨逐层降低[19]。切线层纤维与细胞平行精密排布水分基本无法透过,胶原纤维粘连蛋白和蛋白质的水含量高。移行层的水含量降低,辐射层的水含量最低。
3.2 OCT对软骨分层的呈现
OCT技术由于具有无辐射、无创伤、可定量、分辨率和敏感度高等优越性,在眼科[20]、胃肠道[21]、心血管[22]、皮肤[23]等领域中已经取得了多方面的进展,也越来越受到临床工作者的重视。实验应用OCT对关节软骨样本模型进行了成像和定量分析,并将同一样本的相同部分的OCT图像和组织学图像进行比较,发现所采用的OCT系统能够清晰呈现软骨的分层结构。软骨表面由于软骨纤维同软骨细胞构成了致密的切线层,由于Fresnel反射呈现强信号带;表层下的移行层信号明显减弱;第三层辐射层为性质均匀的强信号区。OCT图像的低信号区同均匀强信号区之间没有明显的分割线而呈现一种渐变的过程,这与组织解剖学的结果是一致的,解剖图像的移行层同辐射层之间的纤维及细胞的分布改变也是一个渐进的过程,两个层次间没有明显的分隔线。最深层钙化层为一条强信号带。此外,OCT对深度的测量准确性较好,可以对软骨的纵深改变进行评估。
综上研究结果提示,将OCT应用于软骨的检测,可以弥补目前临床使用的关节病变常规检测手段对呈现软骨组织解剖分层结构的不足。同时,可以对早期关节软骨各层的变化及软骨厚度的改变进行定量,更便于临床监测和干预措施的效果评估。OCT系统对深度的测量具有较高的准确性;随着这项技术在临床的推广运用,OCT必将成为早期关节病变临床诊断的有力工具。
[1]MUEHLEMAN C,MAJUMDAR S,ISSEVER A S,et al.X-ray detection of structural orientation in human articular cartilage[J].Osteoarthritis Cartilage,2003,12(2):97-105.
[2]YOSHIOKA H,HAISHI T,UEMATSU T,et al.MR microscopy of articular cartilage at 1.5 T:orientation and site dependence of laminar structures[J].Skeletal Radiology,2002,31(9):505-510.
[3]HUBER M,TRATTNIG S,LINTNER F.Anatomy,biochemistry,and physiology of articular cartilage[J].Investigative Radiology,2000,35(10):573-580.
[4]BONIFACIO A,BELEITES C,VITTUR F,et al.Chemical imaging of articular cartilage sections with Raman mapping,employing uni-and multi-variate methods for data analysis[J].Analyst,2010,135(12):3193-3204.
[5]AIGNER T,MCKENNA L.Molecular pathology and pathobiology of osteoarthritic cartilage[J].Cellular and Molecular Life Sciences,2002,59(1):5-18.
[6]REGAN E,FLANNELLY J,BOWLER R,et al.Extracellular superoxide dismutase and oxidant damage in osteoarthritis[J].Arthritis Rheum,2005,52(11):3479-3491.
[7]RUTGERS M,SARIS D B,YANG K G,et al.Joint injury and osteoarthritis:soluble mediators in the course and treatment of cartilage pathology[J]. Immunotherapy, 2009,1(3):435-445.
[8]HUANG D,ZHANG W,ZHONG H,et al.Optical clearing of porcine skin tissue in vitro studied by Raman microspectroscopy[J].J Biomed Opt,2012,17(1):015004.
[9]ZHONG H,GUO Z,WEI H,et al.In vitro study of ultrasound and different-concentration glycerol-induced changes in human skin optical attenuation assessed with optical coherence tomography[J].J Biomed Opt,2010,15(3):036012.
[10]XIONG H L,GUO Z Y,LI S X,et al.in vivo detection of Hirschsprung's disease by optical coherence tomography in rats[J].Physics in Medicine and Biology,2013,58(5):1549-1561.
[11]SHEN Z Y,WANG M,JI Y H,et al.Transverse flow velocity quantification using optical coherence tomography with correlation[J].Laser Physics Letters,2011,8(4):318-323.
[12]WANG K,WU J,DAY R E,et al.Utilizing confocal microscopy to measure refractive index of articular cartilage[J].Journal of Microscopy,2012,248(3):281-291.
[13]ALMONTE-BECERRIL M,NAVARRO-GARCIA F,GONZALEZ-ROBLES A,et al.Cell death of chondrocytes is a combination between apoptosis and autophagy during the pathogenesis of Osteoarthritis within an experimental model[J].Apoptosis,2010,15(5):631-638.
[14]HAJJAJI H E,WILLIAMS J M,DEVOGELAER J P,et al.Treatment with calcitonin prevents the net loss of collagen,hyaluronan and proteoglycan aggregates from cartilage in the early stages of canine experimental osteoarthritis[J].Osteoarthritis Cartilage,2004,12(11):904-911.
[15]PUDLAS M,BRAUCHLE E,KLEIN T J,et al.Non-invasive identification of proteoglycans and chondrocyte differentiation state by Raman microspectroscopy[J].J Biophotonics,2013,6(2):205-211.
[16]LEMOINE J K,LEE J D,TRAPPE T A.Impact of sex and chronic resistance training on human patellar tendon dry mass,collagen content,and collagen cross-linking[J].American Journal of Physiology-Regulatory Integrative and Comparative Physiology,2009,296(1):R119-R124.
[17]SHEPHERD J H,GHOSE S,KEW S J,et al.Effect of fiber crosslinking on collagen-fiber reinforced collagen-chondroitin-6-sulfate materials for regenerating load-bearing soft tissues[J].Journal of Biomedical Materials Research,Part A,2013,101A(1):176-184.
[18]LI J J,SUN H,SUN D,et al.Biomimetic multicomponent polysaccharide/nano-hydroxyapatite composites for bone tissue engineering[J].Carbohydrate Polymers,2011,85(4):885-894.
[19]LEONE G,BIDINI A,LAMPONI S,et al.States of water,surface and rheological characterisation of a new biohydrogel as articular cartilage substitute[J].Polymers for Advanced Technologies,2013,24(9):824-833.
[20]RODRIGUES E B,MEDEIROS F,MENNEL S,et al.Optical coherence tomography in ophthalmology[J].Journal of Ophthalmology,2012,134569
[21]TESTONI P A,MANGIAVILLANO B.Optical coherence tomography in detection of dysplasia and cancer of the gastrointestinal tract and bilio-pancreatic ductal system[J].World Journal of Gastroenterology,2008,14(42):6444-6452.
[22]RABER L,RADU M D.Optimising cardiovascular outcomes using optical coherence tomography-guided percutaneous coronary interventions[J].Eurointervention,2012,8(7):765-771.
[23]ALAWI S A,KUCK M,WAHRLICH C,et al.Optical coherence tomography for presurgical margin assessment of non-melanoma skin cancer-a practical approach[J].Experimental Dermatology,2013,22(8):547-551.

