COPD患者呼出气NO水平与肺功能相关关系的研究
首都医科大学怀柔教学医院(101400)王瑜君
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以气流受限为特征的肺部疾病,气流受限不完全可逆,并呈进行性发展。主要临床表现为慢性咳嗽、咳痰、气短或呼吸困难、喘息和胸闷。COPD的各种危险因素都可产生类似的炎症过程,从而导致COPD的发生[1]。但吸烟是目前公认的COPD已知最重要的危险因素。氧化应激在COPD放大机制中起着重要作用,在急性加重期更为严重。吸入烟雾和其他颗粒可以产生氧化剂,这些氧化剂激活炎性细胞如巨噬细胞和中性粒细胞释放细胞因子如IL-8、TNF-α等。氧化应激对气道与肺产生很多有害的影响,包括炎性基因的激活,抗蛋白酶的抑制,黏膜分泌的增多,浆液渗出的增多。其中很多的有害作用由过氧化亚硝酸盐介导,这种物质由超氧阴离子和一氧化氮相互作用产生。
一氧化氮(NO)是体内的一种信号分子,能够穿透其他细胞膜并调节其功能,介导了很多生理和病理过程(如炎症)。NO也可作为机体内重要的内源性调控分子,在许多不同的生物学反应中起着信使的作用。NO的形成由一氧化氮合酶(NOS)介导,一氧化氮合酶(NOS)的亚型有三种,分别称为神经元型NOS(nNOS)、内皮型NOS(eNOS)和诱导型NOS(iNOS)。nNOS 和eNOS合称为结构型NOS(cNOS),其活性均为Ca2+依赖性,受细胞内Ca2+浓度的生理性调节。肺内的血管内皮细胞、神经元、血小板以cNOS为主,在缓激肽、乙酰胆碱、组胺、白三烯、血小板激活因子的影响下可以催化L-精氨酸生成NO分子。iNOS活性为非Ca2+依赖性,肺内的巨噬细胞、中性粒细胞、血管平滑肌和成纤维细胞以iNOS为主,受各种细胞因子的诱导,也可催化L-精氨酸生成NO分子,这些细胞因子包括肿瘤坏死因子,白细胞介素-1,干扰素-γ等炎性介质和内皮素。
1991年Gustafsson首次报道呼出气体中检测NO[2]。有研究表明,呼出气中的NO来自于上下部气道的上皮细胞,也可能与肺内血管内皮细胞生成的NO由肺组织向气道弥散有关[3]。目前已有大量的文献报道关于哮喘患者呼出气NO的研究表明,呼出气NO水平在哮喘患者中升高[4],测定呼出气NO水平是一种简单易行、非侵入性的方法,对成人、儿童均适用。呼出气NO水平与多数呼吸道炎症临床标志物有一定的相关性,如与气道高反应性[5],诱导痰嗜酸性粒细胞数[6]及支气管肺泡灌洗[7](BAL-呼吸道炎症评估的金标准)相关。此外,哮喘病人其呼出气NO水平与哮喘病情相关,患者临床病情加重前会出现呼出气NO水平的增高[8]。对哮喘患者呼吸道炎症进行系统性治疗:包括吸入性皮质激素,白三烯拮抗剂进行抗炎治疗可降低其呼出气NO水平[9]。但COPD与哮喘是不同炎症致病机理的慢性呼吸道疾病,目前有关COPD呼出气NO的研究目前尚不成熟,尚存在不一致的研究结论。
基于以上认识,我们的试验选择COPD急性加重期和稳定期患者为受试对象,进行呼出气NO、肺功能测定,探讨呼出气NO水平与气流受限程度的相关性及探讨呼出气NO能否反映气流受限程度情况。
1 研究对象
此试验研究对象分为三组,分别为:健康对照组为20例健康成人,男6例,女14例,平均年龄65±5岁,均为从未吸烟者;25例COPD稳定期患者,男16例,女9例,平均年龄65±6岁,平均吸烟指数486±67年×支/日;23名COPD急性加重期患者,男16例,女7例,平均年龄69±6岁,平均吸烟指数564±80年×支/日。健康对照组近2周无上呼吸道感染、无呼吸道症状、无近期服药史、既往无慢性病史。COPD患者均选择按照2006年GOLD(Global Initiative for Chronic Obstructive Lung Disease,GOLD)[10]诊断标准确诊的我院呼吸科门诊和病房的COPD患者,所有COPD患者其一秒钟用力呼气容积占预计值百分比(FEV1%预计值)均<80%,一秒钟用力呼气容积/用力肺活量(FEV1/FVC)均<70%,且两个月内无明显变化,吸入400µg沙丁胺醇后FEV1占预计值%可逆性<12%,且无呼吸道感染、活动性肺结核、心律失常、急性心肌梗塞等病史。过敏性疾病、哮喘及其他呼吸系统疾病者被排除。稳定期COPD患者在最近8周之内无呼吸困难、喘息、痰量增加及脓痰出现等急性加重的症状。急性加重期COPD患者出现咳嗽、咳痰、气短和(或)喘息加重,痰量增多,呈脓性或黏脓性,可伴发热等炎性明显加重的表现。
2 实验流程和技术路线
分别测定健康对照组、COPD稳定期组、COPD急性加重期组呼出气NO水平,应用统计学方法比较有无差异性。测定COPD稳定期组肺功能FEV1占预计值%,并将其与呼出气NO水平进行相关性分析。测定COPD急性加重期组患者肺功能FEV1占预计值%,并将其与呼出气NO水平进行相关性分析(见附图1)。
3 实验方法
3.1 呼出气NO水平的测定 应用呼出气一氧化氮测定系统测定健康对照者、稳定期及急性加重期COPD患者呼出气NO水平。美国胸科协会推荐了成人及儿童呼出气NO水平测量技术的标准。采用标准化的测量仪器,受试者吸入无NO气体至肺总容量,并以50mL/s 的恒定气流呼气(设定固定的流速是由于呼出气NO水平有流速依赖性),使呼出气到达一个稳定的平台期,得到测量结果,需要重复测量3次,3次的测量结果要达到基本一致。
3.2 肺功能的测定 用肺功能测定仪(Master Screen IOS)对健康对照者、COPD稳定期及急性加重期患者行第一秒用力呼气量占预计值百分比(FEV1%预计值)测定。最先正常呼吸,记录3~5个潮气呼吸后缓慢呼气至功能残气位(function residual volume,FRV),接着缓慢吸气至肺总量位(total lung capacity,TLC),之后尽最大力量快速呼气至没有气体再呼出(呼气时间至少持续6秒),再用力快速完全吸气回到TLC。至少重复3次操作但通常不超过8次,得到3次可接受的流速—容量环,如果2个FVC或FEV1的最大变异值在0.150L之内可以接受。
操作参照美国胸科协会/欧洲呼吸病协会工作组系列报告:肺功能测试标准化(2005年)中制定的操作标准[11]。
4 统计学方法
采用SPSS11.0软件进行数据分析,所有计量资料均进行正态性检验,凡符合正态性分布计量资料数据以均数±标准差(Mean±SD)表示。组间显著性检验用方差分析,相关性检验采用直线相关分析,在所有的分析里,P<0.05考虑有统计学差异。
5 结果
5.1 健康对照组、COPD稳定期组及急性加重期组基本临床资料 三组受试者的年龄没有统计学差异(P>0.05);三组的FEV1%pre、FEV1/FVC%间有统计学差异(P<0.05),COPD稳定期组及急性加重期组均低于健康对照组(见附表1)。
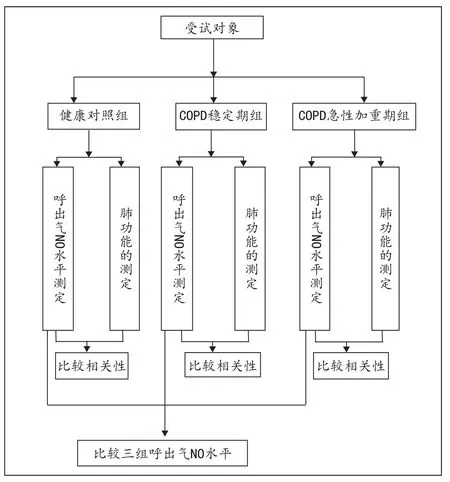
附图1 实验流程
5.2 呼出气NO水平 COPD稳定期患者呼出气NO水平(17.6±9.6ppb)明显高于健康对照组(11.1±5.84ppb),有统计学差异(P<0.05)。COPD急性加重期患者呼出气NO水平(23.1±8.3ppb)明显高于COPD稳定期患者(17.6±9.6ppb)和健康对照组(11.1±5.84ppb),有统计学差异(P<0.05,见附图2和附表2)。
5.3 呼出气NO水平与肺功能FEV1%预计值的相关性 COPD稳定期患者呼出气NO水平与FEV1%预计值存在着明显的负相关性(P<0.01,r=-0.656)。COPD急性加重期患者呼出气NO水平与FEV1%预计值存在着明显的负相关性(P<0.01,r=-0.542)。
6 讨论
本研究选择COPD稳定期和急性加重期患者为受试对象,进行呼出气NO水平、肺功能的检测,探讨呼出气NO水平和气流受限程度的相关性。结果显示,COPD急性加重期患者呼出气NO水平明显高于COPD稳定期患者和健康对照组,COPD稳定期患者呼出气NO水平明显高于健康对照组,COPD稳定期患者呼出气NO水平与FEV1%预计值存在着明显的负相关性,COPD急性加重期患者呼出气NO水平与肺功能FEV1%预计值存在着明显的负相关性。
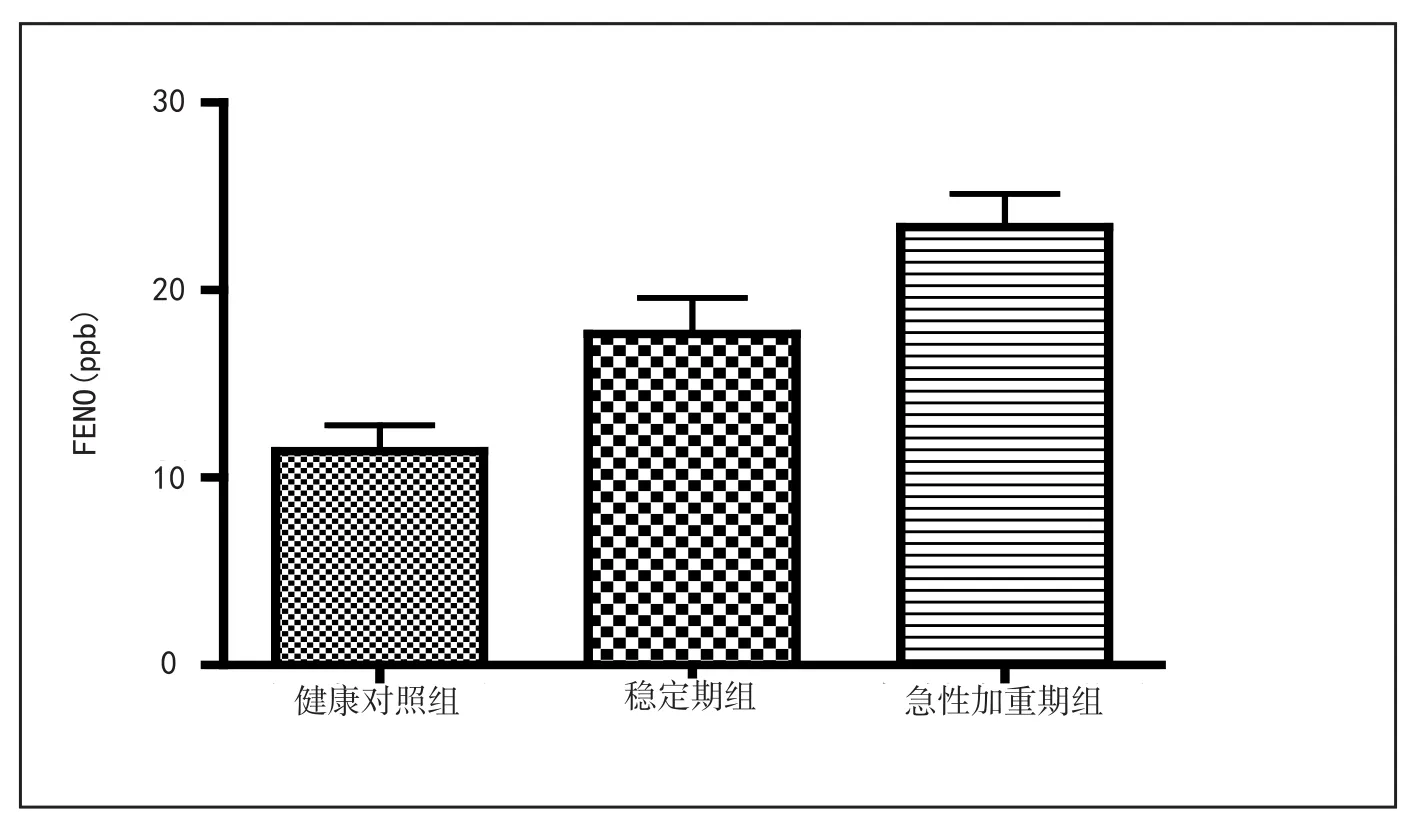
附图2 健康对照组、COPD稳定期组、COPD急性加重期组呼出气NO水平的比较
6.1 健康对照人群与COPD患者呼出气NO水平的比较 本试验发现COPD稳定期患者呼出气NO水平明显高于健康对照组,COPD急性加重期患者呼出气NO水平高于COPD稳定期患者和健康对照组,这与以前的研究者所作的有关呼出气NO水平方面的研究结论相同[12][13]。稳定期COPD患者呼出气NO测定水平高于健康对照组的可能机制是:①COPD稳定期患者存在气道慢性炎症,炎性细胞受细胞因子诱导催化L-精氨酸生成NO分子;②呼出气NO是体内一种高度活跃的化学物质,可与肺毛细血管中的血红蛋白快速结合而被清除,当COPD病人出现气流受限及通气血流障碍时,呼出气NO清除减少导致呼出气NO水平升高。现有大量研究表明,当痰中嗜酸性粒细胞增多时,哮喘患者呼气中NO水平明显增加,呼出气NO水平与痰嗜酸性粒细胞水平呈正相关关系,其可能的机制是:气道产生过敏性炎症后,重要的转录因子NF-kappaB发生上调[14],导致iNOS升高,使呼出气NO增多,而此转录因子对表达嗜酸性粒细胞趋化因子也至关重要。因此转录因子上调后而使气道嗜酸性粒细胞增多,故呼出气NO水平与痰嗜酸性粒细胞水平呈正相关。COPD急性加重期呼出气NO明显升高,这可能与急性加重期感染加重,肺内巨噬细胞、中性粒细胞受细胞因子诱导催化L-精氨酸生成NO分子增多或气道产生了嗜酸性粒细胞增多的炎症有关。
6.2 呼出气NO水平与肺功能FEV1%预计值的相关性比较 COPD是一种常见的慢性呼吸道疾病,其特征为不完全可逆的气流受限,气道阻塞和气流受限是COPD最重要的病理生理改变。
肺功能检查是判断气流受限的主要客观指标,FEV1%预计值是中、重度气流受限的良好指标,其减少能反映气道阻塞的程度,监测FEV1%预计值的变化可以了解患者的病情变化,而本研究发现呼出气NO水平与FEV1%预计值存在负相关关系,这与之前的研究者Philip R[15]和Ansarin K[16]的研究结果一致,这种现象可能的原因是:COPD发病的关键机制是气道、肺实质及肺血管的炎症,中性粒细胞及巨噬细胞等多种炎性细胞通过释放TNF-α、IL-1、IL-8、干扰素-γ等多种生物活性物质参与慢性炎症的发生及发展,而气道的慢性炎症及反复修复可使管腔狭窄及破坏支气管壁软骨使支气管失去正常的支架结构,且气道慢性炎症时细胞浸润、黏膜充血水肿及分泌物增多等这些都可造成气道阻塞,气流受限,同时COPD的气道慢性炎症时,炎性细胞受细胞因子诱导可催化L-精氨酸生成NO分子导致呼出气NO水平升高。这种研究结果表明,呼出气NO水平能够部分反映气流受限的程度,呼出气NO水平的测定可能提供了一个更简单和无创的方法来监测呼吸道疾病的活动性和气道受限的程度。

附表1 COPD稳定期组、急性加重期组与健康对照组的基本临床资料

附表2 健康对照组、COPD稳定期组及急性加重期组的数据资料
7 结论
胸部X线检查也有助于确定肺过度充气的程度及与其他肺部疾病鉴别[17]。COPD是一种可以预防和可以治疗的常见疾病,其特征是持续存在的气流受限。气流受限呈进行性发展,伴有气道和肺对有害颗粒或气体所致慢性炎症反应的增加。急性加重和合并症影响患者整体疾病的严重程度。但笔者通过对COPD患者呼出气NO水平的测定及与肺功能FEV1%预计值相关性比较,发现在COPD中,呼出气NO水平在一定程度上可以反映气流受限程度,可作为无创性的监测COPD病情严重程度的生物标志物之一。

