骨肽对成骨细胞骨形成蛋白2表达影响的实验研究
崔晓明 韩 斌
成骨细胞增殖与分化是骨折愈合的关键步骤,成骨细胞数目增加、细胞外基质成熟和矿化,可以填补骨缺损并促进骨折愈合。骨肽能够调节骨代谢,并具有刺激成骨细胞增殖、促进新骨形成等药理作用,目前广泛应用于骨折愈合、骨代谢疾病、风湿及类分湿性关节炎的修复治疗[1]。本研究体外分离培养成骨细胞,观察骨肽对成骨细胞的增殖作用,并检测其骨形成蛋白2(BMP2)表达的影响,为骨肽的临床应用提供理论基础。
1.材料与方法
1.1 材料
1.1.1 实验动物:Wistar乳鼠购自吉林大学动物实验中心。
1.1.2 主要试剂:DMEM-H培养基、胎牛血清(美国Gibco公司);骨肽(安徽宏业药业有限公司);FACScan流式细胞仪(美国BeckmanCou lter公司);BMP2酶联免疫试剂盒(武汉新启迪生物科技有限公司);全自动酶标仪(英国BMG Labtech公司)。
1.2 方法
1.2.1 颅盖骨分离成骨细胞:取2~3天龄乳鼠20只,处死后75%酒精浸泡2分钟,无菌手术分离颅盖骨,无菌PBS液清洗2~3次,将颅盖骨至于无血清DMEM培养基中,利用组织剪将颅盖骨破碎并加入0.25%胰蛋白酶,37℃消化30分钟。加入含血清培养基终止消化。然后在37℃条件下,加入1.2g/L I型胶原酶消化45分钟后加入冷 PBS终止消化。吸取上清液,1000r/min离心10分钟,培养液冲洗细胞,37℃、5%CO2及饱和湿度条件下,以1×106密度将细胞悬液接种于含10%小牛血清的DMEM培养基中培养。
1.2.2 骨肽对成骨细胞的增殖影响:取对数生长的第3代成骨细胞,无血清培养基培养6小时,然后更换含不同浓度骨肽培养基培养24小时,胰蛋白酶消化细胞,制备细胞悬液,乙醇固定后用PI染色,以流式细胞仪分析细胞周期,并计算细胞增殖指数
1.2.3 骨肽对成骨细胞作用:骨肽按照浓度分为0.02mg/ml、0.08mg/ml、0.32mg/ml三个剂量组,对照组加入正常细胞培养基。分别在24小时、48小时、72小时利用ELISA试剂盒检测细胞培养液BMP2含量。
2.结果
2.1 骨肽对成骨细胞增殖的影响 不同剂量浓度骨肽作用24小时后,各组的光密度值与对照组相比均增高,0.002mg/ml剂量组光密度值与对照组相比 P<0.05,其中0.08mg/ml,0.32mg/ml剂量组光密度值与对照组相比 P<0.01,并存在剂量依赖关系(结果见图1)。
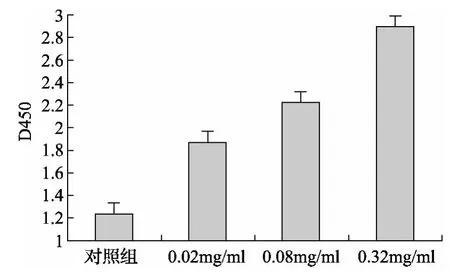
图1 不同剂量骨肽对成骨细胞增殖的影响
2.2 骨肽对成骨细胞BMP2表达的影响 在24小时时间点,骨肽各浓度组与对照组相比BMP2表达量增高(P<0.05)。在48小时时间点,与对照组相比骨肽各浓度组BMP2表达量依然增高,其中0.08mg/ml剂量组BMP2表达量增高明显,与对照组相比有显著性差异(P<0.01),而0.02mg/ml和0.32mg/ml两个剂量组BMP2表达量与24小时时间点相比无统计学差异。在72小时时间点,骨肽各浓度组BMP2表达量与对照组相比无统计学差异(结果见表1)。
表1 不同剂量、不同时间骨肽对成骨细胞BMP2表达的影响(±s)

表1 不同剂量、不同时间骨肽对成骨细胞BMP2表达的影响(±s)
注:*与对照组相比P<0.05,Δ与对照组相比P<0.01。
骨肽(mg/ml) 成骨细胞BMP2表达量24小时 48小时 72小时对照组 0.23+0.04 0.25+0.03 0.22+0.05 0.02 0.32+0.05* 0.33+0.08* 0.25+0.03 0.08 0.37+0.11* 0.48+0.12Δ 0.24+0.07 0.32 0.38+0.12* 0.39+0.05*0.24+0.05
3.讨论
骨肽是从猪和胎牛四肢骨中经高科技生物技术精制提取的一种新型骨病治疗药物,含有机钙、磷、无机钙、无机盐、微量元素、氨基酸等多种骨代谢的活性肽类代谢因子,通过各种骨生长因子直接作用于成骨细胞,可诱导骨髓细胞转化为成骨细胞,促进骨髓成骨作用,同时调节骨代谢,直接调节骨钙磷代谢,增加骨钙磷沉积,刺激成骨细胞增殖促进骨质合成[2,3]。
在骨折缺损的愈合中,成骨细胞的分裂、增殖及骨基质沉积是形成新生骨和骨重建的重要过程,成骨细胞的增殖、分化受多种生长因子的调节[4]。转移生长因子(Transforming growth factor,TGF)超家族对成骨细胞的形态学发生、增殖、分化起重要作用[5]。骨形态发生蛋白(Bone morphogenetic protein,BMP)是转化生长因子-β(TGF-β)超家族中的一组多功能细胞因子,具有诱导间充质细胞迁徙、增殖、分化,最终导致软骨、骨形成的作用[6]。Wegman等[7]研究表明成骨细胞的功能之一是分泌骨形成蛋白-2(BMP-2),而Boumah等[8]则认为BMP-2有很强的促进成骨细胞分化和诱导体外成骨的能力,被认为是TGF-β家族中活性最高且唯一能单独诱导成骨的因子,其高表达可以进成骨细胞的增殖与分化。
本研究中,骨肽各浓度组在24小时均可引起BMP2表达升高,提示骨肽可能是通过促进BMP2转录表达进而完成刺激成骨细胞分裂增殖的能力。在48小时时间点,与对照组相比骨肽各浓度组BMP2表达量依然增高,其中0.08mg/ml剂量组BMP2表达量增高明显,提示在该浓度和作用时间点刺激BMP2表达能力最强。在72小时,各剂量组对BMP2的表达无明显影响,分析可能由于骨肽作用强度已经达到BMP2表达上限,故BMP2表达无明显改变。
1 邓利娟,任 雪,范慧红.骨肽及复方骨肽注射液降压物质的研究[J].中国生化药物杂志,2010,31(4):231 -234.
2 阮莲芝.骨肽注射液的临床应用[J].中国临床药学杂志,2008,17(5):320-323.
3 施莱.骨肽注射液在骨科的应用进展[J].社区医学杂志,2010,8(7):38-39.
4 Kaur G,Valarmathi M T,Potts JD.Regulation of osteogenic differentiation of rat bone marrow stromal cells on 2D nanorod substrates[J].Biomaterials,2010,31(7):1732 -1741.
5 KIM Y J,CHUNG J Y,LEE SG,etal.Arsenic trioxide- induced apoptosis in TM4 Sertoli cells:The potential involvement of p21 expression and p53.phosphorylation[J].Toxicology,2011,285(3):142 -151.
6 CHEN D,HARRIS M A,ROSSINI G,etal.Bone morphogenetic protein 2(BMP-2)enhances BMP-3,BMP-4,and bone cell differentiation marker gene expression during the induction ofmineralized bone matrix formationin cultures of fetal rat calvarial osteoblasts[J].Calcif Tissue Int,1997,60(3):283-290.
7 WEGMAN F,BIJENHOF A,SCHUIJFF L,etal.Osteogenic differentiation As a result of BMP-2 plasmid DNA based gene therapy in vitro and in vivo[J].Eur Cell Mater,2011,21:230-242.
8 BOUMAH C E,SELVAMURUGAN N,PARTRIDGE N C.Transcription in the osteoblast:regulatory mechanisms utilized by parathyroid hormone and transforming growth factor- beta[J].Prog Nucleic Acid Res Mol Biol,2005,80:287 -321.

