尤瑞克林对局灶性脑缺血大鼠神经细胞凋亡的影响
张学艳 张幽燕 常红云
脑血管病是一种常见病和多发病,其发病率、致残率、病死率均较高。脑缺血急性期及时恢复脑血流灌注,改善缺血区血供,一直是治疗缺血性脑卒中的重点。尤瑞克林主要成分为人尿激肽原酶,能分解产生血管缓激肽和血管舒张素,实验研究表明:应用尤瑞克林能够减少脑梗死面积[1],减轻神经功能受损,其机制可能与促进血管新生和神经细胞增殖、迁移、分化、减少细胞凋亡等有关[2]。药效学研究显示,尤瑞克林可选择性扩张缺血部位细小动脉,改善梗死灶内供血[3],并促进损伤部位新生血管生成[4],从而对急性脑梗死起到治疗作用。脑缺血的发病机制复杂,其中细胞凋亡仍然是脑缺血损伤机制研究的重要内容。凋亡是指机体在生理条件下受到刺激后,经过多种信号转导引起细胞程序性死亡的过程。关于尤瑞克林从细胞凋亡角度对脑保护作用机制国内笔者很少见报道。本研究从细胞凋亡角度探讨尤瑞克林的保护作用,为临床应用尤瑞克林提供依据。
1 材料与方法
1.1 实验动物与分组 选用成年健康SD大鼠60只,雌雄各30只,体重250~300 g。实验动物级别:普通级。随机分为假手术组、单纯缺血组、尤瑞克林组(低剂量组、中剂量组、高剂量组),每组12只。参照文献[5]给药:尤瑞克林组用灭菌0.9%氯化钠溶液分别稀释为3.75 ×10-3、8.75 ×10-3、17.25 ×10-3PNA单位/kg,给药量1 ml/kg,分别于缺血后30 min及23.5 h 2次经舌下静脉给药。余2组予同等剂量0.9%氯化钠溶液。
1.2 试剂与仪器 注射用尤瑞克林(广东天普生化医药股份有限公司提供)。bcl-2、bax蛋白测定试剂盒:武汉博士德生物工程公司。连续变倍体视显微镜160×:桂林仪器厂;CIAS-1000型图像分析仪:北京大恒图象视觉有限公司;LKBⅢ型超薄切片机:瑞典;电子天秤:上海天平仪器厂;石英自动双重纯水蒸馏器:江苏丹阳门石英玻璃厂;烘片、烤片机:孝感市电子仪器厂。
1.3 局灶性脑缺血模型制备 参照Longa等采用线栓法[6]制备MCAO,大鼠手术前12 h禁食不禁水,健康SD大鼠称重后,按10%水合氯醛0.3 ml/100 g腹腔注射麻醉。固定,常规消毒,取颈正中切开,剪开浅筋膜,暴露胸锁乳突肌、右侧颈总动脉、迷走神经、颈外动脉、颈内动脉、翼腭动脉,在近心端结扎颈总动脉,在颈总动脉分叉处结扎颈外动脉及翼腭动脉。距颈总动脉分叉处近心端0.5 cm处剪一小口,插入头端烧成圆钝形直径为0.235 mm的尼龙鱼线,进线长度18~19 mm在大脑中动脉起始端堵塞右侧大脑中动脉,然后将颈总动脉连同尼龙鱼线一起结扎,缝合皮肤,放回笼内单笼喂养。假手术组只分离、暴露血管,不结扎颈总动脉及颈外动脉,不插入尼龙鱼线。术后保持环境温度25~30℃。尤其要注意动物头部的保温。
1.4 观察指标
1.4.1 神经行为学评分[6]:参考经典的 Longa 等[7]的方法对大鼠在MCAO术后清醒后到24 h进行3次神经功能评分,取平均值。0:无明显神经功能丧失;1:不能完全伸展左侧前爪;2:向左侧旋转,环形运动;3:行走时向左侧倾倒;4:不能自行行走,意识水平下降。
1.4.2 免疫组织化学方法检测缺血侧大脑皮层 bcl-2、bax的表达:5组大鼠行MCAO,24 h后行脑灌注固定后取脑,取双侧大脑冠状位距嗅球尖端6~11 mm脑组织块,放入多聚甲醛液固定24 h,常规梯度脱水、透明、石蜡包埋。从冠状面中1/3层面开始留取切片,厚度5 μm,连续切片,备用。将其进行免疫组化SABC法染色,操作严格参照武汉博士德公司说明书。判断标准及方法:对于大鼠MCAO模型,Shi等[8]研究指出,缺血侧大脑半球距离嗅球尖端7~11 mm、矢状裂至外侧裂上1/3的皮质组织由大脑前动脉和中动脉双重供血,缺血较轻,表现为半暗区的变化。每只大鼠各取3张脑组织切片,在显微镜下定位,取缺血侧(假手术组取假手术侧)大脑皮层顶叶第三层外锥体细胞层,随机采集5个高倍视野(10×40),参照Quaini等[9]采用双盲法计算每个高倍镜视野bcl-2及bax阳性细胞率(阳性细胞数/阳性细胞数+阴性细胞数)×100%。细胞胞质含有棕黄色颗粒的细胞为阳性细胞。
1.5统计学分析应用SPSS 16.0统计软件,计量资料以±s表示,多组间比较采用单因素方差分析检验,各指标组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 神经功能缺损评分比较 术后大鼠多于1 h内清醒,假手术组动物均活动正常,无神经功能缺损,神经功能缺损评分为0分,单纯缺血组动物神经功能缺损评分最为严重;与单纯缺血组相比,尤瑞克林组各组均能改善局灶性脑缺血大鼠的神经行为学评分(P<0.05或<0.01)且随剂量升高呈量效关系。其中单纯缺血组及尤瑞克林中剂量组各1只大鼠死亡,剔除。见表1。
表1神经功能缺损评分比较±s

表1神经功能缺损评分比较±s
注:与单纯缺血组比较,*P <0.05,#P <0.01
?
2.2 缺血侧大鼠大脑皮层bcl-2、bax阳性细胞表达个数结果
尤瑞克林各剂量组bcl-2、bax阳性细胞表达率均明高于单纯缺血组(P <0.05或 <0.01),且呈剂量依赖性关系。见表2,图 1、2。

表2 5组对大脑皮层bcl-2、bax阳性细胞表达影响
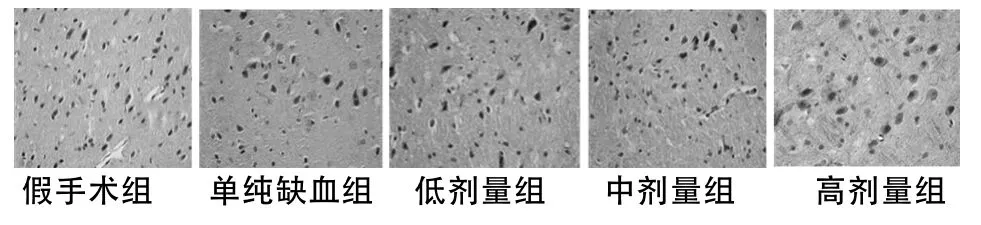
图1 大脑皮层bcl-2表达(免疫组化×400)
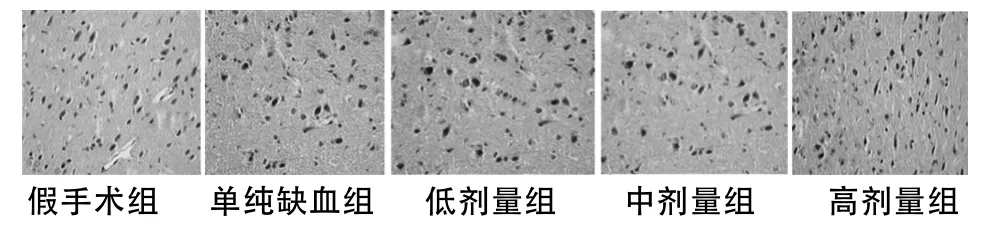
图2 大脑皮层bax表达(免疫组化×400)
3 讨论
脑缺血后,由于脑缺血缺氧致氧自由基大量生成、神经细胞凋亡、氧化应激损伤等,使脑组织损伤进行性加重。缺血性脑血管病的高致残率及病死率与脑缺血后大量神经细胞凋亡密切相关。细胞凋亡发生机制复杂,涉及信号转导、基因调控和凋亡效应的执行等。各种凋亡相关蛋白在调控凋亡发生的过程中起关键作用。有研究发现大鼠MCAO后,脑缺血半暗区的凋亡细胞在缺血1 h即可出现,随缺血时间的延长逐渐增多,凋亡的特征性改变主要发生于缺血后12~24 h,48 h以后凋亡细胞明显减少,72 h以后凋亡表现逐渐消失,半暗区内的神经元已基本全部死亡[10]。研究表明,bax为促进细胞凋亡;bcl-2增高抑制细胞凋亡,且bcl-2基因家族是决定细胞是否发生凋亡以及凋亡严重性的重要因素[11]。因此,各种药物可以通过促进bc1-2蛋白表达,减少bax蛋白表达,来抑制细胞发生凋亡,对脑损伤起保护作用。
注射用尤瑞克林是从男性尿液中提取精制的组织型激肽原酶,能催化激肽原水解产生激肽。研究证实,组织激肽原酶能促进一氧化碳生成,改善脑组织供血,能选择性扩张脑细小动脉,改善缺血脑组织血供和氧供,减轻氧化应激损伤,促进新生血管发生,减少细胞凋亡,从而对急性脑梗死起到治疗作用[12,13]。且注射用尤瑞克林及其相关代谢产物对缺血部位的靶向性作用强,可成为缺血性脑血管病的最重要的治疗药物之一。
本研究结果显示:脑缺血后24 h大鼠缺血性病理损伤及神经功能缺损症状严重,低、中、高剂量尤瑞克林能使神经功能缺损症状减轻,说明尤瑞克林对脑缺血有保护作用。尤瑞克林可促进抑凋亡基因bcl-2蛋白的表达,并下调促凋亡基因bax蛋白的表达,从而减少脑缺血后的神经细胞凋亡,且随剂量增加治疗效果越明显,呈剂量依赖性。说明尤瑞克林对大鼠脑缺血损伤有很强的保护作用。其保护机制可能抑制脑缺血损伤中神经细胞凋亡,减轻迟发性神经元坏死,保存神经细胞功能,从而达到治疗目的。
本研究还发现单纯缺血组缺血侧脑组织较假手术组bcl-2阳性细胞表达增多,脑缺血后bcl-2的这种变化可能是神经细胞自我保护机制之一,可防止或减少缺血时脑组织细胞凋亡的发生。
1 Emanueli C,Madeddu P.Angiogenesis therapy with human tissue kallikrein for the treatment of ischemic diseases.Arch Mal Coeur Vaiss,2004,97:679-687.
2 Chao J,Chao L.Kallikrein-kinin in stroke cardiovascular and renal disease.Exp Physiol,2005,90:291-298.
3 Xia CF,Yin H,Borlongan CV.Kallikrein gene transfer protects against ischemic stroke by promoting glial cell migration and inhibiting apoptosis.Hypertension,2004,43:452-459.
4 李昌盛,闵拮,湛彦强,等.利用激光散斑成像技术观察尤瑞克林对脑梗死大鼠脑血流的影响.中华神经科杂志,2010,43:732-736.
5 屈志炜,苏丹,张丽英,等.凯力康对大鼠局灶性脑缺血的实验研究.中国处方药,2005,44:73-75.
6 xu X,Ye L,Ruan Q.Environmental enrichment induces synaptic structural modification after transient focal cerebral ischemia inrats.Exp Biol Med(Maywood),2009,234:296-305.
7 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats.Stroke,1989,20:84-91.
8 Shi J,Panickar KS,Yang SH,et al.Estrogen attenuates over-expression of beta-amyloid precursor protein messager RNA in an animal model of focal ischemia.Brain Res,1998,810:87-92.
9 Quaini F,Cigola E,Lagrasta C,et al.End-stage cardiac failure in humans is coupled with the induction of proliferating cell nuclear antigen and nuclear mitotic division iventricular myocytes.Circ Res,1994,75:1051-1063.
10 陈元新,林祥通,沈冰.大鼠永久性脑缺血及缺血再灌注后半暗带caspase-3mRNA表达变化.复旦学报(医学科学版),2001,28:490-493.
11 De Bilbao F,Guarin E,Nef P,et al.Cell death is prevented in thalamic fields but not in injured neocortical areas after permanent focal ischaemia in mice overexpressing the anti-apoptotic protein Bcl-2.Etr J Neurosci,2000,12:921-934.
12 谢惠芳,徐如祥,魏继鹏,等.大鼠脑缺血再灌注损伤后磷酸化JAK2、STAT3蛋白表达及细胞凋亡.南方医科大学学报,2007,27:208-211.
13 Chao J,Bledsoe G,Yin H,et al.The tissue kallikrein-kinin system protects against cardiovascular and renal diseases and ischemic stroke independently of blood pressure reduction.Biol Chem,2006,387:665-675.

