口腔黏膜白斑上皮组织中凋亡相关蛋白Bax的表达研究
满一 沈国华 钟良军
白斑是公认的最常见的癌前病变之一,上皮过度增生或不典型增殖是其特点,是上皮细胞数量由单纯增加向细胞质量癌变转化的中间阶段,在这个转变过程中不仅有细胞的过度增殖,同时还存在细胞凋亡异常,凋亡失控在细胞恶变的起始过程发挥作用[1,2],近年来Bcl-2凋亡家族中的Bax蛋白在细胞恶性转化早期阶段中的抑癌作用受到重视[3],但此类研究报道笔者较少见。本研究通过观察分析口腔白斑中Bax蛋白的表达状况,探讨口腔黏膜上皮恶变转化中Bcl-2蛋白生物学行为,有助于临床早期诊断和防治。
1 材料与方法
1.1 材料 选择2007年4月至2009年6月中国石油天然气集团公司中心医院保存的的石蜡切片54例,其中正常口腔黏膜25例,白斑29例;所有检材诊断和组织学均依据WHO标准,由同1名经验丰富的病理学专家完成。
1.2 试剂 所有试剂均购自福州迈新生物技术有限公司。Bax为即用型鼠抗人单克隆抗体,SP复合物MaxVisionTM为快捷即用型。DAB显色试剂盒为链霉亲和素-辣根过氧化物酶(HPR)免疫组化染色EnVision系统,适用于链霉素-过氧化物酶免疫组织化学染色方法(streptavidin-peroxidase,SP)。
1.3 实验方法 采用免疫组化SP法染色检测细胞凋亡与增值状况。所有组织切片经10%甲醛固定、常规脱蜡、透明、浸蜡、石蜡包埋。5 μm连续切片,固定于经多聚赖氨酸处理的载玻片上,常规组织切片脱蜡入水;微波加热10 min暴露抗原;过氧化物酶溶液阻断内源性过氧化物酶的活性,PBS水冲洗,鼠抗人即用型Bax抗体37℃孵育60 min,加入SP复合物HRPMarVisionTM,30℃孵育60 min;加入SP复合物HPR,4℃过夜;DAB缓冲液、DAB底物、DAB色原顺序加入、混匀成DAB显色液滴定组织切片,室温下显色10 min,显色后苏木素复染,常规脱水,二甲苯透明,封片。以PBS(0.01 mol/L,pH值 7.4)代替一抗为阴性对照,胃癌阳性染色切片为Bax的阳性对照(福州迈新生物技术公司提供)。
1.4 阳性判断标准 采用HM2A8-2000高清晰度彩色医学图文分析系统,每例每张切片各随机选取2~5个不重复、不重叠400倍高清视野,细胞质和细胞核染成棕色或棕红色颗粒或弥漫成片状为Bax的阳性表达。计数切片中1 000个上皮基底细胞中的阳性细胞数。参照文献[2]标准,将Bax定级为:阳性反应为棕色到棕红色颗粒或片状弥散定位于胞浆,高倍镜下计数:标本中无阳性细胞为0分,<25%为1分;26~50%为2分;50%以上为3分,最后求其平均数。染色强度以棕色为1分;深棕色为2分;棕红色为3分。两者相乘,0分为阴性(-);1~3分为弱阳性(+);4~6分为中等阳性(++);7~9分为(+++)。计算凋亡指数(apoptosis index,PI)=凋亡细胞数/视野内细胞总数×100%。
1.5 统计学分析 应用SPSS 11.5统计软件,病变组织与对照组中阳性表达率以及各种临床指标中的表达率的的的差异采用χ2检验;样本数<40,癌前病变Bcl-2、Bax阳性表达率之间的相关性,白斑、扁平苔藓之间的bcl-2、bax阳性表达率的差异采用Fisher精确概率法单因素相关分析,P<0.05为差异有统计学意义。
2 结果
本研究的检材组织类型涵盖了口腔黏膜癌前病变发展所经历几个阶段:正常上皮组织、单纯性增生、不典型增生,最终发展为原位癌。
2.1 Bax蛋白表达定位 正常口腔黏膜上皮组织的阳性细胞主要分布在角化层和粒层,点状散在型分布为主;单纯增生组织中的阳性细胞多位于上皮棘层,部分基底层也见阳性反应性,周围型分布为主;而不典型增生的上皮组织中以基底层阳性染色居多,主要定位于基底细胞胞质中,个别病例在胞核中也有表达,贯穿上皮全层,多数局灶性分布。Bax在各种上皮组织中的表达情况见表1。见表1、图1~4。
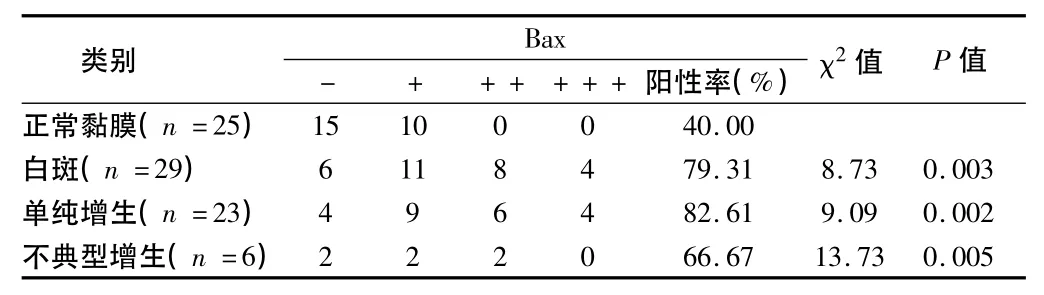
表1 Bax蛋白在口腔正常黏膜、白斑上皮细胞中的表达 例
2.2 Bax蛋白表达强度 在正常口腔黏膜上皮组织中的Bax阳性细胞主要分布在角化层和粒层,但染色较淡,呈黄棕色,阳性表达率40.00%。上皮单纯增生Bax阳性细胞染色强度加深,阳性细胞在上皮全层均可见,棕色和棕红色颗粒、棕红色颗粒,弥散分布,随着增殖程度的增加,随着上皮异常增生程度的加重,Bax表达逐渐增强,不典型增生上皮中分布最广,贯穿上皮全层,整体染色强度也增强,以基底层中细胞质着色最深。Bax在在各种上皮组织中的表达情况见图1~4。
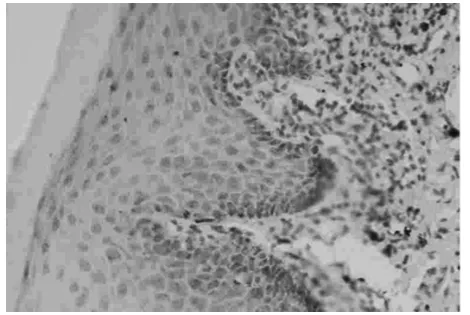
图1 单纯增生中Bax的表达与分布(SP×100)

图2 不典型增生中Bax的表达与分布(SP×100)

图3 正常口腔黏膜上皮Bax表达与分布(SP×100)
2.3 Bax蛋白表达形式 (1)弥散型:组织内多数上皮细胞全层都有阳性表达;(2)周围型:主要是在组织周边的基底层细胞有阳性表达;(3)局灶型:上皮基底层、棘层、颗粒层内有2~6个阳性细胞组成的局灶。
3 讨论
Bax蛋白是在白细胞基因文库中发现的21 kD Bcl-2同源蛋白,因 RNA 剪方式的不同编码 3种蛋白:Baxα、Baxβ、Baxγ。其中Baxα为跨膜蛋白,可与Bcl-2α结合异二聚体Bcl-2/Bax,或形成同种二聚体Bax/Bax,细胞凋亡的调节严格依赖于二者的化学计量。
Bax蛋白免疫组化染色统计结果分析:25例正常口腔黏膜有10例出现了Bax阳性表达,主要分布在角化层、粒层等基底上层,弱染色染色为主;23例上皮单纯增生阳性细胞19例,阳性染色多位于上皮棘层、颗粒层,部分基底层也见阳性反应细胞,分布形式上以周围型为表现特征,染色强度加深;不典型增生上皮增殖中阳性细胞染色强度深,以基底层阳性染色居多。无论单纯增生还是不典型增生白斑组织中的Bax蛋白均显过度表达,显著高于正常口腔黏膜,但白斑各时期上皮组织之间的Bax蛋白阳性细胞表达率差异无统计学意义(P>0.05)。
正常口腔黏膜上Bax蛋白阳性细胞位于基底上层,并且呈点状散在分布,这符合黏膜上皮细胞分裂起源于基底层并逐渐向角化层移行成熟、衰老、凋亡的生理特征。而当上皮出现异常增生时,特别不典型增生时,Bax蛋白的表达随着增生强度改变而强化,强阳性染色细胞大多集中在上皮基底层,这种Bax蛋白表达随着上皮增生强度改变而发生的波动提示机体为了抑制过度生长的细胞群体而采取了自稳定机制。文献报道,鼻咽癌组织中的Bax蛋白表达较慢性鼻咽炎组织的免疫反应明显减弱,鼻咽癌中促凋亡基因受到抑制[4]。Baldve等[5]研究发现鳞癌中的Bcl-2蛋白免疫反应强烈,Bcl-2蛋白具有拮抗Bax蛋白作用,在鳞癌阶段Bax蛋白表达降低。由此可见,当增生性质的改变时,若细胞获得恶性表型,Bax蛋白可能失去作用或部分失去作用,肿瘤细胞自发的凋亡可能不再增加,细胞增殖加快。因此,在上皮细胞恶性转化阶段,Bax蛋白表达的异常增高是白斑恶变的早期阶段自我免疫反应,体现了机体为抑制过度生长的细胞群体,新生细胞开始启动了细胞自稳定机制,试图通过Bax/Bax蛋白表达的强化,促进异常增殖细胞的凋亡,维持细胞数目的稳定,细胞凋亡能除去一些有基因突变的细胞,阻止恶性转录,对肿瘤的生长产生副调控作用,使肿瘤发生的时间延迟。在不典型增生后期,则是细胞恶性转化加速阶段,通过Bax蛋白表达强化加速一些分裂周期短、增殖快,具有显著恶变表型的异质细胞凋亡。另一方面,Bax蛋白对分裂周期长、增殖慢但具有高侵袭力、尚处在潜伏期的肿瘤细胞的免疫麻痹,丧失清除能力,维持潜在肿瘤细胞增殖率,导致肿瘤细胞生存周期过长,肿瘤细胞聚集造成细胞爆发式恶变,其保留的恶性细胞具有恶性程度高、侵袭力强、预后差。基因敲除实验也说明,细胞凋亡抑制因子如Bcl-2,可以作为癌基因,或者说细胞是凋亡的促进因子如Bax,可以作为肿瘤抑制因子,如果敲除了具有促凋亡活性基因的大鼠肿瘤的发病率升高,则提示这个基因具有抑癌功能[6]。关于细胞数目自稳定启动机制,Adams[6]认为除 Bax、Bcl-2 和 Bak,在 Bcl-2 凋亡蛋白家族中还有一个单BH3结构域蛋白,单BH3结构域蛋白Bim、Bmf能够与线粒体膜外的抗凋亡Bcl-2家族蛋白相互作用。其活性通过转录诱导、翻译后磷酸化、细胞骨架扣押等机制调节,从而结合并拮抗抗凋亡的Bcl-2家族蛋白来诱导细胞凋亡[7],当接到凋亡信号后,Bax与Bak在线粒体外膜聚集,形成允许细胞色素C通过的通道。在正常细胞中,Bim、Bmf被分别扣押在微管和肌球蛋白而保持无活性状态,caspase8可以裂解激活Bid,磷酸化可以调节Bax的活性。
在细胞恶性转化中,不典型增生的Bax蛋白阳性率高于单纯增生,而细胞获得恶性表型,促凋亡基因受到抑制,癌细胞的凋亡受阻,可能是肿瘤发生、发展的一个重要因素,说明细胞恶变发生过程中存在促凋亡与凋亡抑制的相互倾轧倾向[8]。以往的研究偏重于细胞增殖在肿瘤形成中的作用,实际上细胞凋亡和增殖的平衡是决定细胞最终表型的重要因素。从细胞凋亡的机制出发,通过诱导细胞凋亡的研究,对抓住有效治疗时期,减少后期恶变的可能性或消除化疗药物的不良反应,对临床检测疾病的转归,预防癌变的发生有指导意义。
1 Gottschalk AR,Boise LH.Bcl-xL and Bcl-2 repress a common pathway of cell death.J Exp Med,1994,91:7350-7354.
2 Schimmer AD,Welsh K,Pinilla C,et al.Small-molecule antagonisys of apoptosis suppressor exhibit broad anti-tumor activity.Vancer cell,2004,5:25-35.
3 Eischen CM,Roussel MF,Korsmeyer SJ,et al.Bax loss impairs Mycinuced apoptossis and circumvents the selection of p53 mutations during Myc-mediated lymphomagenesis.Mol Cell Biol,2001,21:7653-7662.
4 王茂鑫.鼻咽癌组织中凋亡相关基因蛋白表达及意义.贵阳医学院学报,2005,6:214-216.
5 Baldve B,Francis WS,Bryan Whitatker,et al.Immunohistochemical evalution of bcl-2 oncoprotein in oral dysplasia and carcinoma.Oral Surg O-ral Med Pathol,1988,85:692-697.
6 Adams JM.Ways of dying:multiple pathways to apoptosis.Genes Dev,2003,17:2481-2495.
7 Villunger A,Michalak EM,Coultas L,et al.P53-and drug-induced apoptotic responses mediated by BH3-only proteins puma and noxa.Science,2003,302:1036-1038.
8 Yin C,Knudson CM,Korsmeyer SJ,et al.Bax suppression tumorigensis and stmulates apoptosis in vivo.Nature,1997,385:637-640.

