食品中甲醛的快速测定方法研究
刘振华,黄 帆,2,徐向华,包建强,丁卓平*
(1.上海海洋大学 食品学院,上海201306;2.上海太太乐福赐特食品有限公司技术质量部,上海201812;3.中国检验认证集团上海有限公司检测中心,上海201203)
甲醛是一种具有较高毒性的破坏生物细胞蛋白质的原生质毒物,能与蛋白质的氨基结合,使蛋白质变性凝固,扰乱细胞代谢。同时甲醛也是一种刺激物和诱变剂,已经被世界卫生组确定为致癌和致畸物质,是公认的变态反应源,也是潜在的强致突变物之一。长期接触低剂量的甲醛可引起基因突变,DNA单链内交联和DNA 与蛋白质交联及抑制DNA 损伤的修复,导致鼻咽癌、结肠癌、脑瘤。此外,甲醛主要对人的中枢神经系统、呼吸系统、消化系统和内分泌系统造成损害[1]。
甲醛并不是一种食品添加剂,但由于利益的驱使,许多不法商贩在食品中加入甲醛用来防腐和改善口感,因而检测甲醛成为食品分析的一大任务。甲醛的分析面临着“方法”和“仪器”两方面问题。如何准确、快速、在线监测周围食品中的甲醛具有积极的社会意义。一方面可以测定甲醛残留于各种食品的含量,另一方面对于保障人民的身体健康和有效减少疾病的发生具有积极的现实意义。
甲醛常用的检测方法有乙酰丙酮法[2-4]、变色酸法[5-10]、盐酸苯肼法、间苯三酚法[11]、副品红法(PRA)、三氮杂茂法(AHMT)、溴酸钾 - 次甲基蓝法、银 - Ferrozine 法、气相色谱质谱联用法(GC -MS)[12-13]、高效液相色谱法(HPLC)[14-15]、离子色谱法、薄层色谱法等。简单方法往往准确度低,复杂的方法往往检测成本高、仪器昂贵、费时。本试验旨在简单快速和准确灵敏之间找一个平衡点,探索一种简单快速且灵敏度较好的检测方法。本文采用正交试验优化了前处理方法,建立了快速、简便、稳定,准确、灵敏度高的食品中甲醛残留量的测定方法。
1 材料与方法
1.1 材料与仪器
岛津UV-2450 紫外分光光度计,日本SHIMADZU 公司;数显恒温水浴锅HH-4,国华电器有限公司。
干香菇、干腐竹、干肉皮、干鱿鱼、啤酒,市售;98%浓硫酸;1%变色酸溶液:准确称取10.00 g 变色酸粉末,溶于蒸馏水中,并定容到1 000 mL,摇匀,放置3 d 后,过滤使用;甲醛标准贮备溶液:准确移取37%甲醛溶液2.8 mL 于1 000 mL 容量瓶中,用水稀释至刻度,移取此溶液10 mL 于100 mL 容量瓶中,用水稀释至刻度,溶液浓度大约为0.10 mg/mL,用碘量法测定甲醛溶液的精确浓度;甲醛标准使用溶液:吸取甲醛标准贮备溶液10.0 mL 于100 mL 容量瓶中,用水稀释至刻度,溶液浓度为10 μg/mL,现配现用;其他试剂均为分析纯;实验用水,符合GB/T6682 一级水标准。
1.2 实验方法
1.2.1 样品的分析 干香菇、干腐竹、干鱿鱼、干肉皮:分别准确称取1.0 g 粉碎后的样品置于100 mL 具塞三角瓶中,加入50 mL 蒸馏水,在室温(25 ℃)下进行摇床震荡提取,提取时间为0.5 h,震荡提取后,以4 000 r/min离心15 min。取上层清液25 mL 至另外一个三角瓶中,经活性炭脱色后,抽滤,定容至100 mL。在10 mL 比色管中依次加入3 mL 变色酸、5 mL 浓硫酸,冷却后,分别加入样品溶液2.0 mL,95 ℃水浴6 min,以试剂空白溶液作为参比,在572 nm 波长处测定吸光度,计算样品中甲醛含量。
啤酒:在10 mL 比色管中依次加入3 mL 变色酸、5 mL 浓硫酸,冷却后,加入啤酒液体2.0 mL,95 ℃水浴6 min,以试剂空白溶液作为参比,在572 nm 波长处测定吸光度,计算样品中甲醛含量。

表1 3 因素3 水平试验设计Tab.1 Form of 3 factors and 3 levels
1.2.2 标准工作曲线 准确若干具塞比色管,依次加入3 mL 变色酸、5 mL 浓硫酸,冷却后,再加入一系列甲醛标准工作溶液,其浓度分别为1.1,2.2,4.4,6.6,8.8,11.1,13.2,22 μg/mL,95 ℃水浴6 min,重复3 次,以试剂空白溶液作为参比,在572 nm 波长处测定吸光度。以甲醛的浓度对吸光度绘制标准工作曲线,得到标准曲线。
1.2.3 正交实验 综合单因素试验得出的结论设计L9(34)正交表,如表1 所示,按照表中所列的因素及因素选择水平进行正交试验。
2 结果与讨论
2.1 测定波长的选择
取一定量的甲醛标准使用液于10 mL 比色管中,加入3 mL 变色酸溶液,加入浓硫酸6 mL,在沸水浴中显色30 min,然后在不同的波长条件下,测其吸光值。从图2 中可以得出,在572 nm 处,有最大吸光值,因此,变色酸分光光度法测甲醛的测定波长确定为572 nm。

图1 波长与吸光度的关系Fig.1 The relationship between absorbance and wavelength
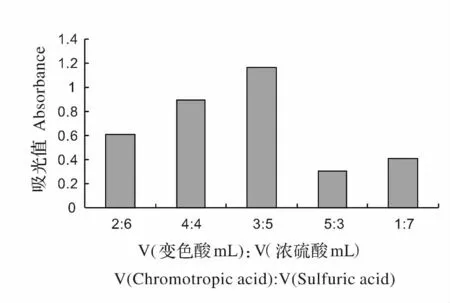
图2 不同反应物体积比所测吸光值(n=3)Fig.2 The absorbance measured in different volume ratio of reactants
2.2 单因素试验
2.2.1 变色酸和浓硫酸的体积比 在5 支10 mL 比色管中分别加入8 mL 不同体积比的变色酸和浓硫酸,其比例分别为1∶7、2∶6、3∶5、4∶4、5∶3,再加入2 mL 甲醛标准使用溶液,95 ℃水浴30 min,以试剂空白溶液作为参比,测其吸光值,重复3 次。所得数据如图2 所示,当体积比为V(变色酸mL):V(浓硫酸mL)为3∶5 时,所测的吸光值最大。
2.2.2 加热时间的选择 在10 支10 mL 比色管中依次加入3 mL 变色酸和5 mL 浓硫酸,再加入2 mL的甲醛标准使用液,95 ℃水浴,水浴时间分别为2,4,6,8,10,20,30,40,50,60 min,以试剂空白溶液作为参比,测其吸光值,重复3 次。结果如表3 所示。为加快显色反应速度,采用沸水浴加热。水浴时间在2 min 时,反应不完全,吸光值较低,4 min 到6 min 这段时间反应是逐步进行的,且6 min 后反应完全,但是超过10 min 时,由于加热时间过长,紫色络合物不稳定,受到光线的影响,导致结果偏低。当加热时间超过20 min 时,会在比色皿中溶液表面出现一层黑色物质,并随着时间的增加而增多,可能是由于反应物中有强氧化剂浓硫酸所致,黑色物质的出现导致吸光值不稳定。因此,加热时间不宜过长。

图3 不同加热时间所测吸光值(n=3)Fig.3 The absorbance measured in different heating time

图4 不同水浴温度条件下所测吸光值(n=3)Fig.4 The absorbance measured in different water temperature
2.2.3 水浴温度的选择 在10 mL 比色管中依次加入3 mL 变色酸和5 mL 浓硫酸,再加入2 mL 的甲醛标准使用液,水浴6 min,水浴温度为55 ℃、75 ℃、95 ℃,以试剂空白溶液作为参比,测其吸光值,重复3 次。结果图4 所示,当水浴温度为95 ℃时,吸光值最大。
2.3 正交试验
根据上述单因素试验结果设计正交表,其试验结果如表2 所示。
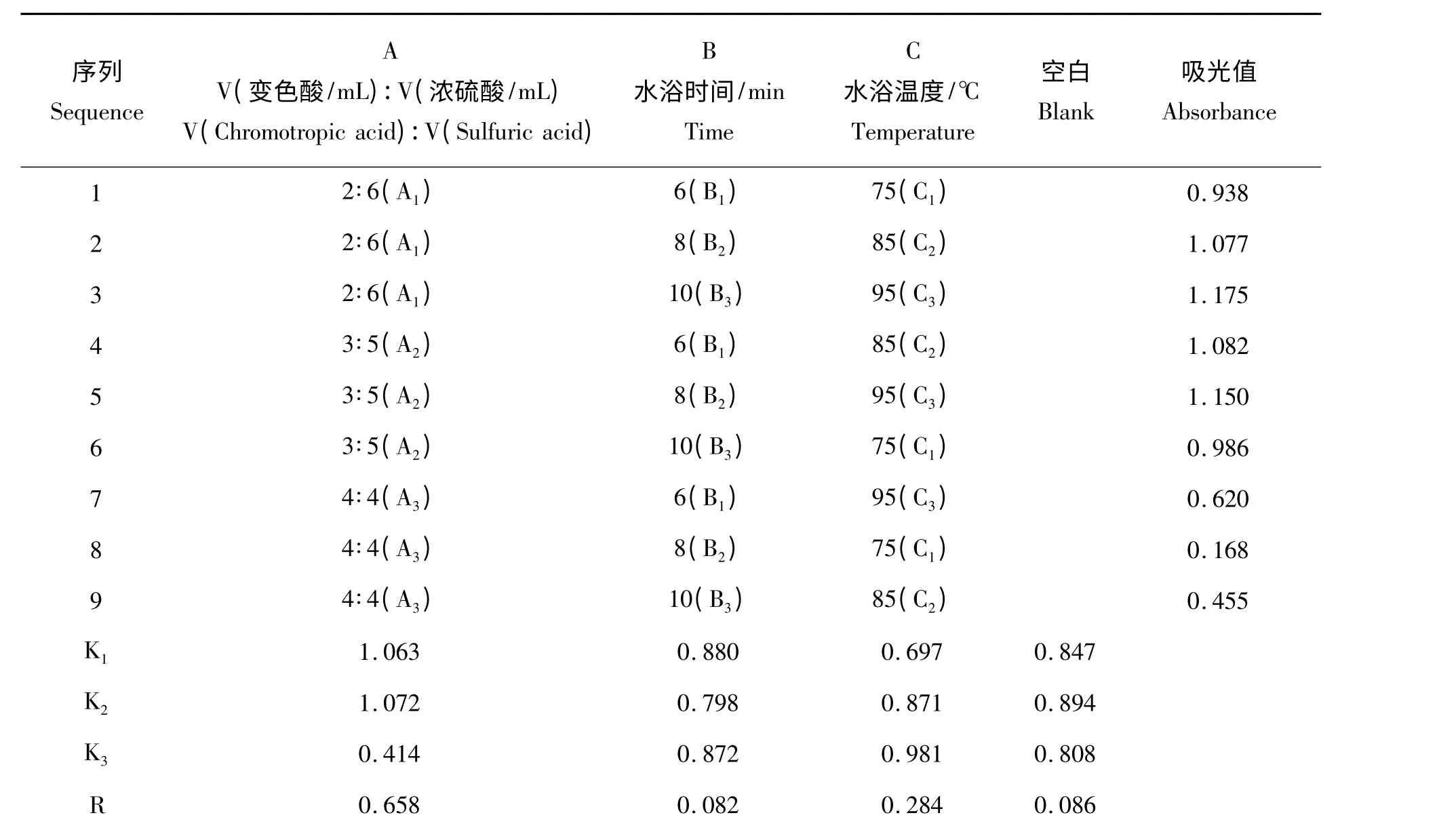
表2 正交试验数据分析(n=3)Tab.2 The data analysis of orthogonal experimental
从表2 中R 值可以看出,变色酸和浓硫酸的体积比对测定结果影响最大,且K2 >K1 >K3,因此选择第2 水平,即变色酸3 mL、浓硫酸5 mL;水浴温度的影响也很大,且K3 >K2 >K1,选择第3 水平,即水浴温度为95 ℃;水浴时间对结果影响不显著,因此选择最短时间,即水浴时间为6 min。
对实验结果进一步正交试验方差分析,结果见表3。由表3 可知,水浴时间的F 值远低于F 临界值,说明对结果影响不大,变色酸和浓硫酸的体积比的F 值远大于F 临界值,说明对结果影响最大,这与之前的极差分析结果一致。

表3 方差分析表(n=3)Tab.3 Square-error analysis
最优的反应条件为A2B1C3,而正交试验中并未设计这个条件,故再做1 组验证试验,其吸光值为1.211,比表格中吸光值最大的A1B3C3高,得出反应的最佳条件组合方案为A2B1C3,即变色酸3 mL、浓硫酸5 mL、水浴时间6 min、水浴温度95 ℃。因此实验步骤可概括为:在10 mL 具塞比色管中依次加入3 mL 变色酸和5 mL 浓硫酸,冷却一段时间后,再加入2 mL 的甲醛溶液,95 ℃水浴6 min,取出后测其吸光值。
2.4 标准工作曲线的绘制
变色酸在浓硫酸介质中与甲醛反应生成紫色化合物,加热处理后利用产物的吸光值与甲醛浓度的关系,绘制标准曲线,如图5 所示。通过回归分析,得到的标准曲线为:y=0.032 3x-0.028 7,相关系数为0.995 9,线性相关性良好。

图5 甲醛标准溶液浓度与吸光值之间的关系Fig.5 The relationship between the absorbance and the concentrations of standard solution of formaldehyde

图6 不同震荡时间对从香菇中提取甲醛的影响Fig.6 The concentrations of formaldehyde corresponding to different soaking time shaking the mushroom
2.5 样品的处理(以干香菇为例)
由于甲醛的沸点为-21 ℃,所以用加热法提取甲醛容易造成甲醛的大量损失,故本实验采用室温振荡提取法。取4 个100 mL 具塞三角瓶,称取1.0 g 粉碎后的样品,加入50 mL 蒸馏水,进行摇床振荡提取,时间分别为0.5,1.0,1.5,2.0 h。震荡提取后,以4 000 r/min 离心15 min。取上层清液25 mL至另外一个三角瓶中,经活性炭脱色后,抽滤,定容至100 mL后,按照2.3 所得的最佳试验条件进行操作,以试剂空白溶液作为参比,测其吸光值。其结果如图6 所示,提取时间越长,吸光值反而降低,这是因为长时间振荡导致甲醛的挥发,而时间为0.5 h 和1.0 h 时,结果接近,所以振荡提取时间定为0.5 h。

表4 样品的相对标准偏差和回收率(n=6)Tab.4 The precision and recovery of samples
2.6 回收率和精密度
称取一定量粉碎后的样品置于100 mL 具塞三角瓶中,加入50 mL 蒸馏水,其中甲醛浓度分别为0.685,1.370,2.056 μg/mL,室温下震荡提取,提取时间为0.5 h,按照2.3 的操作步骤,做6 次平行试验,同时以试剂空白溶液作为参比。测其吸光值。结果如表4 所示。
当样品中甲醛的添加浓度为0.685,1.370,2.056 μg/mL 时,其回收率为83.39% ~101.03%,相对平均偏差在7.33% ~13.87%,准确性和精密度高,适用于食品中甲醛的快速测定。
3 结论
本研究建立了变色酸分光光度法测定甲醛的方法,反应特异性较强、色阶清晰、颜色稳定,能快速定性定量检测甲醛。方法回收率为83.39% ~101.03%,相对平均偏差在7.33% ~13.87%,准确性和精密度较高。同时对反应条件进行了正交处理,得出最优的反应条件:变色酸3 mL、浓硫酸5 mL、水浴温度95 ℃、水浴时间6 min。样品采用室温振荡提取0.5 h,最大限度地减少了甲醛的损失。
[1]闫树刚,刘慧,朱力,等.甲醛的快速检测方法之研究[J].北京农学院,2003,19(3):122 -125.
[2]顾娟红,朱振华,夏缨,等.乙酰丙酮分光光度法工作曲线稳定性研究[J].检验检疫科学,2010,9(2):28 -29.
[3]范荻,潘振球,曹华娟,等.食品中甲醛测定前处理的干扰问题探讨[J].实用预防医学,2002,9(4):412 -413.
[4]Opas B,Frank D,Proespichaya K,et al.Sol-gel based sensor for selective formaldehyde determination[J].Analytica Chimica Acta,2010,659(1 -2):251 -257.
[5]王萃.变色酸分光光度法测定食用酒精中微量甲醛的条件研究[J].西安文理学院学报:自然科学版,2006,9(4):34-38.
[6]黄显屏,邓代征,付达美.变色酸法测定食用酒精中甲醛含量[J].中华预防医学杂志,2004,38(6):395.
[7]胡德银,张勇.变色酸比色法测定工业废气中微量甲醛[J].安徽教育学院学报,1996,11(1):46 -48.
[8]Fagnani E,Melios C B,Pezza L,et al.Chromotropic acid-formaldehyde reaction in strongly acidic media.The role of dissolved oxygen and replacement of concentrated sulphuric acid[J].Talanta,2003,60(1):171 -176.
[9]Sihn Y S,Guillory J K,Kirsch L E.Quantitation of taurolidine decomposition in polymer solutions by chromotropic acid formaldehyde assay method[J].Journal of Pharmaceutical and Biomedical Analysis,1997,16:643 -650.
[10]Sakiara K A,Pezza L,Melios C B. Spectrophotometric determination of dipyrone in pharmaceutical preparations by using chromotropic acid[J].II Farmaco,1999:629 -635.
[11]Li Z W,Ma H B,Lu H H,et al.Determination of formaldehyde in foodstuffs by flow injection spectrophotometry using phloroglucinol as chromogenic agent[J].Talanta,2008,74(4):788 -792.
[12]Bianchi F,Careri M,Musci M,et al.Fish and food safety:Determination of formaldehyde in 12 fish species by SPME extraction and GC-MS analysis[J].Food Chemistry,2007,100(3):1049 -1053.
[13]Trenholm R A,Rosario-Ortiz F L,Snyder S A Snyder.Analysis of formaldehyde formation in wastewater using on-fiber derivatization-solid-phase microextraction-gas chromatography-mass spectrometry[J]. Journal of Chromatography A,2008,1210(1):25 -29.
[14]Burini G,Coli R.Determination of formaldehyde in spirits by high-performance liquid chromatography with diode-array detection after derivatization[J].Analytica Chimica Acta,2004,511(1):155 -158.
[15]Xu X,Su R,Zhao X,et al.Determination of formaldehyde in beverages using microwave-assisted derivatization and ionic liquid-based dispersive liquid-liquid microextraction followed by high -performance liquid chromatography[J].Talanta,2011,85(5):2632 -2638.

