光生物反应器中光传递模型在微藻培养中的应用
吴小芳,张志斌,余佳清,曾庆桂,汪 涯,颜日明,朱 笃,
(1.江西师范大学 生命科学学院 江西省亚热带植物利用与保护重点实验室,江西 南昌330022;2.江西科技师范大学 生命科学学院 江西 南昌330013)
微藻作为光自养生长微生物,以光能作为能源,CO2为碳源进行细胞生长和产物生成,在食品、保健品、水产养殖以及色素、多不饱和脂肪酸和精细化工品等方面有着广泛的应用[1-2],同时在生物柴油制备[3]、氢能的生产[4]、污水处理和废气中CO2的吸收[5-7]也有着良好的应用前景。虽然光能对于微藻细胞生长的重要性得到广泛关注,但在光生物反应器工程领域中光能的传递和利用特性仍然被忽视。在光生物反应器中光能要么被吸收进行光合作用,要么以热能的形式耗散,而不能以任何形式储存[8-9];在实际培养中,光生物反应器中暗区、光限制区、光饱和区和光抑制区又同时存在,当光强较低时,细胞生长受到限制;而光强较高时,光抑制又限制细胞的生长[10-11]。因此要获得最大细胞得率就必须使整个光生物反应器处于饱和光强范围内,这在实际培养中是很难实现的。因此研究光生物反应器中光强的分布规律是探索提高微藻培养过程中光能的传递和利用效率的重要途径之一。
由于细胞的相互遮挡和细胞所含色素对光能的吸收,光在藻液中会发生衰减并导致整个光生物反应器中光的分布不均,从而影响微藻的光能生长密度。因此建立光生物反应器中的光分布模型来描述光能的传递是实现细胞高密度培养的先决条件。Rabe 和Benoit 利用光学中的辐射理论,首次引入点光强和平均光强的概念来描述光生物反应器中的光分布[12],之后有很多学者根据不同光生物反应器类型提出许多光分布模型。Cornet 等[13-15]考虑细胞对光的吸收和散射,以人造光能为外置光源研究了矩形、圆柱形及球形光生物反应器中光能分布模型。Acién Fernádez 等[16]和Evers[17]以太阳光为光源提出计算户外管式光生物反应器中光传递特性模型。这些模型都能较好的描述微藻培养过程中光生物反应器中光能的传递动态变化,但迄今为止,尚未见有关光生物反应器中光能传递模型的研究综述。本文对微藻培养光生物反应器中光强的衰减及分布模型进行综述,以期为光生物反应器的设计、放大和提高微藻培养的光能利用效率提供参考。
1 微藻细胞培养体系中光的衰减
在光生物反应器中,光通过藻液时,由于微藻自身的相互遮挡和藻细胞色素对光的吸收效应,入射光穿过藻液时存在着不断衰减的现象,随着培养密度和光透距离的增加光衰减现象越严重。影响光衰减的主要因素包括细胞的浓度、培养液厚度、细胞的大小、细胞所含色素的多少等。在混合均一的微藻培养体系中[18],由细胞浓度导致的光衰减可以Lamber-Beer 定律来描述,但Lamber-Beer 定律基于以下假设下才成立:
(1)入射光源是单一和垂直的光源;
(2)吸收光的介质是均匀、透明的溶液;
(3)由固体颗粒产生的散射与吸收相比是可以忽略的。
根据Beer 定律,微藻溶液的衰减系数与细胞浓度成正比,许多文献利用不同的表达式来描述微藻细胞浓度与衰减系数的关系,研究中常用的光衰减系数模型有以下几种:直线模型、多项式模型、双曲模型、吸收和散射模型。本研究将分别对其进行介绍。
1.1 光衰减系数的线性模型
康瑞娟等[19,20]在研究蓝藻的光衰减时,在考虑细胞密度和培养液浓度同时还考虑细胞大小对光强衰减的影响,研究了丝状体的鱼腥藻7120 和单细胞的聚球藻7002 培养体系中光强的衰减,在Lamber-Beer 定律的基础上,用藻细胞和光衰减系数的线性关系得出了藻细胞的光衰减模型:
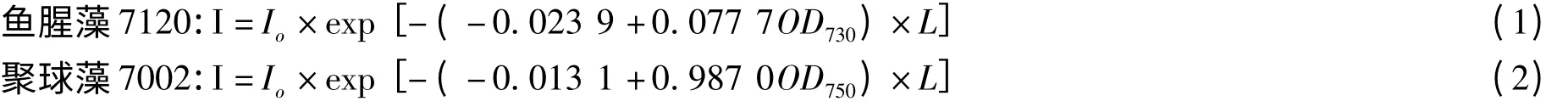
陈烨等[21]和张志斌等[22]在研究藻液光衰减特性时,发现总光衰减系数与藻细胞密度之间的线性关系拟合较好,说明在一些藻液中光衰减系数可以用直线模型来描述。
1.2 光衰减系数的多项式模型
描述光衰减现象的一个基本定律是郎伯-比尔定律,温少红等[23-24]在研究螺旋藻和紫球藻的光衰减特性时发现存在一些非线性的关系,可能是由于螺旋藻和紫球藻培养液是一种很不稳定也不规则的溶液体系。它不仅有较强的光吸收能力,而且对光还有反射、折射和散射作用,这两个因素使螺旋藻藻培养液的光衰减规律远远偏离Lamber -Beer 定律。针对螺旋藻和紫球藻培养液的特征建立了可描述两种微藻的光衰减规律的数学模型:
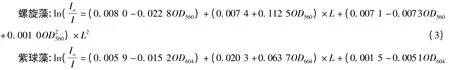

该模型能较好地描述螺旋藻浓度、光穿透距离和透过光强之间的相互定量关系,经检验该模型的总体平均误差为5.7%。
1.3 光衰减系数的双曲模型
Acién Fernandez 等[16]在研究Phaeodactylum tricornutum UTEX 640 细胞培养过程中,利用Lamber -Beer 定律描述藻液中的光衰减现象,发现在细胞浓度较低情况下藻细胞的衰减系数和细胞浓度符合线性关系,当细胞浓度超过1.3 g/L 时,细胞的光衰减相悖于线性关系,根据衰减趋势,提出双曲模型来描述细胞的光衰减现象。在低浓度下衰减系数与细胞浓度呈线性关系;在高浓度下衰减系数存在朝最大值慢慢趋近的趋势。此模型表达式为:

其中A(X)为光衰减系数,A(X)max最大光衰减系数,B 为常数,X 为细胞浓度。
虽然该模型没有实际的生物学意义,但却能很好的描述微藻细胞光衰减系数随浓度的变化趋势,可以当作经验式来描述微藻细胞中的光衰减。Lee and Suh[25]和Yun 等[26]利用双曲模型描述了藻细胞的光衰减,证明此模型在很大细胞浓度范围内能很好的描述光衰减系数的变化。朱笃等[27]在研究聚球藻7942 的光衰减现象时也证明双曲模型能很好地描述细胞浓度和光衰减系数的关系。
1.4 光衰减系数的吸收和散射模型
光在均匀的介质中传递,光的衰减主要由吸收引起的。当光束通过光学性质不均匀的物质时,散射会使光在传播方向上造成衰减。引起光衰减的主要因素包括光的吸收和散射。微藻细胞培养体系中细胞浓度偏高时是一种不均匀的介质,在光传递过程中的光衰减是由细胞对光的吸收和散射造成的。当藻液中细胞浓度高时,由细胞颗粒导致的光散射对光的衰减占主要部分[28]。在Lamber -Beer 模型中,用仅考虑光吸收的光衰减系数来描述培养体系中光衰减存在很大的偏差,因此,Cornet 等[14,15]在Schuster 一维光传播模型的基础上推导了一个包括光吸收和光散射参数的藻液光衰减模型。其表达式如下:

此模型基于以下假设:(1)光的传播方向在培养液中不发生变化;(2)光的吸收和散射用Ea 和Es两个系数表示。
Cornet 等[29]在不同的生物反应器中用该模型描述了螺旋藻的光衰减特性,得到散射系数和吸收系数的值分别为200 m2/kg 和150 m2/kg;Pottier 等[30]在圆环面光生物反应器中利用上述模型研究Chlamydomonas reinhardtii 的光衰减特性,得到散射系数和吸收系数的值分别为172 m2/kg 和868 m2/kg,二位学者的研究结果证明散射系数与吸收系数相比不能被忽略。
2 微藻细胞培养光生物反应器中光的分布
光能在细胞生长中扮演重要的角色,光在光生物反应器中分布跟其几何形状密切相关,不同形状的光生物反应器中光的分布是各不相同的。在培养体系中计算光能的先决条件是利用模型分析光能的传递。以前数学模型主要集中在以太阳能为光能的系统,大多数应用于开放池系统[31-32],平板式光生物反应器和管状光生物反应器[33-34],以人造光源为光能的外置辐射光的光生物反应器光分布模型也已建立。为了减少外置光生物反应器光能的损失,几种内置光源的光生物反应器已经构建,同时计算内部光能分布的精确数学模型也已构建。本文主要介绍平板式、管式和圆柱形光生物反应器中光分布模型。
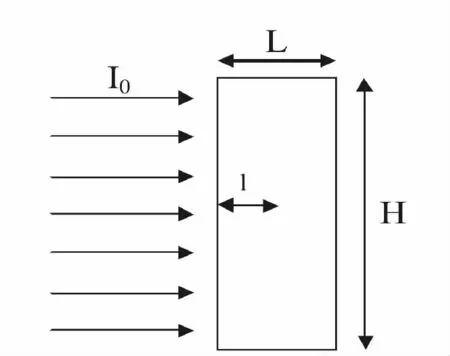
图1 单向平行光通过平板式光生物反应器Fig.1 Schematic drawing of unidirectional collimated light flux in a flat photobioreactor
2.1 平板式光生物反应器中光的分布
平板式光生物反应器具有大的光照表面积,短的光径等优点在微藻培养中受到广泛关注。由于其结构简单,计算光在其中的分布也相对简单。Molina Grima 等[33]利用微元法把光生物反应器分成无数小单元,在忽略反应器表面光的反射和散射的情况下(图1),利用Lamber-Beer 定律描述光生物反应器内任意点的光强:
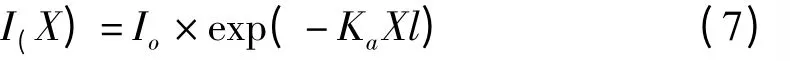
同时利用Alfano 等[34]提出的计算平均光强的公式推算出平板式光生物反应器中的平均光强,其表达式如下:

许波和王长海[35]首次在国内应用平板式光生物反应器对一种高度合成高不饱和脂肪酸—花生四烯酸的淡水微藻Parietochloris incise 进行了高密度培养研究,其单位体积和面积的细胞生物量产率分别提高到了0.73 g/(L·d)和70. 1 g/(m2·d)。Hoekema 等[36]利用平板式光生物反应器培养Rhodobacter capsulatus 产氢能,发现在高光强下光能转化成氢能的效率高达3.7%;Chae[37]等人设计了一种具有光暗周期循环的L -型光生物反应器,在该反应器中以太阳光为光源,石油的燃烧气体为碳源对微藻E.gracilis 的培养达到了中试规模,收获的生物量含有粗蛋白高达47%,在生产动物高蛋白饲料方面很有发展潜力。这些学者培养结果表明平板式光生物反应器具有光能利用率高和生物产率高等优点,可以实现微藻高密度高产培养。
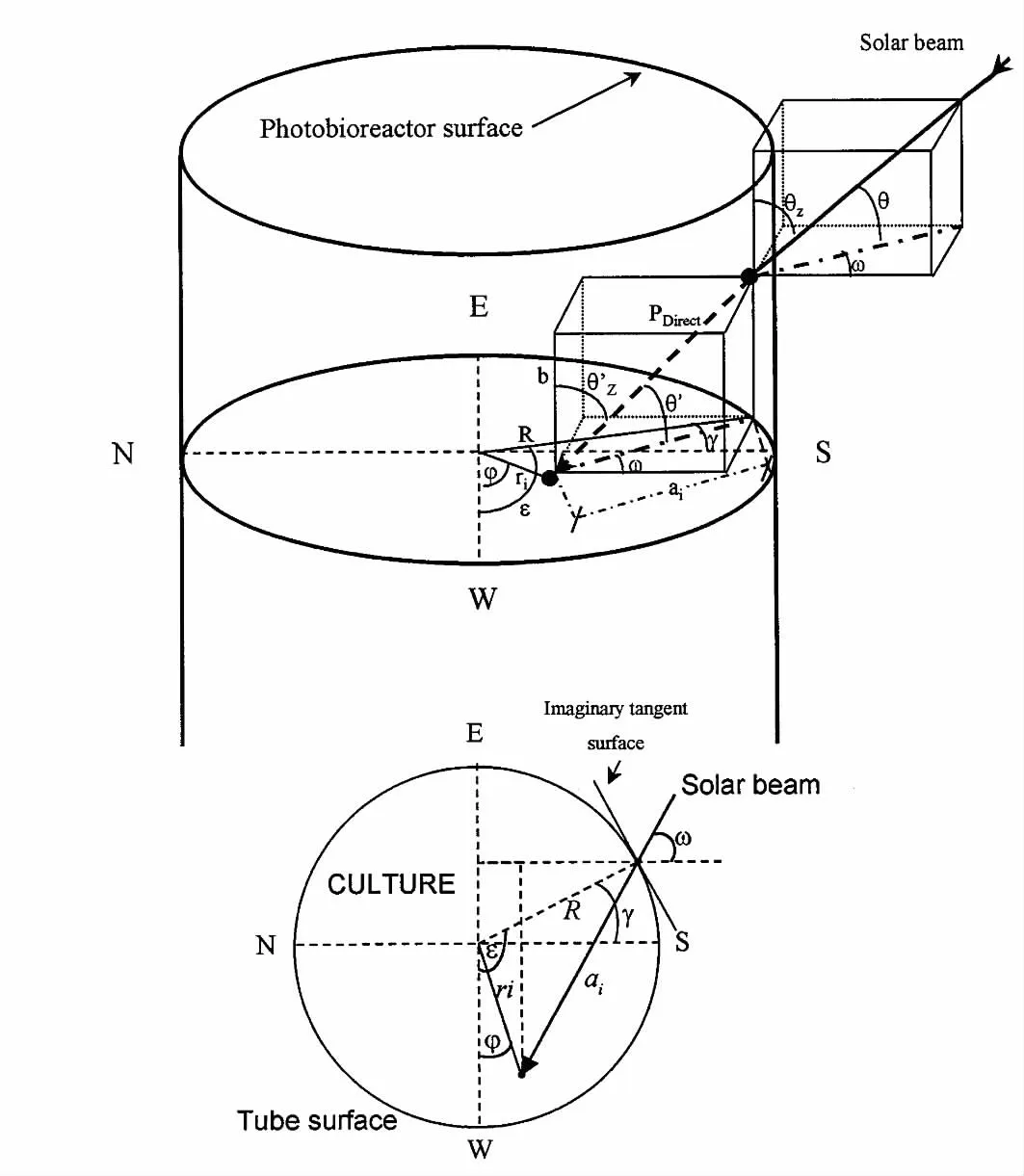
图2 管式光生物反应器中光路上任意点距离(ri)和角度(φ)的变量关系示意图;下图为其横截面Fig.2 Relationships among the various angles and distances associated with the path of direct radiation to any internal point ri,φ)inside the culture in a vertical tube;A plan view of the cross-section of the tube is shown in the lower part of the figure
2.2 管式光生物反应器光分布模型
在微藻培养中,以太阳光作为光能户外培养微藻是目前工业化生产微藻产品的主要形式,由于光强随着时间和季节的变化而导致用来描述反应器中的光强的模型非常复杂。基于Duffie 和Beckman[38]的太阳能利用理论,García Camacho 等[39]在户外管式光生物反应器中培养Phaeodactylum tricornutum UTEX 640 时,考虑太阳光线射入光生物反应器中的直射和散射现象,入射光线进入光生物反应器后的光学几何路径如图2 所示。
由于入射光进入光生物反应器后发生折射和散射,光传递中的光的分布包括折射和散射,光生物反应器中任意点光强为IBt和IDt的矢量和;引用Rabe 和Benoit 等[12]计算平均光强的公式,该生物反应器中平均光强的计算式如式(9):

2.3 圆柱形光生物反应器光的分布
2.3.1 外置光源圆柱形光生物反应器光分布模型 人造光源具有根据培养要求改变光强的大小、不受自然条件的干扰等优点,在培养高附加值的微藻产品和对光敏感的藻类具有广泛的应用前景,相关学者对外置人造光源光生物反应器中光能的分布进行了研究,现就目前应用广泛的光分布模型进行简单介绍。
(1)光分布的二维模型。Evers[17]提出了在反应器中由于细胞的相互遮挡导致光分布不均的模型,在不考虑光的散射和折射的前提下,该模型能很好地阐明不同光照下培养体系中光分布的真实状况。
如图3 所示,光生物反应器中任意点的光强来源于所有直射方向光能的总和,光生物反应器中任意点处光强表达式(10):
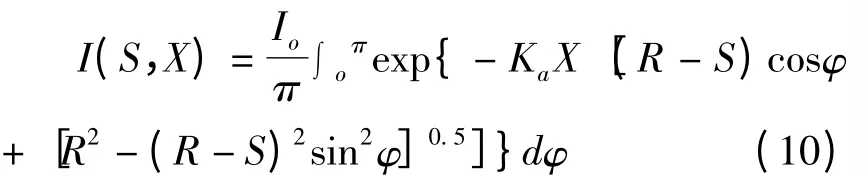
光生物反应器中平均光强表达式(11):
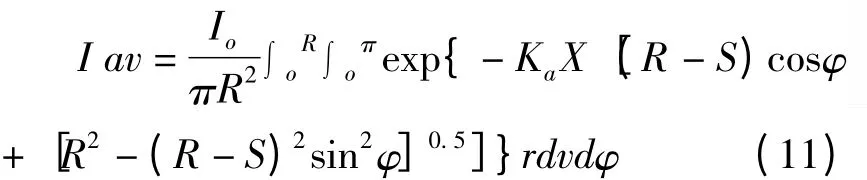
Molina Grima 等[40]利用式(12)计算生物反应器中的光强,并利用测光仪器验证实验模型的准确度,发现该模型能比较准确描述不同浓度下光生物反应器中光强的变化。随着细胞浓度的增加,光生物反应器中离反应器表面的距离越远,光强越弱。
(2)光分布的三维模型。Molina Grima 等[41]考虑到光传递的空间性,在研究光强对微藻细胞生长的影响时提出光生物反应器中任意点和平均光强的三维模型,其几何结构关系如图4 所示。
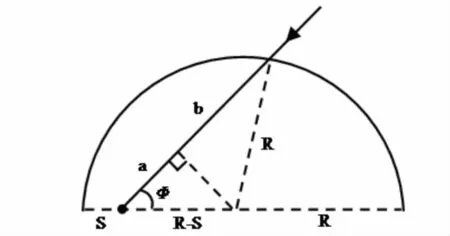
图3 圆柱形光生物反应器半截面Fig.3 Schematic representation of one-half of a cross section through a cylindrical vessel
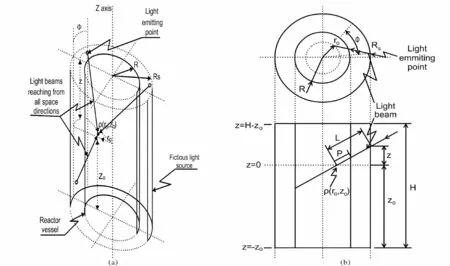
图4 圆柱形反应器中三维分散模型示意图(a)和光散射及光路中的几何关系计量图(b)。Fig.4 Scheme of the three-dimensional diffuse model in cylindrical reactor(a)and geometrical relationships involved in the calculation of light diffusion and optical path(b).
根据Alfano 等[34]的经验式,光生物反应器中任意点光强表达式(12):
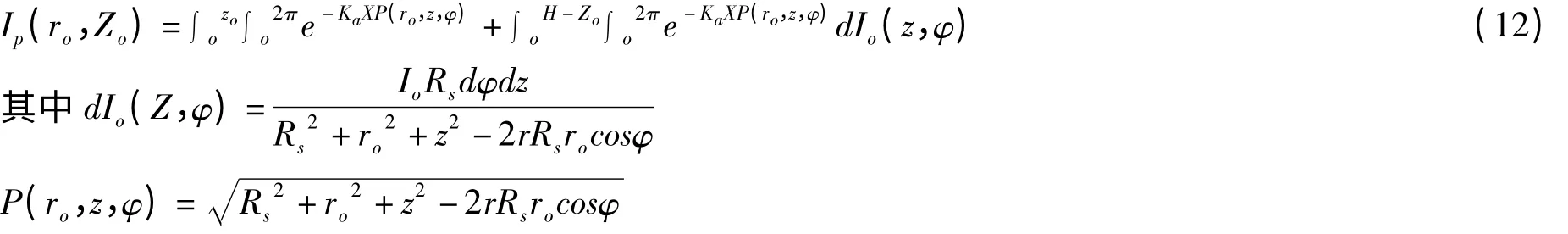
光生物反应器中的平均光强表达式为(13):
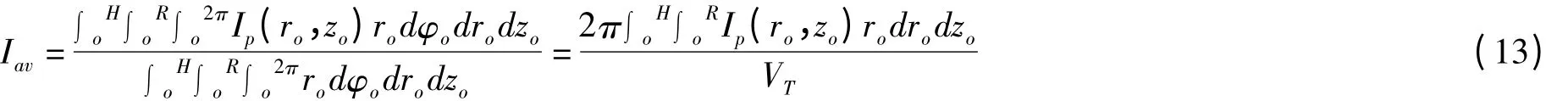
Molina Grima 利用(13)描述不同高度下光生物反应器中的平均光强,发现此模型相对于Evers 的二维模型能更精确描述实验数据与模型计算值的关系。Yokota 等[42]研究表明只考虑光的吸收会过高评估光的衰减,此模型的衰减系数同时考虑到了光的吸收和散射作用,因而具有更高的精确度。
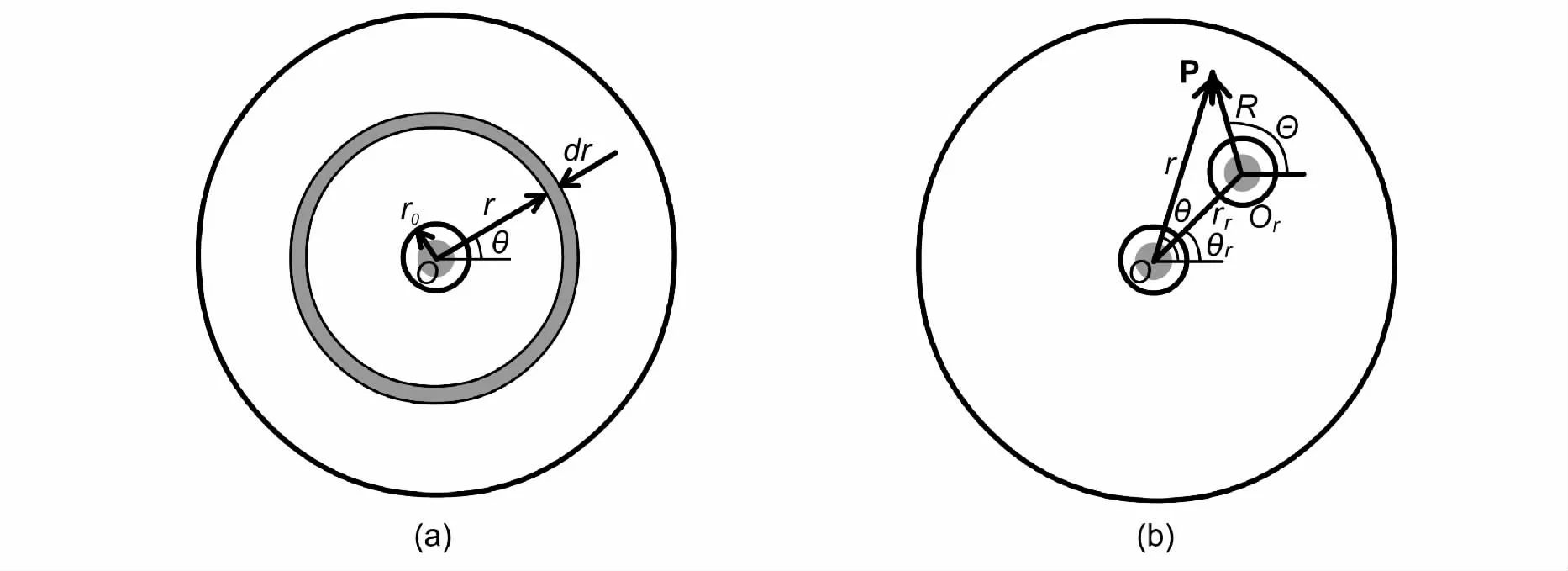
图5 内置单根发光体光生物反应器水平截面Fig.5 Schematic representations of a horizontal section of a photo-bioreactor with a single radiator
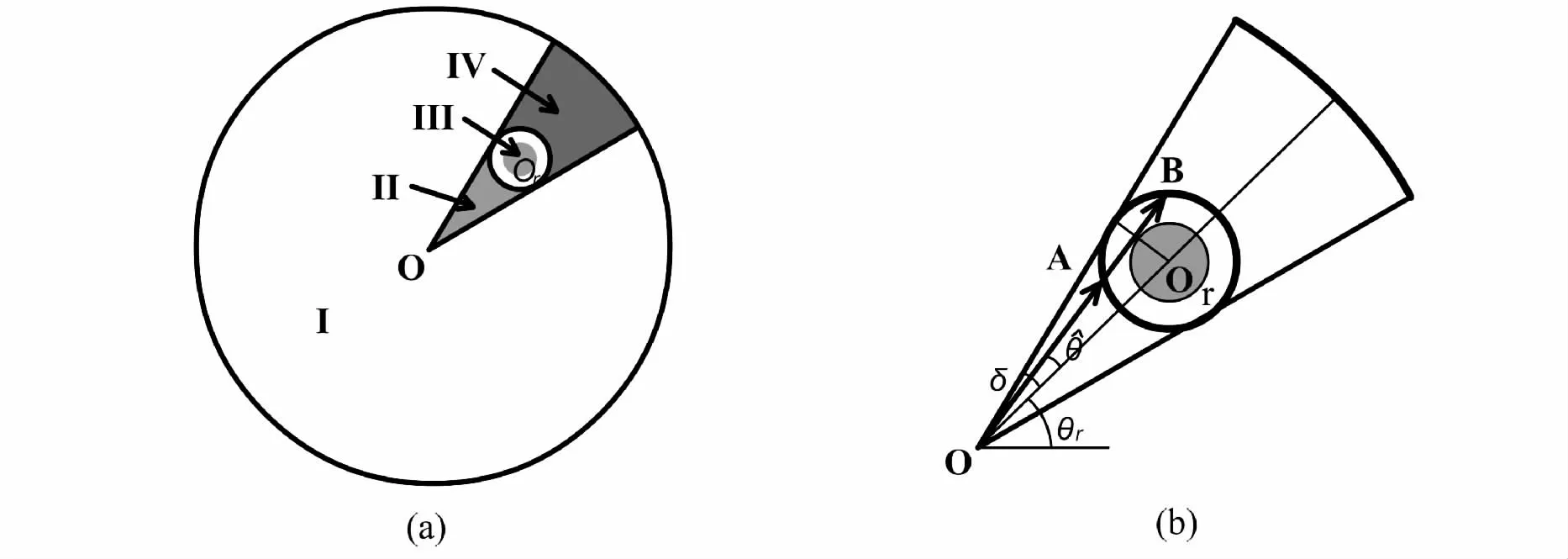
图6 光生物反应器中单根发光体水平截面结构Fig.6 Schematic representations of a horizontal section of a photobioreactor with a single radiator
2.3.2 内置光源圆柱形光生物反应器光分布模型 利用外置光源作为光能,光能由于四处辐射而存在以热能的形式耗散的现象。为了减少外置光生物反应器光能的损失,利用光导纤维,荧光灯,光发射板或发光二极管作为内置光源的光生物反应器已经构建[43-46]。然而没有精确的模型解释内置光源光生物反应器光分布的报道。Suh 和Lee[26]在圆柱形生物反应器中以荧光灯管为内置光源研究了不同灯管数下光分布情况,得出任意点和平均光强的数学表达式,其几何关系图如图5 和图6,光生物反应器中任意点光强表达式(14):
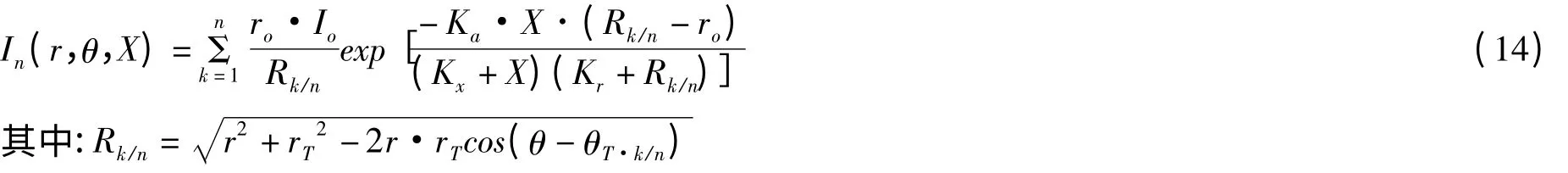
光生物反应器中平均光强表达式(15):
在圆柱形光生物反应器中培养Synechococcus sp.PCC 6801 时,利用式(14)和(15)验证不同的培养密度下光强的变化,发现该模型的计算值和实验值能很好的吻合。该模型也能很好的应用于描述不同几何形状光生物反应器中光分布状况。
3 展望
光衰减导致的光强分布不均匀在光生物反应器中普遍存在,因此光衰减模型和光强分布模型对于研究微藻在不同类型反应器中的光能传递和利用规律提供了很好的理论依据。利用这些模型,我们不但能及时了解微藻培养过程中光强的动态变化,而且可以根据实际需求进一步优化微藻培养工艺,尽可能提高微藻的培养密度和光能利用效率。但在实际培养过程中,由于光生物反应器中光强的不均匀分布导致微藻密度低的问题依然非常突出。因此要提高微藻的培养密度和光能利用效率,除了进一步加强对微藻培养过程中光强分布理论模型的研究外,还可以从以下几方面入手:
(1)微藻光合作用效率机理模型的构建。利用工程水平、细胞水平相结合手段来提高微生物反应器中的能量利用效率是当前多尺度研究的热点,微藻大规模产业化工艺离不开多尺度角度的开发。微藻培养中光生物反应器中光分布模型仅从光的入射、折射和散射等方面来描述光的传递,这些模型仅从工程学角度阐述光生物反应器中光能的分布,而光能的实际利用效率是光传递到藻细胞后被吸收和利用所消耗的能量,因此仅采用这些模型来计算微藻利用光能的实际效率肯定存在一些误差。本实验室在传统光传递理论的基础上,结合叶绿素荧光技术研究聚球藻7942 的光合作用机理,建立了一个新的光能利用模型[47-48]。该模型不仅从细胞生长的宏观角度,而且还从光合作用机制和代谢的微观角度探讨聚球藻7942 的光合利用效率,该模型的建立为新型高效光生物反应器的开发及实现微藻大规模培养奠定理论基础,同时也为从多尺度构建理论模型提供有益的借鉴。
(2)设计和开发新型的光生物反应器。根据光衰减规律和光强分布模型,可以设计开发新型高效的光生物反应器,一方面可以增加光强分布的均匀性,另一方面改变反应器中的流场特性,增加微藻的平均受光时间,从而达到均匀受光的目的[49-51]。
利用光能进行光合作用是大多微藻生长的重要特征,因此提高光能的传递和利用效率是微藻培养的重要研究课题之一。作为基础研究的光衰减和光能分布模型,为实现微藻培养的高效和规模化奠定了坚实的理论基础。随着科学技术的发展,加上各种新材料、新型高效光源的出现与使用,必将使微藻在光生物反应器中的培养工艺更加先进和高效。
[1]Harun R,Singh M,Danquah M K,et al.Bioprocess engineering of microalgae to produce a variety of consumer products[J].Renew Sust Energ Rev,2010,14(3):1037 -1047.
[2]Eriksen N T.The technology of microalgal culturing[J].Biotechnol Let,2008,30(9):1525 -1536.
[3]Wijffels R H,Barbosa M J.An Outlook on Microalgal Biofuels[J].Science,2010,329(5993):796 -799.
[4]Kruse O,Hankamer B.Microalgal hydrogen production[J].Curr Opin Biotechnol,2010,21(3):238 -243
[5]Kong Q X,Li L,Ruan R,et al.Culture of microalgae chlamydomonas reinhardtii in wastewater for biomass feedstock produc-tion[J].Appl Biochem Biotechnol,2010,160(1):9 -18.
[6]Morais M G,Cost J A V.Biofixation if carbon dioxide by Spirulina sp.and Scenedesmus obliquus cultivated in a three-stage serial tubular photobioreactor[J].J Biotechnol,2007,129:439 -445.
[7]Ho S H,Chen C Y,Lee D J,et al.Perspectives on microalgal CO2-emission mitigation systems — A review[J].Biotechno Adv,2011,29(2):189 -198.
[8]Lüning K Light.In:Lobban C S,Wynne M J,editors.Biology of seaweeds[M].Berkeley:University of California Press,1981:326 -355.
[9]Prokop A,Erickson L E. Photobioreactors. In:Asenjo J A,Merchuk J C,editors. Bioreactor system design[M]. New York:Marcel Dekker,1995:441 -477.
[10]Ogbonna J C,Tanaka H.Light requirement and photosynthetic cell cultivation -development of processes for efficient light utilization in photobioreactors[J].J Appl Phycol,2000,12:207 -218.
[11]Zijffers J M F,Janssen M,Tramper J,et al.Design process of an area-efficient photobioreactor[J].Mar Biotechnol,2008,10(4):404 -415.
[12]Rabe A E,Benoit R J.Mean light intensity—a useful concept in correlating growth rates of dense cultures of microalgae[J].Biotechnol Bioeng,1962,4:377 -390.
[13]Cornet J F,Dussap C G,Dubertret G.A structured model for simulation of cultures of the cyanobacterium Spirulina platensis in photobioreactors:I Coupling between light transfer and growth kinetics[J].Biotechnol Bioeng,1992,40:817 -825.
[14]Cornet J F,Dussap C G,Gros J B. Conversion of radiant light energy in photobioreactors[J]. AIChE J,1994,40:1055 -1066.
[15]Cornet J F,Dussap C G,Gros J B.A simplified monodimensional approach for modeling coupling between radiant light transfer and growth kinetics in photobioreactors[J].Chem Eng Sci,1995,50:1489 -1500.
[16]Acién Fernádez F G,García Camacho F,Sánchez Pérez J A,et al.A model for light distribution and average solar irradiance inside outdoor tubular photobioreactors for microalgal mass culture[J].Biotechnol Bioeng,1997,55:701 -714.
[17]Evers E G.A model for light-limited continuous cultures:Growth,shading,and maintenance[J].Biotechnol Bioeng,1991,38:254 -259.
[18]Yun Y S,Park J M.Attenuation of monochromatic and polychromatic lights in Chlorella vulgaris suspensions[J].Appl Microbiol Biotechnol,2001,55:765 -770.
[19]康瑞娟,蔡昭铃,施定基.光强在鱼腥藻7120 培养液中衰减及其对藻细胞生长的影响[J].化工冶金,2000,21(4):384 -388.
[20]康瑞娟,蔡昭铃,施定基.蓝藻培养体系中光强衰减的研究[J].水生生物学报,2002,26(3):310 -313.
[21]陈烨,骆其君,马斌,等.角毛藻光衰减特性及其在光生物反应器培养中的应用[J].宁波大学学报:理工版,2004,17(2):143 -146.
[22]张志斌,颜日明,朱笃,等.气升式反应器培养集胞藻6803 过程中光能利用特性研究[J].海洋通报,2009,28(4):54-61.
[23]温少红.螺旋藻培养液光衰减规律的研究[J].海洋通报,2001,20(4):92 -96.
[24]温少红,王长海,鞠宝,等.紫球藻培养液光衰减规律的研究[J].海洋通报,2001,20(2):35 -39.
[25]Suh I S,Lee S B. Cultivation of a cyanobacterium in an internally radiating air - lift photobioreactor[J]. J App Phycol,2001,13:381 -388.
[26]Suh I S,Lee S B.A light distribution model for an internally radiating photo- bioreactor[J].Biotech Bioeng,2003,82(2):180 -189.
[27]朱笃,李元广,叶勤,等.转基因聚球藻7942 培养中光传递及其对细胞生长的影响[J].过程工程学报,2003,3(3):231 -237.
[28]刘晶麟,张嗣良.光生物反应器微藻生长与比消光系数的关系[J].化学反应工程与工艺,1999,15(4):407 -415
[29]Cornet J F,Dussap C G,Gros J B. Kinetics and energetics of photosynthetic microorganisms in photobioreactors[J]. Adv Biochem Eng,1998,59:155 -222.
[30]Pottier L,Pruvost J,Deremetz J,et al.A fully predictive model for one-dimensional light attenuation by Chlamydomonas reinhardtii in a torus photobioreactor[J].Biotechno1 Bioeng,2005,91 (5):569 -582.
[31]Guterman H,Vonshak A,BenYaakov S.A macromodel for outdoor algal mass production[J].Biotechnol Bioeng,1990,35:809 -819.
[32]Sukenik A,Levy R S,Levy Y,et al.Optimizating algal biomass production in an outdoor pond:A simulation model[J].J Ap-pl Phycol,1991,3:191 -201.
[33]Molina Grima E,García Camacho F,Sánchez Pérez J A,et al.Evaluation of photosynthetic efficiency in microalgal cultures using averaged irradiance[J].Enzyme Microb Technol,1997,21:375 -381.
[34]Alfano O M,Romero R L,Cassano A E.Radiation field modelling in photo reactors homogeneous media[J].Chem Eng Sci,1986,41:421 -444.
[35]许波,王长海.微藻的平板式光生物反应器高密度培养[J].食品与发酵工业,2003,29(1):36 -40.
[36]Hoekema S,Rutger D,Janssen M,et al.Controlling light-use by Rhodobacter capsulatus continuous cultures in a flat-panel photobioreactor[J].Biotechno1 Bioeng,2006,95 (4):613 -626.
[37]Chae S R,Hwang E J,Shin H S,et al.Single cell protein production of euglenagracilis and carbon dioxide fixation in an innovative photobio reactor[J].Bioresour Technol,2006,97:322 -329.
[38]Duffie J A,Beckman W A.Solar Engineering of Thermal Processes[J].John Wiley & Sons,New York,1980.
[39]García Camacho F,Acién Fernádez F G,Molina Grima E,et.al.Use of concentric-tube airlift photobioreactors for microalgal outdoor mass cultures[J]. Enz Microbia1 Techno1,1999,24:164 -172.
[40]Molina Grima E,García Camacho F,Sánchez Pérez J A,et al. A mathematical model of microalgal growth in light limited chemostat cultures[J].J Chem Technol Biotechnol,1994,61:167 -173.
[41]Molina Grima E,Fernández Sevilla J M,Sánchez Pérez J A,et al.A study on simultaneous photolimitation and photoinhibition in dense microalgal cultures taking into account incident and average irradiances[J].J Biotechnol,1996,45:59 -69.
[42]Yokota T,Yashima K,Takahashi K,et al.A new random-walk model for assessment of light energy absorption by a photosynthetic microorganism[J].J Chem Eng Jpn,1991,24:558 -562.
[43]Javanmardian J,Palsson B O.High -density photoautotrophic algal cultures:Design,construction,and operation of a novel photobioreactor system[J].Biotechnol Bioeng,1991,38:1182 -1189.
[44]Matsunaga T,Takeyama H,Sudo H,et al.Glutamate production from CO2by marine cyanobacterium Synechococcus sp.using a novel biosolar reactor employing light-diffusing optical fibers[J].Appl Biochem Biotechnol,1991,28/29(1):157 -167.
[45]Ogbonna J C,Yada H,Masui H ,et al.A novel internally illuminated stirred tank photobioreactor for large-scale cultivation of photosynthetic cells[J].J Biosci Bioeng,1996,82:61 -67.
[46]Csögör Z,Herrenbauer M,Perner I,et al.Design of a photo-bioreactor for modeling purposes[J].Chem Eng Process,1999,38:517 -523.
[47]Yan R,Zhang Z,Zhu D,et al. Characterization of energy conversion of Synechococcus sp. PCC7942 under photoautotrophic conditions based on metabolic flux and chlorophyll fluorescence analysis[J].Biotechnol Bioproc E,2011,16(3);520 -530.
[48]颜日明.聚球藻7942 光自养本征生长动力学及其能量利用研究[D].上海:华东理工大学,2011.
[49]林晨,李元广,王伟良,等.一种新型多节隔板-平板式光生物反应器的数值和实验研究[J]. 高校化学工程学报,2009,23(2):263 -269.
[50]Kliphuis A M J,Winter L,Vejrazka C,et al.Photosynthetic efficiency of Chlorella sorokiniana in a turbulently mixed short light-path photobioreactor[J].Biotechnol Prog,2010,26(3);687 -696.
[51]Cuaresma M,Janssen M,Vílchez C W.Horizontal or vertical photo- bioreactors How to improve microalgae photosynthetic efficiency[J].Bioresour Technol,2011,102(8):5129 -5137.

