一个建鲤家系的遗传多样性及微卫星标记与经济性状相关性分析
李建林,李红霞,唐永凯,俞菊华
(中国水产科学研究院 淡水渔业研究中心/农业部淡水渔业和种质资源利用重点实验室,江苏 无锡214081)
建鲤(Cyprinus carpio var.jian)是我国鲤养殖品种中重要的一个品种,也是我国养殖鱼类杂交选育成功的第一个品种[1]。它以荷包红鲤和元江鲤为亲本,通过多系杂交、选育和雌核发育技术相结合,再经横交固定而成的遗传性状稳定的鲤鱼新品种[2]。与其它鲤鱼品种相比,该鱼体型偏长,生长快、肉质好、易起捕、抗逆性强,可在不同地区不同养殖模式进行养殖[3],1996 年该鱼被农业部审核为适宜推广的水产优良品种[4],目前,已在我国普及养殖并取得了巨大的经济效益和社会效益。作为人工育成品种,在大规模育种和推广过程中,要保持其优良的经济性状和遗传稳定性,仍需要对建鲤不断地进行选育保种和遗传保护。
微卫星DNA(microsatellite DNA),又称简单序列重复(SSR)和短串联重复(STR)。微卫星标记作为第二代遗传标记与其他遗传标记与同工酶、RAPD、RFLP 等相比,具有多态性丰富、检测分析容易、重复性好、共显性的孟德尔式遗传等优点,被广泛用于群体遗传分析、经济性状联锁和QTL 定位分析、品种鉴定等研究中[5-8]。标记辅助选择(Marker assisted selection,MAS)目前是一个比较活跃的研究领域,它不易受环境的影响,且没有性别、年龄的限制,可进行早期选种,缩短世代间隔。随着近几年来鲤鱼微卫星分子标记的开发及利用的迅速发展,微卫星分子标记用于鲤鱼的遗传结构分析和辅助育种已有较多的报导。孙效文等[9]分析了镜鲤2 个繁殖群体的遗传结构,找到了与体质量相关的基因型。鲁翠云等[10]通过用微卫星分子标记分析镜鲤亲本的遗传结构并指导家系亲本的选配,获得了良好的选育效果。本研究以选育中的建鲤家系为实验材料,用微卫星标记技术分析它们的遗传多样性及微卫星标记与体质量、体型(体高/体长)的相关性,为选育过程中建鲤遗传变异、分子标记辅助育种提供依据和参考。
1 材料与方法
1.1 实验材料
实验鱼取自于中国水产科学研究院淡水渔业研究中心宜兴养殖基地,建鲤12 个家系孵化后分别用网箱养至25 g 左右,再用PIT(Passive Integrated Transponder)标记后于同一池塘养殖至成鱼(1 冬龄)测量鱼体长、体质量、体高等生长参数。从12 个家系中选取生长较快的1 个家系43 尾鱼用于实验分析。剪取样本鳍条,用95%酒精保存备用。
1.2 方法
1.2.1 基因组DNA 提取 样本鳍条用蛋白酶K 消化12 h 后,用酚-仿法抽提总DNA,再通过琼脂糖凝胶电泳和紫外分光光度计分别测定DNA 基因组的完整性、浓度和纯度,稀释DNA 至50 ~100 ng/μL,4 ℃保存备用。
1.2.2 引物合成及PCR 反应 根据文献[10 -13]随机选择部分微卫星位点,微卫星引物由上海博尚生物技术有限公司合成。表1 列出了经筛选得到的16 对在建鲤中有多态性,且能扩增出清晰条带的引物序列和退火温度。PCR 反应总体积为10 μL,其中含10 × 反应缓冲液1.0 μL,20 mmol/L MgCl21.0 μL,2.5 mmol/L dNTP 0. 8 μL,10 μmol/L 引物0. 1 μL,5 U/μL Taq 酶0. 1 μL,50 ~100 ng/μL DNA 1.0 μL,用灭菌双蒸馏水补足体积。PCR 反应条件为:94 ℃3 min;94 ℃20 s,退火20 s,72 ℃20 s,30 个循环;72 ℃延伸8 min;4 ℃ 保存,PCR 仪为Eppendorf 5345 型。
1.2.3 电泳及染色 PCR 产物用8.0%的非变性聚丙烯酰胺凝胶电泳分离后,用0.1%硝酸银染色10 min,再经显色液(2%NaOH,0.04%Na2CO3,1%甲醛)显色、拍照记录电泳结果。根据25 bp DNA Step Ladder(Promega)分子量标记估计PCR 扩增片段大小,并分析等位基因和判定基因型,依据等位基因长度从小到大标为A、B、C 等进行记录。
1.2.4 数据分析 根据每个个体的基因型,建立基因型数据矩阵,用Cervus3.0 软件分析每一位点的观测杂合度(Ho)、期望杂合度(He),多态信息含量(PIC)及固定系数(FIS)等参数信息;用populations软件计算每个个体间的DA[14]遗传距离。采用SPSS 15.0 软件一般线性模型(GLM)对微卫星基因型与建鲤体质量、体型进行最小二乘方差分析。

表1 16 对微卫星引物序列及其反应条件的信息Tab.1 16 primer pair sequences and PCR reaction conditions
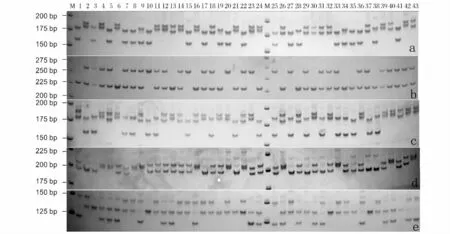
图1 位点MFW11(a)、CCA19(b)、KOI55 -569(c)、KOI83 -849(d)和HLJ3209(e)扩增的结果Fig.1 Results amplified by MFW11(a),CCA19(b),KOI55 -569(c),KOI83 -849(d)and HLJ3209(e)
2 结果与分析
2.1 16 个微卫星位点扩增结果及多态性
本实验筛选出了16 对微卫星引物在建鲤中扩增条带清晰,PCR 产物经过电泳后可以清楚地分辨等位基因和基因型,图1 为位点MFW4(a)、MFW10(b)、MFW11(c)和CCA19(d)扩增的结果。经统计分析,这16 个位点在本建鲤家系中都为多态位点,各位点检测到的等位基因数为2 ~4 个,共检测出等位基因53 个,平均每个位点3.3 个,所检测到的等位基因片段大小为124 ~282 bp;每个位点检测出基因型2 ~4 种,共检测出基因型共58 种,平均每个位点3.6 种。所有位点的基因型基本都符合孟德尔式遗传规律,未出现基因型严重偏离或基因型缺失现象。表2 列出各位点的基因片段大小、等位基因数和基因型数等。

表2 16 个微卫星位点的遗传信息Tab.2 Genetic information of the 16 microsatellite loci
2.2 群体遗传多样性
本实验16 个微卫星位点中有10 个位点在所有个体中都表现为杂合子,群体观察杂合度(Ho)、期望杂合度(He)分别为0.423 ~1 和0.355 ~0.750,平均分别为0.829 1 和0.648 5;16 个位点多态信息含量(PIC)为0.292 ~0.703,平均为0.576 6,有4 个位点多态信息含量为中度多态(0.25 <PIC <0.5),其余的位点为高度多态(PIC >0.5);固定系数(FIS)表明,只有1 个位点表现为杂合子缺失(FIS >0),其他15 个位点都表现为杂合子过剩(FIS <0)。平均固定系数为-0.284,说明该建鲤群体存在杂合子过剩现象。各位点详细遗传参数如表2 所示。经populations 软件计算得到43 ×43 的遗传距离矩阵,所有个体间的遗传距离为0.105 7 ~0.506 6,平均为0.403 9。
2.3 微卫星位点与体质量、体形相关性分析
最小二乘方差进行微卫星位点与体质量、体型的相关性分析结果表明,16 个微卫星位点中,与本建鲤群体体质量相关的微卫星位点有3 个,分别为CCA19,KOI55 -56 和HLJ320,与建体型相关的微卫星位点只有1 个位点,为KOI83 -84,对与体质量、体型相关的微卫星位点进行不同基因型间的多重比较结果如表2 所示。位点CCA19 检测到3 种基因型,其中AA 型个体平均体质量显著大于另外2 种基因型个体;位点KOI55 -56 检测到4 种基因型中,AC 型个体平均体质量显著小于BD、CD 型体质量;位点HLJ320 AB 型个体平均体质量显著大于其它3 种基因型个体。位点KOI83 -84 AC 型个体平均体高/体长值显著小于BC 型个体,说明位点KOI83 -84 检测出的AC 型个体体型较长,BC 型个体体型较宽。

表3 4 个微卫星位点不同基因型体质量、体型的多重比较Tab.3 The multicomparison on body weight and body shape of different genotypes in 4 micosatellite loci
3 结论与讨论
本研究所筛选到的16 个微卫星位点在建鲤能稳定扩增出清晰条带,说明这16 个位点在建鲤中适用性较好。16 个位点仅在本实验1 个家系中就检测出等位基因53 个,基因型58 种,平均每个位点等位基因3.3 个,基因型3.6 种(因微卫星位点按孟德尔遗传定律遗传,因此同一家系中等位基因和基因型一般不超过4 种),说明这些位点都有较高的多态性,能较好地用于建鲤群体遗传多样性评估。遗传多样性是生物多样性的核心,一般情况下,物种遗传多样性越丰富,对环境的适应性和生存能力就越强,反之,遗传多样性降低可导致其适应能力、生存能力降低最终导致物种退化[15]。杂合度是度量种群遗传多样性程度的重要参数,位点平均杂合度反映了群体遗传结构变异程度的高低,杂合度越大变异越大,对环境适应能力越强[16]。Dewoody 等[17]利用微卫星标记分析得出13 种淡水鱼类的平均杂合度为0.46。本实验建鲤家系平均观察杂合度(Ho)为0.829 1,说明该建鲤家系的遗传变异水平较高,有较强的适应力。群体内固定系数(FIS)反映了观察杂合度(Ho)和期望杂合度(He)之间的平衡关系,FIS值越接近零,基因型的分布越接近平衡状态。当FIS >0 时,表明杂合子缺失,FIS <0 时,表明杂合子过度[18]。本实验平均FIS= -0.284 <0,表现为杂合子过剩。根据Bostein 等[19]提出的衡量基因变异程度高低的多态信息含量指标,本实验中有4 个位点多态信息含量为中度多态(0.25 <PIC <0.5),其余的位点为高度多态(PIC >0.5),平均PIC 为0.576 6,这也说明了本实验建鲤家系遗传多样性比较丰富。本实验个体间的遗传距离为0.105 7 ~0.506 6,平均为0.403 9,说明建鲤同胞子代间也存在着一定的遗传差异,保持选育群体具有一定的遗传多样性,是现代育种中需要并运用的信息,这样才能将近亲繁殖控制在可接受的范围内[20]。综合各遗传参数,本建鲤家系遗传多样性丰富,具有较大的遗传潜力和选育空间。
在鱼类育种中,分子标记应用方向之一是利用基因型与经济性状的连锁关系作为选择这个性状优势品种的工具,在大多数水产品种选育中生长速度是最重要的经济性状[21],体型与出肉率有关[22],生长速度和体型也是鲤鱼最重要的经济性状,本实验的建鲤群体为1 冬龄的成鱼,体质量大也反映了生长速度快。Majumde 等[23]认为,多数利用近交群体进行经济性状的QTL 定位研究能够获得较为满意的结果。本实验用同一家系的建鲤进行微卫星标记与体质量、体型进行相关分析,因此所有个体具有相同的遗传背景,每个位点上的等位基因、基因型不超过4 种,可以避免因同一位点上的等位基因较多,同一基因型的个体数偏少而使与经济性状连锁的结果产生偏差或错误[9]。本实验中找到了与本建鲤群体体质量相关的微卫星标记有3 个,与体型相关的微卫星标记1 个。位点CCA19 中AA 型个体,位点KOI55-56 中BD、CD 型个体和位点HLJ320 中AB 型个体具有比较明显的生长优势,有望作为体质量或生长速度为选育目标的辅助标记;位点KOI83 -84 中AC 型个体体型偏长,BC 型个体体型偏宽,有望作为以体型为选育目标的选择标记。目前,国内外有关鱼类重要经济性状联锁分析或QTL 定位的报导已有很多,但成功应用分子标记辅助育种在水产中还少有报导[20],本实验样本所筛选到的这些标记能否在分子标记辅助育种中有利用价值还需做进一步的研究和验证。
[1]董在杰,朱健,袁新华,等. 建鲤基因组DNA 的RAPD 分析[J]. 湛江海洋大学学报,2002,22(1):3 -6.
[2]张建森,孙小异.建鲤新品系的选育[J].水产学报,2007,31(3):287 -292.
[3]孙小异.建鲤——我国养殖鱼类杂交选育的第一个品种[J].科学养鱼,1988(4):16 -17.
[4]中华人民共和国农业部公告第57 号[Z].中国水产,1996(12):9.
[5]张敏莹,徐东坡,刘凯,等.长江下游放流鲢群体遗传多样性的微卫星标记分析[J].江西农业大学学报,2012,34(1):141 -146.
[6]杜晓东,高远镇,邓岳文,等.利用微卫星标记进行马氏珠母贝家系遗传结构分析与系谱认证[J].水产学报,2011,35(12):1795 -1804.
[7]刘海金,朱晓琛,孙效文,等.牙鲆5 个养殖群体的遗传多样性分析[J].中国水产科学,2008,15(1):30 -37.
[8]杜晓东,高远镇,邓岳文,等.利用微卫星标记进行马氏珠母贝家系遗传结构分析与系谱认证[J].水产学报,2011,35(12):1795 -1804.
[9]孙效文,鲁翠云,匡友谊,等.镜鲤两个繁殖群体的遗传结构和几种性状的基因型分析[J]. 水产学报,2007,31(3):273 -279.
[10]鲁翠云,曹顶臣,孙效文,等.微卫星分子标记辅助镜鲤家系构建[J].中国水产科学,2008,15(6):893 -901.
[11]Crooijmans R P M A,Bierbooms V A F,Komen J,et al.Microsatellite markers in common carp.(Cyprinus carpio L.)[J].Animal Genetics,1997,28:29 –134.
[12]Yue G H,Ho M Y,Orban L,et al.Microsatellites within genes and ESTs of common carp and their applicability in silver crucian carp[J].Aquaculture,2004,234:85 –98.
[13]David L,Rajasekaran P,Fang J,et al. Polymorphism in ornamental and common carp strains(Cyprinus carpio L.)as revealed by AFLP analysis and a new set of microsatellite markers[J].Mol Gen Genomics,2001,266(3):353 -362.
[14]Nei M,Tajima F,Tateno Y.Accuracy of estimated phylogenetic trees from molecular data[J].Journal of Molecular Evolution,1983,19:153 -170.
[15]蒙子宁,庄志猛,金显仕,等.黄海和东海小黄鱼遗传多样性的RAPD 分析[J].生物多样性,2003,11(3):197 -203.
[16]Nei M.Estimation of average heterozygosity and genetic distance from a small number of individuals[J].Genetics,1978,89:583 -590.
[17]Dewoody J A,Avise J C.Microsatellite variation in marine freshwater and anadromous fishes compared with other animals[J].J Fish Biol,2000,56:461 -473.
[18]Weir B S,Cockerham C C.Estimation F-statistics for the analysis of population structure[J].Evolution,1984,38:1358-1370.
[19]Botstein D,White R L,Skolnick M,et al.Construction of a genetic linkage map in man using restriction fragment length polymorphism[J].American Journal of Human Genetics,1980,32:314 -331.
[20]Meuwissen T H E.Maximizing the response of selection with predefined rate of inbreeding[J].J Anim Sci,1997,75:934-940.
[21]Guimarães E P,Ruane J,Scherf B D et al.Marker-assisted selection,current status,and future perspectives in crops,livestock,forestry,and fish[M].FAO Rome,2007:307 -362.
[22]Marc J M Rutten,Henk Bovenhuis,Hans Komen.Genetic parameters for fillet traits and body measurements in Nile tilapia(Oreochromis niloticus L)[J].Aquaculture,2005,246:125 -132.
[23]Majumder P,Ghosh S. Mapping quantitative trait loci in humans:achievements and limitations[J]. Jain Invest,2005,115(6):1419 -1424.

