人脐带间充质干细胞最适宜培养条件研究
张玉琳 于纪棉 曾 斌 王静文 倪晶晶
浙江省宁波卫生职业技术学院,浙江 宁波 315104
人脐带间充质干细胞最适宜培养条件研究
张玉琳 于纪棉 曾 斌 王静文 倪晶晶
浙江省宁波卫生职业技术学院,浙江 宁波 315104
目的:探讨人脐带间充质干细胞 (UCMSCs)成功培养扩增的条件,以提高其培养的成功率。方法:无菌条件下采集足月胎儿脐带6份,分离培养UCMSCs,观察比较不同的新鲜程度、不同分离方法在相同的培养条件下对UCMSCs培养的影响,并对优化条件下培养的UCMSCs进行扩增,评估其贴壁细胞形成集落数。对培养得到的细胞进行表面抗原标志检测及其鉴定。结果:从足月胎儿新鲜脐带中采用组织块贴壁的方法,在5%血清浓度的IMDM培养基中,分离培养得到的UCMSCs成功机率最高,且生成集落数最多为(5.3±0.28)×105/0.5cm脐带组织,与双酶法比较存在明显差异(P<0.001);而胶原酶法接种后未见明显贴壁细胞。培养得到的UCMSCs细胞表面表达MSCs相关抗原CD29,但不表达造血细胞相关抗原CD34,表明此种自脐带中分离得到并诱导扩增的成纤维样细胞为间充质干细胞。结论:优化UCMSCs的培养条件,成功地建立稳定的培养方法,可提高UCMSCs培养成功率,为UCMSCs的实验研究和临床应用打下基础。
脐带间充质干细胞;培养条件
间充质干细胞(mesenchymal stem cells,MSCs)因其具有自我更新、多向分化潜能一直是干细胞的研究热点。目前研究最多的是在成人骨髓、胎儿脐血中分离培养的MSCs[1],但研究发现骨髓源MSCs的含量会随着年龄的增长而下降,而脐血源MSCs受到伦理道德的影响,培养的成功机率又不高[2],这些都限制了MSCs在临床上的应用。近年来,大量的研究已证实在人脐带中也能分离得到MSCs,即脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs),但由于没有标准的分离方法及培养条件,使得其成功培养受到限制,尤其是如何稳定、高效地从脐带中获得MSCs[3]。本研究拟通过比较脐带的新鲜程度、不同的消化方法的影响,来寻求最佳的培养优化条件,以获得更高的UCMSCs培养成功率。
1 材料与方法
1.1 材料 实验所用6份脐带均来自于宁波市明州医院妇产科健康产妇,足月顺产 (经医院伦理委员会许可,产妇签署知情同意书)。待胎儿娩出后,剪下脐带,置于预先盛有IMDM培养液的无菌瓶中待用。主要试剂:胎牛血清(北京灏洋生物),IMDM(GiBCO),胰蛋白酶、胶原酶、姬姆萨染料、多聚赖氨酸、PHA(Sigma),2-巯基乙醇、氢化可的松、L-谷氨酰胺 (上海源聚生物科技公司),丝裂霉素 (浙江海正药业公司),淋巴细胞分离液 (吉林博特生物技术有限公司),免疫细胞化学试剂盒 (北京邦定泰克生物技术公司)。
1.2 方法
1.2.1 脐带分离方法的比较及对培养得到的UCMSCs进行鉴定 在无菌条件下将脐带用含100U/Ml庆大霉素的生理盐水洗涤数次,剔除脐静脉与脐动脉,充分冲洗去除血凝块,然后用剪刀将其剪成约1mm3碎块,分别采用三种不同的分离方法。即一段采用组织块贴壁法进行分离培养,另两段分别采用胶原酶法和双酶法 (胶原酶加胰蛋白酶法)进行分离。收集悬浮细胞,接种于含5%FCS的IMDM的培养瓶内,37℃,5%CO2饱和湿度条件下培养,每3天半量换液1次,待成纤维样细胞爬出,细胞达到80%汇合时,用0.25%胰蛋白酶进行消化,按1∶3传代。对上述方法培养的细胞进行观察记录,分析比较三种方法对UCMSCs培养的成功率。取第5代的UCMSCs细胞,通过免疫细胞化学的方法检测UCMSCs表面抗原标志。
1.2.2 脐带新鲜程度对原代UCMSCs培养的影响 待胎儿娩出后,将脐带剪下分成3段,其中一段立即采用组织块贴壁法分离培养UCMSCs,另外两段放在无菌瓶中分别于-20℃和-70℃冻存,次日将冻存的脐带快速解冻,再采用组织贴壁法进行细胞培养。3组脐带均用同一培养基培养,每日观察记录。
1.2.3 评估UCMSCs贴壁细胞形成集落数 将上述分离方法培养的细胞至第14天,移去未贴壁细胞,在倒置显微镜下可见培养瓶底部有集落形成,计数其形成集落数,超过50个细胞为一个集落。对三种分离方法得到的集落细胞数目进行计数并比较分析。当培养的细胞达到80%汇合时,用0.25%胰蛋白酶进行消化对其进行传代,以2.5×103/cm2浓度接种,传至10代,计算每代细胞扩增的倍数。
1.3 统计学分析 采用SPSS11.0统计软件,计量数据以均数±标准差 (±s)表示,组间比较采用t检验进行统计学分析。
2 结果
2.1 UCMSCs的鉴定及不同分离方法对其培养的影响 原代培养的细胞约24~48h内进行贴壁生长,培养72h后在倒置显微镜下可见成纤维样梭形、多角形细胞出现,当细胞生长达到80%汇合时,对其进行传代,连续传5代,细胞形态无明显改变(图1,2)。对培养第5代的UCMSCs进行免疫细胞化学检测的结果显示其表面抗原标志CD29呈阳性,而造血细胞系的表面抗原标志CD34为阴性 (图3)。这与脐血源MSCs的表面抗原标记相一致[4]。足月新鲜的脐带在相同的培养条件下,其中6份脐带中采用组织块贴壁法成功分离出中MSCs,成功率为100%;而采用双酶法(胶原酶加胰蛋白酶法)进行分离的成功率为66.67%,用胶原酶法消化接种后未见明显贴壁细胞,见表1。


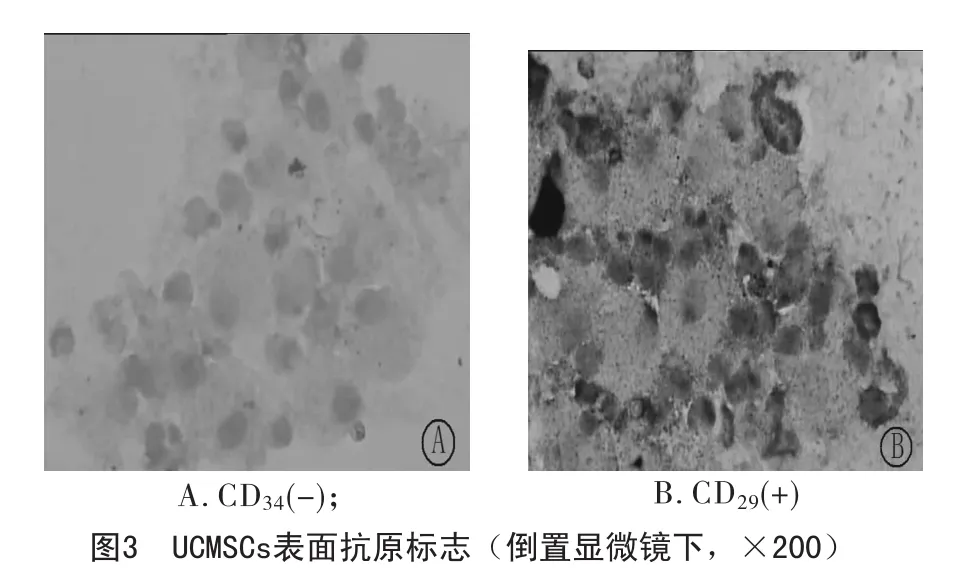

表1 不同消化方法对脐带MSCs培养的影响(n=6)
2.2 不同新鲜程度的脐带对UCMSCs培养的影响 足月新鲜的脐带采用适当的分离方法均能成功地培养出UCMSCs,而于-20℃和-70℃将脐带冻存,次日快速解冻,再进行分离培养的脐带在培养4周左右均未见MSCs样细胞出现(图4)。

2.3 UCMSCs贴壁细胞形成集落数 按上述方法常规培养至第14天,移去未贴壁细胞,倒置显微镜下可见组织块贴壁法和双酶消化法均可见培养瓶底有由数十至数百个纺锤形、梭形、三角形、圆形等细胞组成的集落生成。其中采用组织块贴壁方法生成集落数与其他分离方法相比有统计学差异,t=45.11(P<0.001),且形成集落数最多为(5.3±0.28)×105/0.5cm脐带组织,按照每根脐带均长为40cm计算,平均可得到原代贴壁细胞4.24×107。对得到的UCMSCs进行传代,至少可稳定传10代,采用组织块贴壁法分离培养平均每代可扩增6.1倍(t=2.25,P<0.05),结果见表2。

表2 UCMSCs贴壁细胞形成集落数(n=6)
3 讨论
UCMSCs是MSCs的新生力量,其生物学特征与其他来源MSCs相似,但在增殖能力、CFU-F频率等方面甚至要优于其他来源[5]。因此,UCMSCs作为一种新的种子细胞,在疾病的细胞移植及基因治疗中具有良好的的研究和应用前景。Romanov等[6]认为胎儿血液循环中MSC随胎儿的成熟,大部分定位在脐静脉内皮下层和胎盘。这可以部分解释脐带富含MSC的原因。但是由于其分离方法和培养条件等方面技术还不成熟,使得UCMSCs的临床研究相对滞后。近几年实验人员在对其研究过程中也体会到从人脐带中能成功培养出MSCs并不容易,特别是如何稳定、高效地从脐带中获得MSCs以满足基础和临床研究的需要是一个亟待解决的问题[7]。
本实验从足月胎儿新鲜脐带中采用组织块贴壁的方法,在5%血清浓度的IMDM培养基中,分离培养得到的UCMSCs成功机率最高,且生成集落数最多为(5.3±0.28)×105/0.5cm脐带组织。采用双酶法进行分离所得到的UCMSCs与组织贴壁法分离相比有明显的差异,远不如组织贴壁法;而采用胶原酶法进行分离没有培养出UCMSCs。采用酶消化效果不好的原因可能是脐带组织中成分比较复杂[8],酶难以将其消化,也可能是在用酶消化过程中,酶在消化组织分离细胞的同时将细胞也消化了。酶解法虽然获得细胞数量大,培养时间短,但细胞纯度略低,操作复杂、耗时较长、技术要求较高,同时还存在对细胞的化学污染和机械操作,同时异源蛋白的引入会增加临床应用过程中发生过敏反应的可能性。与此相比,组织块贴壁法对细胞直接损伤小,原代培养细胞纯度高,简单、经济,能够更好地保持细胞的活力、减少污染机会,培养体系中几乎见不到造血干细胞及其他细胞混杂,但所需培养时间长[9]。研究中还发现脐带的新鲜程度对MSCs的成功培养也至关重要,新鲜脐带更利于培养[10],由于其属于原始细胞,冻存后不易存活,加之在冻存和解冻过程中与外界接触时间较长,增加了污染的机率,如果脐带在冻存过程中处理不当,易使大部分细胞活性丧失,则更难以分离培养出MSCs。
综上所述,在足月新鲜的脐带中采用组织贴壁法进行分离可得到较丰富的UCMSCs,且其形态较一致,细胞成分较纯。因此,优化UCMSCs的培养条件,成功建立稳定的UCMSCs培养方法,可提高UCMSCs培养成功率,为UCMSCs的实验研究和临床应用打下基础。
[1]Sanchez-Ramos J.Stem cells from umbilical cord blood[J].Scmin Reprod Med,2006,24(5):358-369.
[2]张华芳,徐景涛,孙丽等.早产胎儿脐血和脐带间充质干细胞分离培养的比较[J].山东医药,2011,50(11):16-18.
[3]Kestendjieva S,Kyurkchiev D,Tsvetkova G,et al.Characterization of mesenchymal stem cells isolated from the human umbilical cord[J].Cell Biol lnt,2008,32(7):724-732.
[4]许超,廖继东,柳菁,等.长期培养人脐血间充质干细胞的生物活性及其限制作用[J].中国组织工程研究与临床康复,2011,3(10):1750-1754.
[5]Lechner V,Hocht B,Ulrichs K,et al.Obtaining ofmesenchymal progenitor cells from the human umbilical cord[J].Zentralbl Chir,2007,132(4):358-364.
[6]Romanov YA,Svintaitakaya VA,Smironov VN.Searching for Iternative sources of postnatal humanmesenchymal stem cells:andidate MSC-like cells from umbilical cord[J].Stem Cells,2003,21(1):105-110.
[7]徐燕,李长虹,孟恒星等.人脐带间充质干细胞分离培养条件的优化及其生物学特性[J].中国组织工程研究与临床康复,2009,13(32):6289-6294.
[8]徐若男,施明,王福生.人脐带间充质干细胞的特征及其临床应用前景[J].中国免疫学杂志,2010,26(1):82-84.
[9]张玉琳.人脐带间充质干细胞抑制同种异体脐血淋巴细胞的转化 [J].基础医学与临床,2012,32(8):930-934.
[10]窦慧慧,郭文君,于丽等.人脐带间充质干细胞分离培养方法的研究[J].中国组织化学与细胞化学杂志,2010,19(2):186-189.
Discussion on the best culture conditions of hum an umbilical cord m esenchymal stem cells
ZHANG Yu-Lin,YU JI-Mian,ZENG Bin,WANG Jing-Wen,NIJing-Jing
Department of Human Morphplogy,Ningbo College of Health Sience,Ningbo 315104
Objective:To optimize the culture conditions of human umbilicalmesenchymal stem cells(UCMSCs),and improve the culture achievement ratio.Methods:Umbilical cord were collected from full term deliveries,mesenchymal stem cells(MSCs)were isolated from the umbilical cord.The influences of different dgrees of freshness,separation methods in the same conditions on UCMSCs were oberved,and followed by counted colony numbers.UCMSCswere isolated from umbilical cord,the purity ofMSCswas analyzed by ICC.Results:When the other conditionswere the same,fresh umbilical cord from full-term deliveries,method of tiling the tissue,in the IMDM+5%FCSmudium had the best results.An 0.5 cm umbilical cord tissues contained(5.3±0.28)×105adhesive cellswere harvested at the primary culture.The cells yields and doubling times in explantation technique group were higher than those in enzymes combination digestion group(P<0.001).While therewas no adhesive cells could be found in collagenase digestion group.The cultured cells expressed MSCs-related antigen CD29 but did not express hematopoietic cell antigen CD34.Conclusion To optimize the culture conditions of UCMSCs,can improve the success rate of UCMSCs culture,providing a basis for research and clinical application.
Umbilical cord mesenchymal stem cells;Culture conditions
R329.2
A
1007-8517(2013)11-0031-03
2013.04.05)
浙江省教育厅科研项目课题(编号:Y201226068)。
张玉琳,Email:zhangyulin219@sohu.com

