蜡样芽胞杆菌生长/非生长界面模型的建立和评价*
陈琛,杨宪时,李学英
1(中国水产科学研究院东海水产研究所,上海,200090) 2(上海海洋大学食品学院,上海,201306)
预测微生物学是运用微生物学、工程数学以及统计学进行数学建模,利用所建模型,通过计算机及其配套软件在没有进行微生物检测的情况下快速有效地预测微生物的生长与死亡规律[1]。预测微生物学的核心是数学模型的建立,预测数学模型可分为动力学模型和概率模型、经验模型和理论模型、初级模型、二级模型和三级模型等[2]。自20 世纪90 年代以来,动力学模型一直为预测微生物学的研究重心[3]。虽然这类模型能够描述微生物生长与环境因子之间的数量关系,预测食品的货架期,但是它只能描述微生物的生长情况,却不能表述微生物的非生长情况。而概率模型既可以描述微生物生长情况也可以描述微生物的非生长情况[4]。与腐败菌达到一定数量食品才会出现问题不同,致病菌处于任何生长期都有引起中毒的潜在危险,对于含有潜在致病菌和产毒素菌株的食品来说,描述其生长/非生长情况比描述其生长速率更有意义。
蜡样芽胞杆菌是条件致病菌,由蜡样芽胞杆菌引起的食物中毒居细菌性中毒的第4 位,且有增长的趋势[5]。最常见的是通过产生腹泻毒素和呕吐毒素导致食物中毒。Andersson A 等人[6]指出当食品中蜡状芽胞杆菌数>103 cfu/g 时,对消费者即产生潜在的危害。软烤虾仁是一种高水分的烤虾制品,属于温和加工类制品。由于加工条件温和,耐高温的蜡样芽胞杆菌很可能残存下来,实验证明蜡样芽胞杆菌是软烤虾仁产品的主要变质菌[7]。因此以软烤虾仁为原料,研究并建立产品中蜡样芽孢杆菌在不同栅栏因子作用下的生长/非生长模型,为抑制蜡样芽孢杆菌生长,进一步优化生产条件提供参考。
本文旨在运用logistic 回归模型建立纯培养基下蜡样芽胞杆菌在温度、水分活度和pH 环境因子协同作用下的生长/非生长界面模型。为软烤虾仁产品中蜡样芽胞杆菌的生长/非生长界面模型的建立提供了方法性参考。
1 材料与方法
1.1 实验材料
菌株:蜡状芽胞杆菌菌株分离自贮藏后期的高水分软烤虾仁。菌株分离与鉴定方法参见GB/T 4789.14 -2003 和文献[8-10]. 将分离的蜡状芽胞杆菌菌株接种到无菌TSB 液体培养基中,加入无菌甘油混匀,置于-70 ℃冰箱中保藏备用。高水分软烤虾仁由浙江省舟山市越洋食品有限公司提供。
1.2 仪器与试剂
Sanyo MIR 153、253 高精度培养箱,日本;OLYMPUS CX41 电子光学显微镜,日本OLYMPUS 公司;SA-960-II SHJ-系列净化工作台,上海净化设备厂;Power wave XS 酶标仪,美国Bioteck 公司;IUL 均质器,上海德记行科技发展有限公司;电热恒温水浴锅DK-S24,上海精宏实验设备有限公司;pHS-2C 型酸度计,上海伟业仪器厂;LabMASTER-aw 型水分活度仪 瑞士Novasina 公司;Sensitire Automated Microbiology System 微生物鉴定和药敏分析仪,英国TECK Diagnostic Systems 公司。
脑心浸液肉汤培养基(BHI),购买于英国OXOID公司;胰蛋白胨大豆肉汤(TSB)和胰蛋白大豆琼脂(TSA),购买于北京陆桥;NaCl、NaOH、KH2PO4、HCl,均为国产分析纯,上海国药化学试剂公司。
1.3 实验方法
1.3.1 菌悬液的准备
菌株采取斜面低温保藏法[11]于4 ℃冰箱中保藏。每月移种1 次,实验前无菌挑取1 环斜面保藏菌株接种到装有10 mL 无菌BHI 肉汤培养基的试管中,置于37 ℃培养,培养24 h 之后从该试管中无菌吸取1 mL 培养液接种于装有9 mL 无菌BHI 肉汤培养基中置于37 ℃培养18 h,以使菌株达到生长稳定期,菌悬液备用。
1.3.2 蜡样芽胞杆菌生长最低温度(Tmin) 、最低水分活度(Awmin) 和最小pH 值( pHmin) 的确定
Tmin的确定:添加甘油调节BHI 培养基的Aw值为0.99,并用1 mol/L 的HCl 调节培养基的pH 值为6.5。将调节好的培养基分装到若干试管后灭菌,待灭菌后测定其最终的Aw值和pH 值。将上述培养基无菌操作移取到7 个灭菌96 孔板里,每个小孔分装200 μL,分别做4 个平行。将菌悬液适当稀释到103cfu/mL 数量级,分别吸取50 μL 到上述的小孔中,然后滴加50 μL 的无菌石蜡油并盖上无菌塑料盖,分别置于15,20,25,30,35,40 ℃恒温箱中培养[12-13]。每小时取出培养板放入微孔板扫描分光光度计中读取各孔在光波长600 nm 下的OD值。测绘不同温度下的蜡样芽胞杆菌的生长曲线,并计算出相应的蜡样芽胞杆菌的生长速率(μmax)[14]。最小的Tmin通过Ratkowski 等人[15]提出的二级模型的外推回归线与温度轴相交而得到。该模型描述了微生物生长速率与温度之间的关系,具体模型如下:

式中r=μmax=△OD/h ,即微生物指数期的生长速率;Tmin为假设的概念,指的是微生物没有代谢活动时的温度(℃);Tmax是允许微生物生长的最高温度(℃);T为设定温度(℃);b是对于温度低于微生物生长最优温度时的回归参数对于温度高于微生物最优生长温度的附加参数。
Awmin的确定:调节BHI 肉汤培养基的水分活度分别为0.94,0.95,0.96,0.97,0.98 和0.99。然后将各培养基的pH 值用HCl 调节到6.5 后灭菌。待其灭菌后测定其培养基的最终水分活度和pH 值。将上述培养基各取200 μL 无菌操作滴加于灭菌96 孔板里,每组做4 个平行。菌液的接种和培养板的液封同上述操作,最后将96 孔板置于37 ℃恒温箱中培养[16]。每小时取出培养板放入微孔板扫描分光光度计读取菌OD值。最小水分活度根据McMeekin[17]等人提出的二级模型求得,该模型描述了微生物的生长速率与温度,pH 和水分活度之间的关系,其中模型如下:
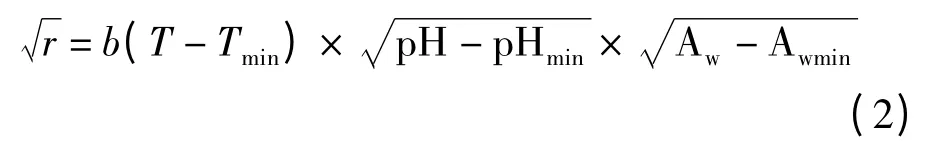
式中,pHmin是理论上允许微生物生长的最低pH;AW是设定的水分活度;Awmin为理论上允许微生物生长的最低水分活度;r、b见式(1)。
pHmin的确定:测定及计算方法同Awmin的确定方法。
1.3.3 实验设计
为了更全面地描述蜡样芽胞杆菌的生长/非生长界面,本实验采用全因子设计方案。因子和水平的选择主要基于前期实验的单因素实验以及一些学者的报道[18-19]。选择温度、水分活度和pH 值3 个因素,温度选择10,15,20,25,30,35 ℃6 个水平,水分活度选择0.992,0.983,0.975,0.965,0.96,0.95,0.942,0.936 8 个水平,pH 值选择5,5.5,6,6.5,7,7.5 6 个水平进行全因子实验。
1.3.4 生长/非生长实验
根据全因子实验的设计,配制相应条件的BHI肉汤培养基,然后将各培养基分装到若干个试管中,灭菌。将菌悬液适当稀释到103CFU/mL 数量级,蜡样芽胞杆菌的初始接种量通过倾注TSA 平板计算菌落总数求得,然后取1 mL 接种到装有9 mL 培养基的试管中,振荡混匀后放入相应温度的恒温培养箱中培养48 h,每组实验作2 个平行。培养结束后观察各试管的混浊度。如果试管中菌液浑浊明显且具有蜡样芽胞杆菌在肉汤培养基中的生长特性,便确定蜡样芽胞杆菌已经生长,并记为1,对于菌液浑浊度不明显或者有质疑的试管,则通过对该试管进行涂布确认,如果有杂菌落出现,则表示该试管有污染,重新测定。反之保留该数据。最后通过比较初始的菌落总数与48 h 后的菌落总数来确定蜡样芽胞杆菌是否生长,如果最终的菌量比初始接种量多于0.5 lg CFU/mL[20],则判定蜡样芽胞杆菌生长,并记为1,否则记为0。
1.3.5 模型的建立和检验
采用logistic 回归模型来拟合实验数据,分析方法通过R 软件的GLM 函数实现。该模型是由Ratowsky[5]等人通过微生物生长动力学模型修正而来,此模型为概率模型,通过似然比卡方统计量来检验模型的拟合效果。该模型描述了微生物的生长概率与不同的培养温度,培养基的pH,水分活度之间的关系,具体模型如下:
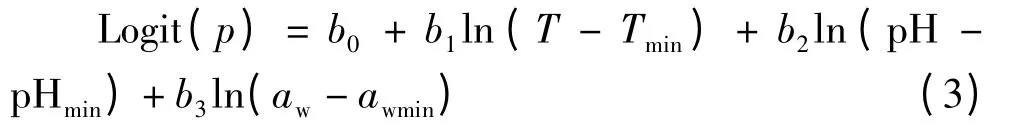
式中logit(p)=ln[p/(1 -p)],p为微生物生长概率,p∈(0,1);bi为模型拟合参数;T为微生物培养温度;Tmin为允许微生物生长的最低温度;pH 为培养基的pH,pHmin为允许微生物生长的最低pH;aw为培养基水分活度;awmin为允许微生物生长的最低生长温度。
为了更好地阐述该回归模型在描述蜡样芽胞杆菌的生长非生长界面的生物学意义,令P=0.1、0.5、0.9 并用Microsoft Excel Solver 来计算这3 种情况下生长非生长界面上的预测T、pH 值和Aw值。并用Matlab 绘制出P=0.1、0.5、0.9 条件下生长非生长的预测界面。
2 结果与分析
2.1 Tmin、Awmin和pHmin的确定
由式(1)、式(2)可以计算出在BHI 肉汤培养基中允许蜡样芽胞杆菌生长的最小温度Tmin=9.99℃,最小水分活度Awmin=0.931 以及最小pH 值pHmin=4.5。该结果与Lanciotti Rosalba[18]等人曾报道的结果不同,可能是不同菌株间的特性差异从而导致对生长环境敏感度的差异。微生物的最低生长温度是一个理论值,它是通过方程外推回归线和温度轴相交得到。据相关报道蜡样芽胞杆菌最适生长温度为30 ~37 ℃,不同来源的蜡样芽胞杆菌的最低生长温度也不完全相同,有些甚至低至4 ~5 ℃,从乳制品中分离出来的蜡样芽胞杆菌一般都能在较低的温度下生长[5,19]。除了培养温度,水分活度的大小和培养基类型也对微生物的生长造成很大影响。微生物的最小水分活度也会因不同菌株和环境因素的不同而略有不同,例如Santos[21]等人曾报道嗜水气单胞菌(Aeromonas hydrophila)的最小水分活度值会因不同的菌株,培养温度和培养基类型的影响从0.940 ~0.973之间变化不等。本实验通过添加甘油来调节养基的水分活度,也有学者通过添加NaCl 和糖来调节[22],但当液体培养基中的NaCl 和糖达到一定量会形成高渗透压,本身对细菌有着一定的抑制,而甘油能够迅速地渗透到微生物细胞中去,因此本身对细菌的抑制作用较弱。所以甘油对实验的干扰性较小,微生物也能在较低的水分活度下生长[23]。
3.2 生长/非生长模型的建立以及数据分析
不同生长温度,水分活度和pH 条件下蜡样芽胞杆菌在BHI 肉汤培养基中的生长/非生长情况的部分结果见表1。从所选的数据可以看出蜡样芽胞杆菌在15 ℃出现生长情况较少,温度越低则出现生长情况越少,水分活度越高则出现的生长情况越多;pH为6.5 时,蜡样芽胞杆菌生长较旺盛,pH 为7.5 时,生长的情况等于非生长情况,而pH 为5.5 时,不生长的情况多于生长情况。因此可以看出偏中酸性的环境更利于该菌株的生长。从所选数据可以得出蜡样芽胞杆菌对温度,pH 和水分活度的交互影响较为明显。当水分活度达到0.965,温度为25 ℃,pH 为5.5 时,蜡样芽胞杆菌不生长,而保持水分活度,温度不变,pH 为6.5 时,蜡样芽胞杆菌则生长;当保持温度,pH 值不变,水分活度为0.975 时,则蜡样芽胞杆菌出现生长。
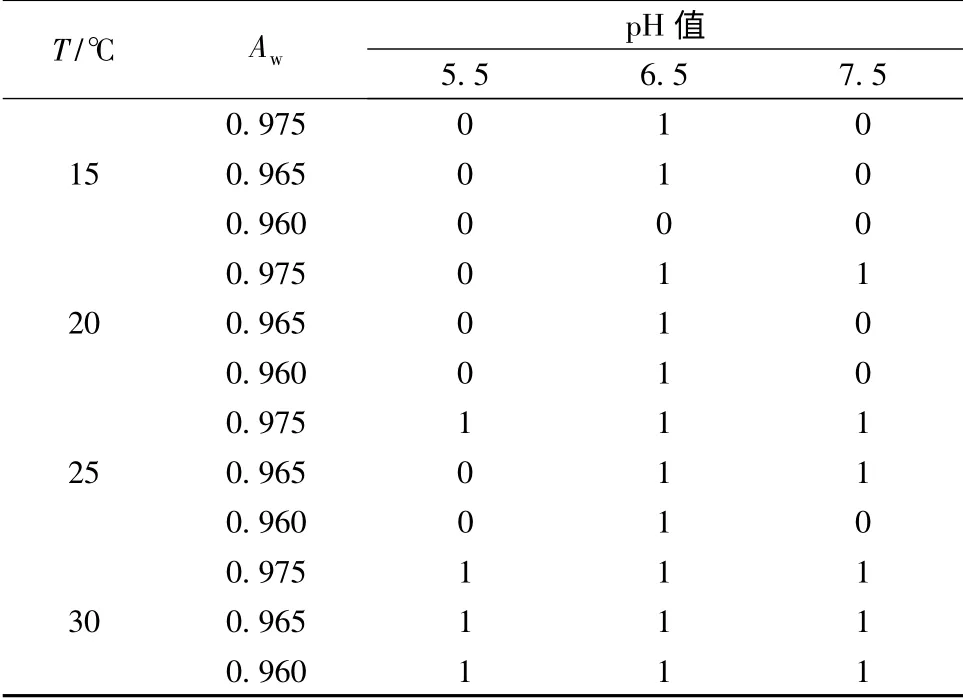
表1 不同Aw、pH 和温度条件下蜡样芽胞杆菌的生长/非生长情况的部分结果Table 1 Some results of the growth/no growth condions for Bacillus cereus in different Aw,pH and temperature
logistic 回归模型拟合结果见表2。z 检验结果显示,模型参数的P值均小于0.000 1,表明各因素拟合结果高度显著,结合卡方检验分析,模型拟合效果达到极显著水平。
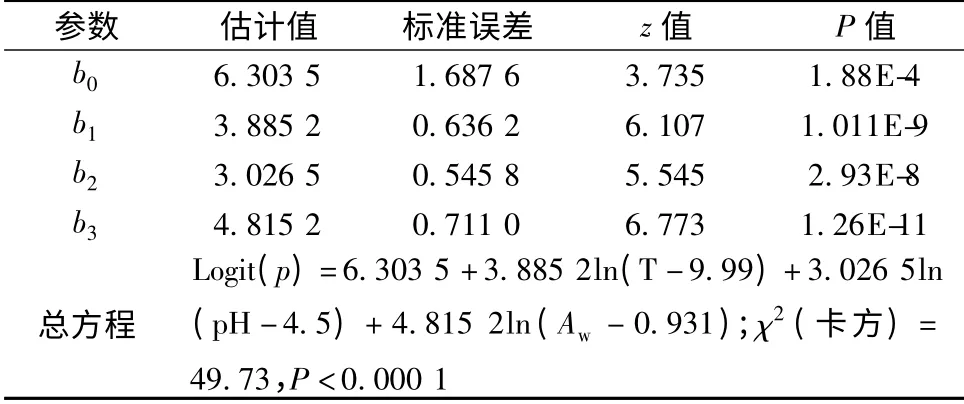
表2 logistic 回归模型拟合结果Table 2 The results equations obtained by fitting the logistic regression model
令拟合方程的P=0.1、0.5、0.9,并用Excel 计算出不同P值(生长概率)条件下pH 预测值,其部分结果见表3。从表3 中可以看出,当温度为30 ℃,水分活度为0.992,生长概率P=0.5 时,可以预测pH≤4.728 时蜡样芽胞杆菌生长概率小于50 %;当P=0.1,即生长概率为10 %时,通过pH 预测值可以得出,只要使得pH≤4.61 时,就能控制微生物生长概率低于10 %。当温度为30 ℃和25 ℃时,培养基的pH 值为7.5,水分活度≥0.96 时,蜡样芽胞杆菌生长概率将会超过90 %。对于培养温度为20 ℃,水分活度≥0.965 时要想控制蜡样芽胞杆菌的生长概率低于50 %,则需要pH≤5.907。从所选的数据可以看出,综合各生长概率来看,在水分活度较高的情况下,温度对蜡样芽胞杆菌的最低生长pH 的影响大于水分活度对最小pH 值的影响,而在水分活度较低的情况下,则情况相反。同样类似的方法也可以求出预测温度和预测水分活度。从表中还可以看出其中一个影响因子接近微生物生长的最小值时,预测值便出现异常,这些预测值虽然有着数学的意义,但在实际试验中失去了微生物意义。虽然这个是该模型运用的缺陷,但是可以通过结合实际的微生物学意义以及人为的数据选择与阐述来完善模型的使用。
图1 描述了P=0.1、0.5、0.9 时不同温度,水分活度和pH 作用下蜡样芽胞杆菌的生长/非生长界面。图中以水分活度做为z 轴,红色曲面代表P=0.9 时的界面,蓝色曲面代表P=0.5 的界面,黄色曲面代表P=0.1 时的界面。黄色曲面以下的空间为蜡样芽胞杆菌生长概率小于0.1 的情况;红色曲面往上的空间为蜡样芽胞杆菌生长概率大于0.9 的情况;中间空间为P∈[0.1,0.9]的转换区域。令P值无限接近0 或者无限接近1,这样可以得到更精确的微生物生长/非生长的转换区域,而转换区域之外的空间即为微生物生长和不生长2 种状态,这对实际生产来说是最有意义。从图中可以看出,3 种影响因子的协同作用对蜡样芽胞杆菌的生长/非生长影响较大。多种限制因子的协同作用会影响蜡样芽胞杆菌的生长速率,但是当其中一种因子在最低生长条件以下时,其余因子对蜡样芽胞杆菌的生长影响很小[24]。
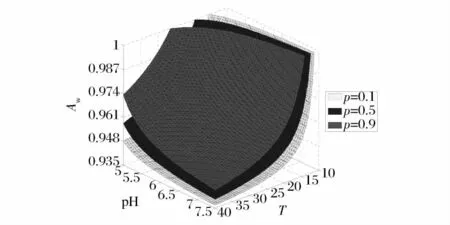
图1 P=0.1、0.5、0.9 时蜡样芽胞杆菌生长/非生长界面三维立体图Figure 1 The three-dimensional representation (3D)of growth/no growth boundaries for Bacillus cereus while P=0.1、0.5、0.9.
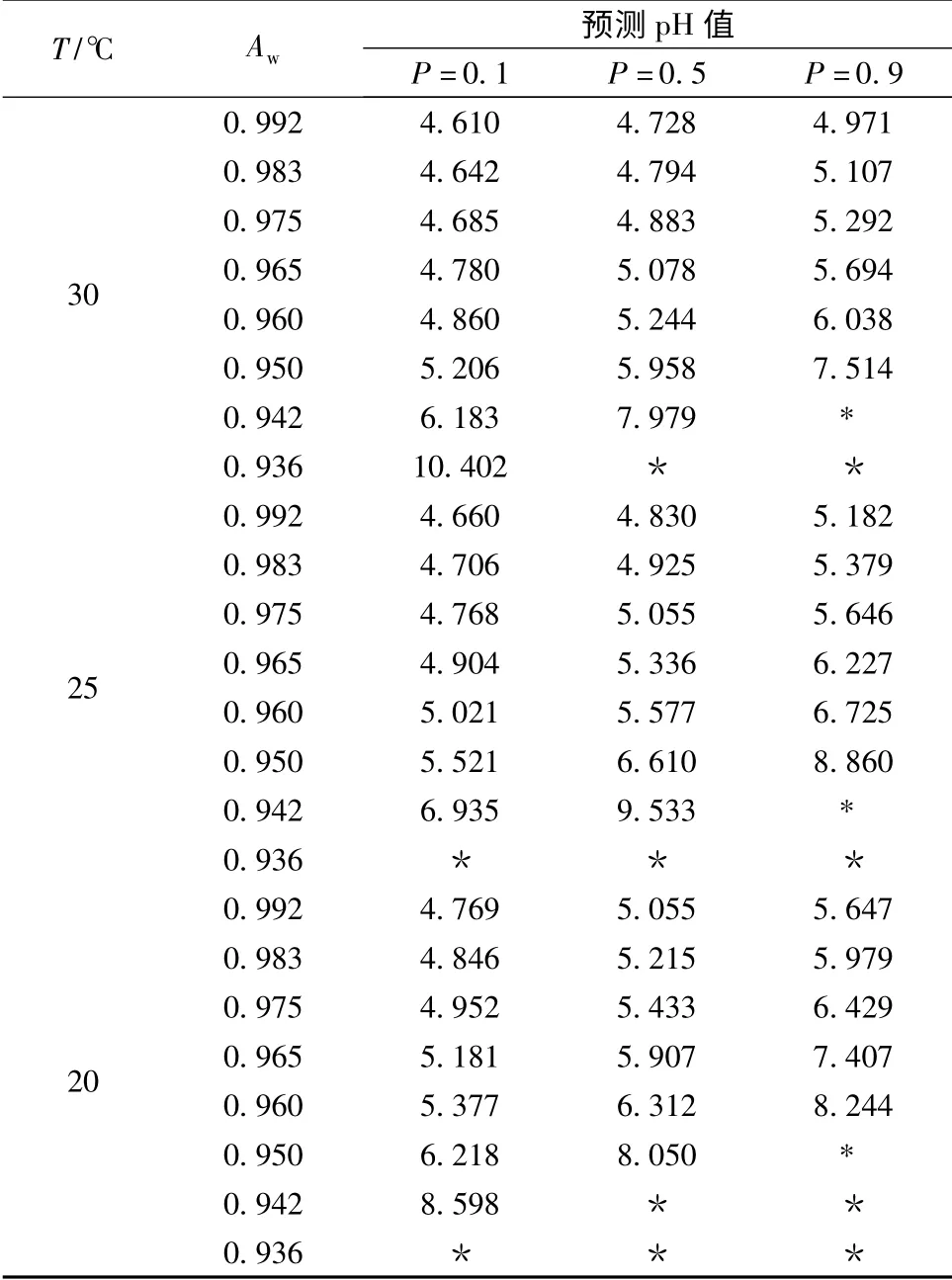
表3 P=0.1、0.5 和0.9 时蜡样芽胞杆菌生长/非生长(48h 后)预测pH 值的部分结果Table 3 Selected predicted values for the pH on the boundary of the growth/no growth interface(after48 h)for Bacillus cereus,corresponding to P=0.1、0.5 and 0.9 of growth
图2 中的4 幅图是AW分别为0.95、0.96、0.97和0.98 下的生长/非生长界面的横截图[26]。图中“○”表示蜡样芽胞杆菌生长概率为0;“△”表示蜡样芽胞杆菌生长概率为0 ~1;“+”表示蜡样芽胞杆菌生长概率为1。实线表示P为0.1 的生长/生长界线,虚线表示P为0.5 的生长/生长界线,点线表示P为0.9 的生长/生长界线。3 条线之间的区域为P∈[0.1,0.9]转换区域。从这4 幅图中可以明显地看出这个转换区域随着水分活度的增加往温度高的方向移动。
当水分活度为0.985 时,出现P=1 的情况较多;而当水分活度为0.950 时,蜡样芽胞杆菌出现P=0的情况较多。因此水分越低,P∈[0.1,0.9]转换区域越宽,过度越平缓。从图2 中还可以看出培养基的pH 值越高,温度越高蜡样芽胞杆菌的生长概率越接近1,反之则越接近0。不同的环境条件对蜡样芽胞杆菌生长概率的影响可以很直接地从横截面中看出。

图2 Aw分别为0.98、0.97、0.96 和0.95 时生长/非生长曲面的横截图Fig.2 The cross section of the growth/no growth interfaces while Aw was 0.98、0.97、0.96 and 0.95
3 讨论
传统意义上,研究学者通过建立微生物生长动力学模型来研究微生物生长速率和环境因素之间的关系。然而对于在低剂量便能导致感染的致病菌来说,研究如何抑制它的生长比研究其生长速率更为有意义。微生物的生长可以通过栅栏技术的应用而得到抑制[27]。栅栏技术通过科学合理的组合不同的栅栏因子,发挥其协同作用,从而抑制微生物生长。通过这种方法不仅使食品安全性得到了保证,同时也保持了大部分食品原有的感官和营养价值。这些抑制因子通常包括环境的温度,pH 值,水分活度,防腐剂等。为了研究哪几种栅栏因子组合的协同作用对抑制微生物的生长最有效,用于描述微生物生长/非生长界面的模型被建立。
目前建立的生长/非生长模型主要分为以下4 大类型:(1)确定性方法(2)最小凸多面体法(MCP)(3)logistic 回归模型法(4)人工神经网络法。前2 种方法认为生长与不生长之间有一个快速转变的界面,后2 种方法则认为微生物生长与不生长之间是一个平缓过度的区域。有学者[27-28]对这些建模方法进行比较,由于范围上受到了限制,比较结果也是前后矛盾。但是微生物生长与不生长之间存在平缓转换区域的可能性已经被证实[29]。本文章中选用了logistic回归模型。它是描述平缓生长/非生长转换区域最常用的方法。它是Ratkowski[5]等人对微生物生长动力学平方根模型修正而来。该模型综合了预测微生物学和栅栏技术、概率模型和动力学模型。模型需要在微生物的最小生长温度、最小水分活度和最小pH 已知的情况下建立,因此本实验对蜡样芽胞杆菌在BHI肉汤培养基中的生长特性做了研究,通过实验结果计算得出:蜡样芽胞杆菌的最低生长温度为9.99 ℃,最小水分活度为0.931,最小pH 为4.5。这也和Lake[19]等人的报道结果类似。但微生物的最低生长温度,最低水分活度,最低pH 会因菌株的来源,培养基的类型,微生物所处的环境不一样而有所不同。
模型是Ratkowski 和Ross 等人通过微生物生长动力学模型修正而得到,将动力学方程的左边替换成logit(P),P表示微生物生长的概率,P也作为一个应变量,其值是通过微生物生长/非生长数据计来获得,当微生物生长则表示为“1”,不生长则表示为“0”。当给定微生物限制因子的条件,便可以通过代入生长/生长模型从而计算出此条件下微生物的生长概率。
该模型的χ2=49.73,P<0.000 1,从拟合效果来看此模型很好地描述了温度,水分活度和pH 值3 个环境因子对蜡样芽胞杆菌的协同作用与其生长概率之间的关系。因此基于该模型,以软烤虾为原料,将蜡样芽孢杆菌接种到实际产品中并进一步建立实际产品在不同栅栏因子条件下的生长/非生长模型来预测有害微生物在不同环境条件下的生长概率情况,以此确定出P∈(0,1)之间的区域,即生长/非生长转换区域,根据该区域的两端无限极限值来优化产品的栅栏因子条件和加工工艺以控制致病菌的生长。目前已有许多有关食品腐败菌和致病菌的生长/非生长模型被建立并被运用到实际生产中去。这也将为建立软烤虾仁产品中蜡样芽胞杆菌的生长/非生长模型提供更进一步的参考。
[1] McMeekin T A,Olley J,Ross T,et al. Predictive microbiology:theory and Application[M]. Tauton:Research Studies Press,1993:11 -83.
[2] 唐佳妮,张爱萍,刘东红. 预测微生物学的研究进展及其在食品中的应用[J]. 中国食品学报,2010,10(6):162 -166.
[3] 郭剑飞,李柏林,欧杰. 基于食品安全性的预测微生物学研究模式[J]. 食品科技,2004(2):5 -8.
[4] McKellar R C ,Lu X. A probability of growth model forEscherichia coliO157:H7 as a function of temperature,pH,acetic acid and salt[J]. Journal of Food Protection,2001,64(12):1 922 -1 928.
[5] 张伟伟,鲁绯,张金兰,等. 食品中蜡样芽胞杆菌的研究进展[J]. 中国酿造,2010(5):1 -4.
[6] Andersson A,Ronner U,Granum P E. What problem does the food industry have with the spore-forming pathogensBacillus cereusandClostridium perfringens[J]. International Journal of Food Microbiology,1995,28(2):145 -155.
[7] 王焕庆,李学英,杨宪时,等. 水分含量对烤虾品质和贮藏性的影响[J]. 现代食品科技,2011,27(8):901 -905.
[8] 韩文瑜,何昭阳,刘玉斌. 病原细菌检验技术[M]. 吉林:吉林科学出版社,1992:395 -396.
[9] 东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:62 -63.
[10] Buchanan R E,Gibbons N E. 伯杰细菌鉴定手册[M].北京:科学出版社,1984:729 -759.
[11] 吕红线,郭利美. 工业微生物菌种的保藏方法[J]. 山东轻工业学院学报,2007,21(1):52 -55.
[12] Valero A,Pérez-Rodríguez F,Carrasco E,et al. Modelling the growth boundaries ofStaphylococcus aureus:Effect of temperature,pH and water activity[J]. International Journal of Food Microbiology,2009,133(1):186-194.
[13] Konstantions p K,Patricia A K,John N S,et al. A comparative study on growth limits ofListeria monocytogenesaffected by temperature,pH and aw when grown in suspension or on a solid surface[J]. International Journal of Food Microbiology,2004,21(4):415 -422.
[14] Zwietering M H,Jongenburger I,Rombouts F M,et al.Modeling of the bacterial growth curve[J]. Applied and Environment Microbiology,1990,56 (6):1 875 -1 881.
[15] Ratkowsky D A,Lowry R K,McMeekin T A,et al. Model for bacterial culture growth rate throughout the entire biokinetic temperature range[J]. Journal of bacteriology,1983,154 (3):1 222 -1 226.
[16] Stewart C M,Cole M B,Legan J D,et al. Staphylococcus aureus growth boundaries:moving towards mechanistic predictive models based on solute-specific effects[J].Applied and Environment Microbiology,2002,68(4):1 864 -1 871.
[17] McMeekin T A,Ross T,Olley J. Application of predictive microbiology to assure the quality and safety of fish and fish products[J]. International Journal of Food Microbiology,1992,15(1/2):13 -32.
[18] Lanciotti R,Sinigaglia M,Gardini F,et al. Growth/no growth interfaces ofBacillus cereus,Staphylococcus aureusandSalmonella enteritidisin model systems based on water activity ,pH ,temperature and ethanol concentration[J]. International Journal of Food Microbiology,2001,18 (6):659 -668.
[19] Lake R,Hudson A,Cressey P. Risk Profile:Bacillusspp. in rice[R]. Institute of Environmental Science and Research Limited,Christchurch,2004.
[20] Skandamis P N,Stopforth J D,Kendall P A,et al. Modeling the effect of inoculum size and acid adaptation on growth / no growth interface ofEscherichia coliO 157∶H7[J]. International Journal of Food Microbiology,2007,120 (3):237 -249.
[21] Santos J,López-Díaz T M,García-López M L,et al.Minimum water activity for the growth ofAeromonas hydrophilaas affected by strain ,temperature and humectant[J]. Letters in applied microbiology,1994,19 (2 ):76 -78.
[22] Coroller L,Kan-King-Yu D,Leguerinel I,et al. Modelling of growth,growth/no -growth interface and nonthermal inactivation areas ofListeriain foods[J]. International Journal of Food microbiology,2012,152 (3):139 -152.
[23] Chorin E,Thuault D,Cléret J J,et al. ModellingBacillus cereusgrowth[J]. International Journal of Food microbiology,1997,38(2/3):229 -234.
[24] Benedict R C,Partridge T,Wells D,et al.Bacillus cere-us:aerobic growth kinetics[J]. Journal of Food Protection,1993,56(2):211 -214.
[25] Gysemans K P M,Bernaerts K,Vermeulen A,et al. Exploring the performance of logistic regression model types on growth/no growth data ofListeria monocytogenes[J].International Journal of Food Microbiology,2007,114(3):316 -331.
[26] Lothar L. Basic aspects of food preservation by hurdle technology[J]. International Journal of Food Microbiology,2000,55(1 -3):181 -186.
[27] Hajmeer M,Basheer I. Comparison of logistic regression and neural network-based classifiers for bacterial growth[J]. Food Microbiology,2003b,20(1):43 -55.
[28] Le Marc Y,Pin C,Baranyi J. Methods to determine the growth domain in a multidimensional environmental space[J]. International Journal of Food Microbiology,2005,100(1 -3):3 -12.
[29] Vermeulen A,Gysemans K P M,Bernaerts K,et al. Influence of pH,water activity and acetic acid concentration onListeria monocytogenesat 7 ℃:data collection for the development of a growth/no growth model[J]. International Journal of Food Microbiology,2007,114(3):332-341.

