球形节杆菌C224 分批发酵2-酮基-D-葡萄糖酸的条件优化及其动力学模型的构建*
孙文敬,高培玲,魏转,崔凤杰,,周延政,滕文华,刘敬泽
1(江苏大学 食品与生物工程学院,江苏 镇江,212013)
2(河北师范大学 生命科学学院,河北 石家庄,050016)
3(百勤异VC 钠有限公司,江西 上饶,334221)
4(河北化工医药职业技术学院 制药工程系,河北 石家庄,050026)
2-酮 基-D-葡 萄 糖 酸(2-keto-D-gluconic acid,2KGA)可以作为除莠化合物的生产原料,也可作为糠醛、D-阿拉伯糖、D-核糖、D-异抗坏血酸及其盐类的合成前体,还是饲料添加剂、水泥增塑剂、洗涤剂的促净剂和照片显影剂的重要组分[1],但其最主要的用途则是在食品抗氧化剂D-异抗坏血酸及其盐类的合成方面[2-3]。我国是目前国际上最大的D-异抗坏血酸(盐)生产国,年产量接近40 000 t,占有该产品80%以上的国际市场份额。
相对于化学催化合成[4]、酶促合成[5-7]等其它生产方法,发酵法是目前最经济、最高效的2KGA 生产方法[1],因而在工业生产中得到了普遍采用。国内外2KGA 工业生产通常采用补料分批发酵模式,其发酵液中的产物浓度大、转化率高,但生产强度较低,一般不会超过6.0 g/(L·h),限制了设备利用率的提高与能源消耗的减少[2]。因此,对2KGA 发酵条件及发酵生产模式进行优化是十分必要的。
有关2KGA 发酵条件的研究已有较多报道[8-10],但几乎未涉及国内主要工业用菌之一的球形节杆菌(Arthrobacter globiformis),尤其是在通气量与葡萄糖浓度对2KGA 发酵的影响方面。另外,发酵动力学的研究对发酵工艺的优化和发酵生产模式的选择具有具有重要的指导意义,但目前尚未见到有关球形节杆菌发酵生产2KGA 动力学研究的报道。
在初步考察葡萄糖浓度与溶解氧对2KGA 发酵影响的基础上,本研究试图构建能够揭示球形节杆菌2KGA 分批发酵代谢基本特征的动力学模型,为发酵工艺和发酵生产模式的优化提供理论依据。
1 材料和方法
1.1 菌株
球形节杆菌C224,是以K1022 菌株为亲株经紫外诱变选育的2-酮基-D-葡萄糖酸高产菌株[11],对噬菌体KS211、KS212、KS213 和KSL -1[12]具有稳定的抗性。
1.2 培养基
斜面培养基(g/L):牛肉膏5.0,蛋白胨10.0,NaCl 5.0,琼脂20.0,pH 7.0。
菌种扩大培养基(g/L):葡萄糖20.0,玉米浆10.0,尿素2.0,KH2PO42.0,MgSO4·7H2O 0.5,pH 7.0。
发酵培养基(g/L):大米淀粉水解糖(以无水葡萄糖计)162.0,玉米浆15.0,pH 6.7。大米淀粉水解糖由江西省德兴市百勤异VC 钠有限公司提供,其葡萄糖质量浓度约为265.0 g/L,蛋白质2.06 g/L(总氮 × 6.38)。
1.3 发酵装置
镇江格瑞生物工程有限公司制造的GRJ-50D 全自动机械搅拌发酵系统,包括1 台5L 的菌种扩大培养设备和1 台50L 的自控不锈钢发酵罐,该发酵系统具有自动控温、无级调速、测定培养液溶解氧浓度和pH 值等功能。
1.4 培养条件
1.4.1 斜面菌种培养[2]
将活化的保藏菌种接种至斜面培养基上,30 ℃培养24 h。
1.4.2 摇瓶种子培养[2]
将斜面菌种的菌悬液接入装有50 mL 种子培养基的500 mL 锥形瓶中,30℃、260 r/min 旋转式摇床振荡培养20 h。
1.4.3 种子扩大培养
按2.0%(体积分数)的接种量将摇瓶种子接入3.5 L 的菌种扩大培养基中,在罐温30℃、罐压0.03 MPa、通气量105.0 L/h 和转速400 r/min 的条件下培养。当培养液中的菌体细胞浓度达到6.15 g/L 左右时,接入发酵培养基中。
1.4.4 发酵
按10.0%(体积分数)的接种量将液体种子接入35.0 L 的发酵培养基中,在罐温32 ±2 ℃、罐压0.03 MPa、通气量52.5 L/min(发酵过程中最低溶解氧浓度不低于4.0%)、转速450 r/min 的条件下进行分批发酵。发酵过程中,当发酵液的pH 值低于5.4 时,采用200.0 g/L 的Na2CO3溶液作为中和剂,维持发酵液的pH 值在5.6 ±0.2。
1.5 测定方法
1.5.1 种子培养液和发酵液中菌体细胞浓度的测定
采用比浊法测定[2]。25℃的条件下,用新制蒸馏水稀释种子培养液或发酵液20 倍,以水作空白,用分光光度计测定其在650 nm 处的吸光度,并根据细胞干质量与吸光度的线性关系求得菌体细胞浓度(每升发酵液中的细胞干质量)。本实验条件下,OD650nm=1 时细胞浓度为0.44 g/L。
1.5.2 发酵液中2KGA 的测定
采用高效液相色谱法测定[1]。
高效液相色谱仪的型号:1260 Infinity(美国Agilent 公司)。
色谱条件:色谱柱为Hypersil SAX 强阴离子交换色谱柱(150 mm×4.6 mm,5 μm);流动相为pH 3.0的0.1 mol/L KH2PO4溶液;流速为1.0 mL/min;检测器为紫外检测器;检测波长为216 nm;柱温30℃;进样量为50 μL。
1.5.3 葡萄糖的测定
采用SBA-40 型生物传感分析仪测定[2]。
2 结果与分析
2.1 通气量对球形节杆菌C224 菌株2KGA 发酵的影响
工业生产条件下,通气量与搅拌速率是影响发酵体系中溶解氧浓度的最主要的因素。根据生产经验,无论是采用气升式还是机械搅拌式发酵罐,国内2KGA 工业发酵过程中的最大通气量为1.0 v·v-1·m-1,其糖酸转化率可以达到0.94 g/g(为理论产率的87.0%)以上,接近于实验室发酵水平,一般认为该通气条件是合适的,忽视了通气量对发酵生产强度的影响。2KGA 发酵是一个典型的生物氧化过程,维持细胞的生长代谢需要大量的氧气,因此实验设计通过增加通气量来提高2KGA 的生产强度。研究结果(表1)表明,随着通气量的提高,细胞浓度明显增加,发酵周期显著缩短,生产强度大大增强,2KGA 的产量和糖酸转化率有所增加。当通气量超过1.5 v·v-1·m-1时,发酵过程中的最小溶解氧浓度明显加大,但各项实验指标无显著变化。因此,可以认为本实验条件下发酵的通气量以不低于1.5 v·v-1·m-1为宜。
在通气量为1.5 v·v-1·m-1的条件下,发酵过程中溶解氧的变化如图1 所示。从图中可以看出,发酵的前3 h,发酵液中的溶解氧浓度迅速降低;至4 h时,溶解氧浓度达到最低,只有4.0%左右;4 ~20 h之间,溶解氧浓度缓慢增加,至20 h 时达到20.0%左右;20 h 后,溶解氧浓度迅速回升,发酵接近终点(24 h)时溶解氧浓度达到73.0%以上。
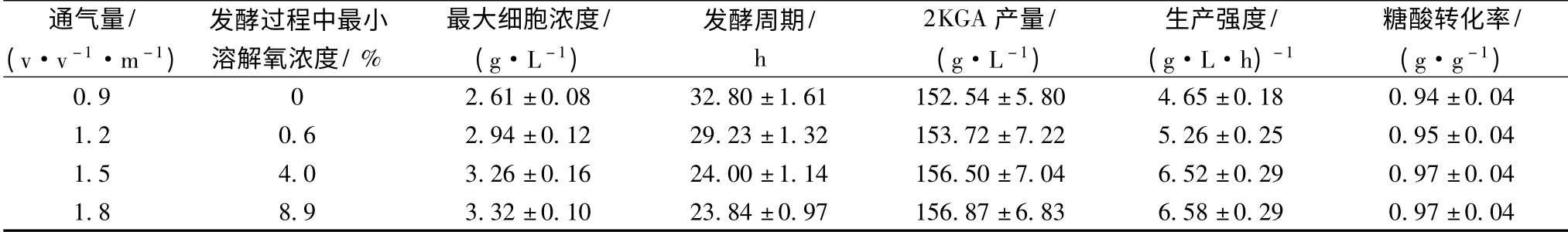
表1 通气量对球形节杆菌C224 菌株2KGA 发酵的影响Table 1 Effect of aeration rate on the 2KGA fermentation performance by Ar. globiformis C224

图1 球形节杆菌C224 菌株2KGA 发酵过程中溶解氧浓度的变化Fig.1 Profile of dissolved oxygen during 2KGA production by Ar. globiformis C224
2.2 葡萄糖浓度对球形节杆菌C224 菌株2KGA 发酵的影响
在2KGA 发酵过程中,碳氮比偏大或偏小均不利于菌体产酸[8]。因此,本实验保持大米淀粉水解糖与玉米浆的比例不变,通过改变发酵培养基中的葡萄糖浓度,考察其对球形节杆菌C224 菌株2KGA 发酵的影响。研究结果(表2)表明,葡萄糖浓度低于150.0 g/L 时,随着葡萄糖浓度的提高,发酵液中的最大细胞浓度、生产强度、2KGA 产量和糖酸转化率逐步增大,发酵周期逐步延长;葡萄糖浓度在120.0~180.0 g/L 时,发酵生产强度和糖酸转化率基本稳定,分别保持在6.36 g/(L·h)和0.96 g/g(约为理论产率的88.75%)以上;葡萄糖浓度达到210.0 g/L时,发酵生产强度和糖酸转化率分别只有5.41 g/(L·h)和0.87 g/g。因此,球形节杆菌C224 菌株2KGA 发酵培养基的葡萄糖浓度以120.0 ~180.0 g/L 为宜。
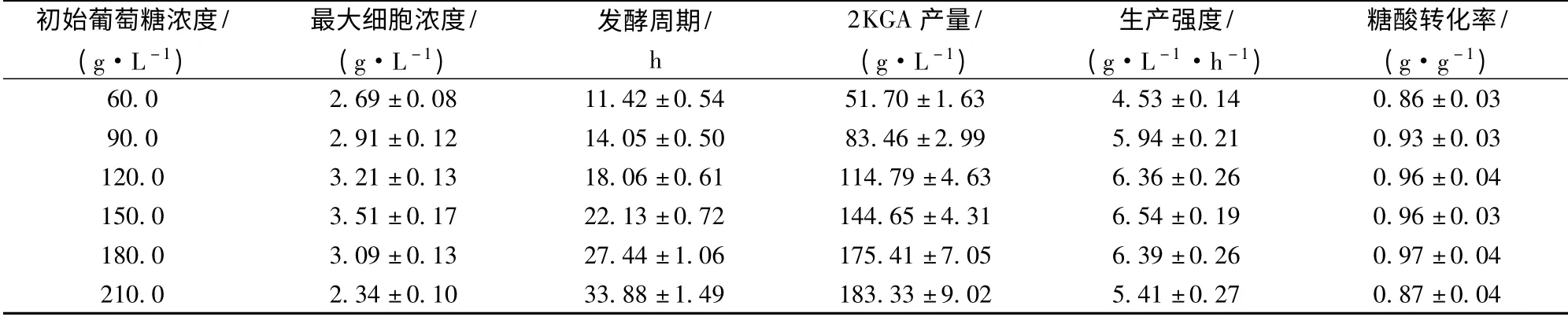
表2 葡萄糖浓度对球形节杆菌C224 菌株2KGA 发酵的影响Table 2 Effect of initial glucose concentration on the 2KGA fermentation performance by Ar. globiformis C224
2.3 球形节杆菌C224 菌株的2KGA 发酵过程
在初始葡萄糖浓度为162.0 g/L、通气量为1.5 v·v-1·m-1的条件下进行发酵。定时取样测定发酵液中的细胞浓度、葡萄糖浓度和发酵产物2KGA 的浓度,并计算细胞生产强度、葡萄糖消耗速率和发酵生产强度,绘制球形节杆菌C224 菌株的2KGA 发酵过程曲线(图2)。
从图2 可以看出,球形节杆菌C224 菌体细胞的生长几乎没有延滞期,很快进入对数生长期(0 ~2 h的细胞生产强度约为0.22 g/(L·h),4 h 时细胞浓度就已达到2.51 g/L 左右,发酵2 ~4 h 的细胞生产强度最高[约为0.64 g/(L·h)];4 ~16 h,细胞浓度的增幅急剧减缓,其生产强度只有0.06 g/(L·h)左右;16 h 后,细胞生长进入稳定期并持续至发酵达到终点。从图2 还可看出,葡萄糖消耗与2KGA 积累的变化趋势一致。在细胞生长的对数期内,尽管葡萄糖的消耗速率和2KGA 生产强度相对较低,但仍然分别达到4.00 g/(L·h)和2.71 g/(L·h)(发酵2 h);8~16 h 是2KGA 的高速合成期,葡萄糖的消耗速率达到7.10 g/(L·h)左右,2KGA 的生产强度达到7.50 g/(L·h)左右,几乎所有被消耗的葡萄糖按理论产率转化为2KGA;16 h 后,葡萄糖消耗速率与2KGA生产强度明显降低。
根据上述研究结果,可以将球形节杆菌C224 的2KGA 发酵过程分为2 个阶段:第1 阶段,菌体处于对数生长期,同时将所消耗的葡萄糖部分转化为2KGA;第2 阶段,菌体生长处于稳定期,2KGA 持续高速合成至葡萄糖消耗殆尽,所消耗的葡萄糖几乎被完全转化为2KGA,由此可以初步推定球形节杆菌C224 生产2KGA 的发酵过程为部分生长联系型。
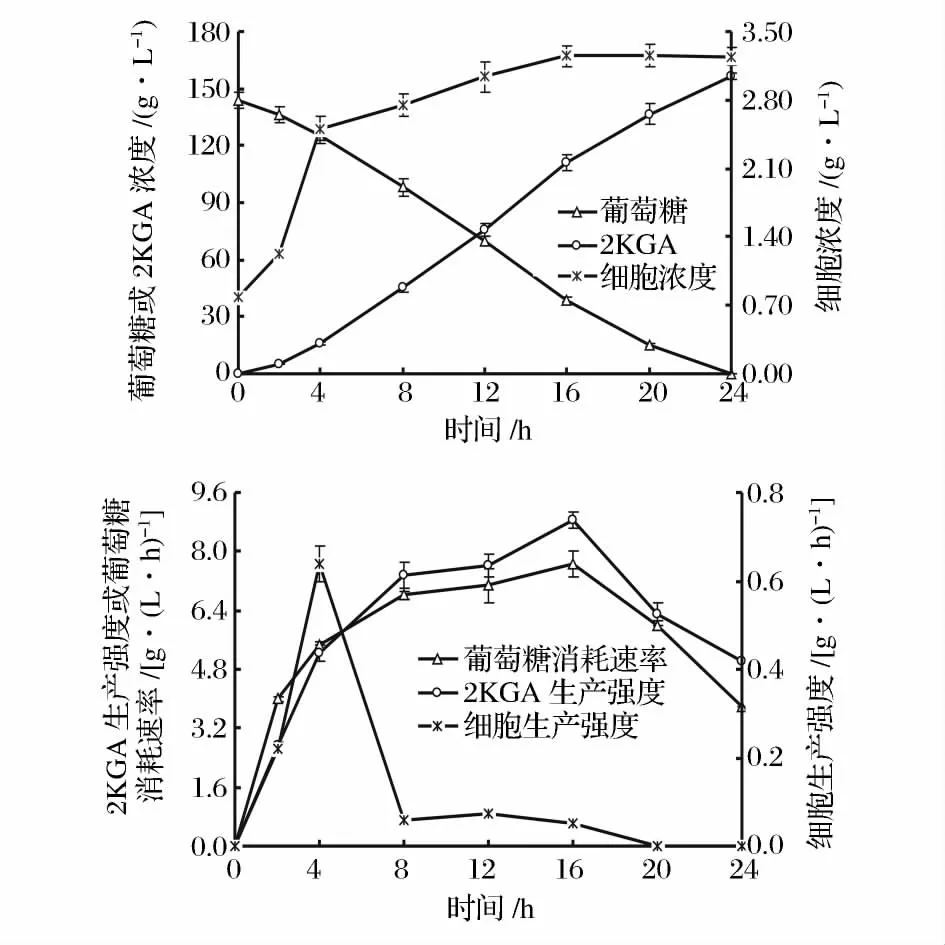
图2 球形节杆菌C224 菌株分批发酵生产2KGA 的过程Fig. 2 Time course of 2KGA batch fermentation by Ar. globiformis C224
2.4 球形节杆菌C224 菌株分批发酵生产2KGA 动力学模型的构建
2.4.1 菌体生长动力学模型
能够描述菌体生长动力学的模型很多,但以Monod 和Logistic 方程最为常用[13]。从图2 可以发现,4 h 时菌体细胞浓度就已达到发酵过程中最高细胞浓度的75%以上,随后细胞生长趋缓,在发酵后期细胞浓度达到最大值。因此,以Logistic 方程[14]来描述球形节杆菌C224 的生长规律较为合适,即:

当t=0 时,X=X0,对式(1)进行积分可得代数方程(2):
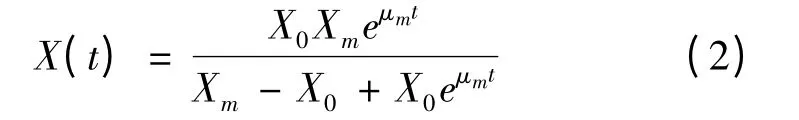
将图2 的实验数据应用于上述模型,利用Origin 8.0 对菌体生长动力学模型参数进行求解,结果为:X0=0.70 g/L;Xm=3.16 g/L;μm=0.54 h-1。对菌体生长的实验数据与模型计算值进行比较,其平均相对偏差计算为5.27 %(图3)。
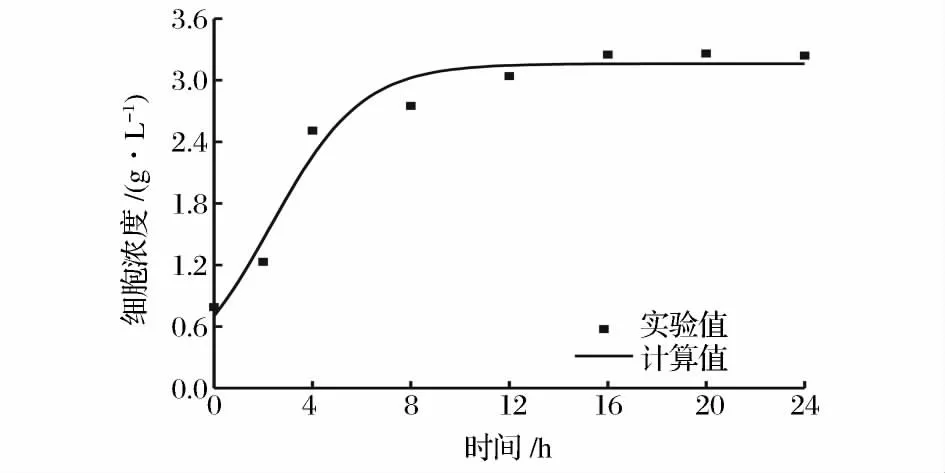
图3 菌体生长实验值和模型计算值的比较Fig.3 Comparison between experimental data and predictive values of cell growth model
从非线性拟合出的生长曲线中可以看出,菌体生长几乎没有延滞期,细胞浓度的增幅随发酵时间的推移逐渐减缓,且在发酵的中后期细胞浓度达到最大值。另外,从图3 中还可以看出,模型计算值和实验值拟合效果良好,模型的相关系数R2=0.951 4,说明所选择的模型能够较好地反映球形节杆菌C224 的生长规律。
2.4.2 产物形成动力学模型
根据发酵过程中产物形成与底物利用之间的关系,发酵产物形成的过程可被分为3 类:生长联系型(简单发酵型)、部分生长联系型(中间发酵型)和非生长联系型(复杂发酵型)[15]。
利用经典的Luedeking-Piret 方程[16]描述产物形成与细胞生长之间的关系,其数学表达式为:
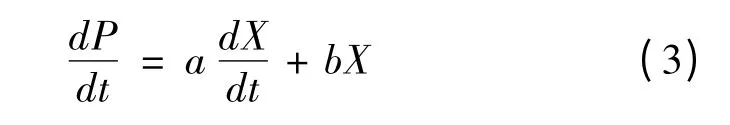
当a≠0,b=0 时,产物形成为生长联系型;当a=0,b≠0 时,产物形成为非生长联系型;当a≠0,b≠0 时,产物形成为部分生长联系型;
将式(1)代入式(3),得:
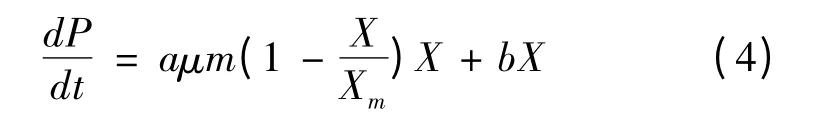
积分后得:

其中

将μm、X0、Xm和图2 的实验数据应用于上述模型,利用Origin 8.0 对产物合成动力学模型参数进行求解,结果为:a=3.62;b=2.29。计算结果表明,球形节杆菌C224 菌株2KGA 的合成属于部分生长联系型。对2KGA 合成的实验数据与模型计算值进行比较,其平均相对偏差计算为5.73%(图4)。
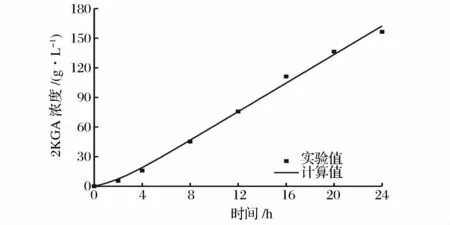
图4 2KGA 产量实验值和模型计算值的比较Fig.4 Comparison between experimental data and predictive values of 2KGA production model
从图4 中可以看出,实验数据与模型计算值模型的拟合效果很好,模型的相关系数R2=0.995 4,说明所选择的模型能够比较准确地反映球形节杆菌C224菌株2KGA 的合成规律。
2.4.3 底物消耗动力学模型
常见的底物消耗动力学模型是基于底物消耗的物料衡算而建立的方程式。在发酵过程中,底物一部分消耗用于菌体的生长和维持细胞生命活动,一部分用于形成产物[13]。因此,底物消耗速率可表示如下:
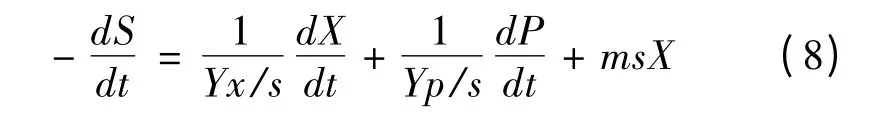
将式(1)和式(3)带入,积分得
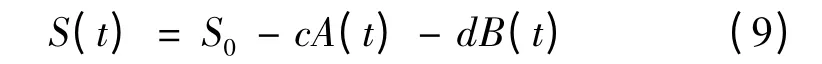
将μm、X0、Xm和图2 的实验数据应用于上述模型,利用Origin 8.0 对底物消耗动力学模型参数进行求解,结果为:c=6.34;d=2.01;Yx/s=0.340 5 g/g;Yp/s=1.062 6 g/g。对葡萄糖消耗的实验数据与模型计算值进行比较,其平均相对偏差计算为4.34%,结果如图5 所示。从图中可以看出,实验数据和模型计算值拟合效果很好,模型的相关系数R2=0.994 7,说明所选择的模型能够比较准确地反映了葡萄糖的消耗规律。
3 结论

图5 残糖实验值和模型计算值的比较Fig.5 Comparison between experimental data and predictive values of glucose consumption model
通气量和葡萄糖浓度对球形节杆菌C224 菌株2KGA 发酵均有明显影响,通气量以不低于1.5 v·v-1·m-1为宜,葡萄糖浓度以120.0 ~180.0 g/L 为宜。在适宜的发酵条件下,球形节杆菌C224 菌株分批发酵生产2-酮基-D-葡萄糖酸的生产强度可达6.36 g/(L·h)以上,糖酸转化率不低于0.96 g/g(约为理论产率的88.75%)。
构建的发酵动力学模型能够比较准确地反映球形节杆菌C224 菌体生长、2KGA 合成与葡萄糖消耗的规律,有助于进一步了解该发酵菌种的生理特性和特征、菌种生长和目的产物积累的适宜条件以及各种发酵参数之间的关系,对发酵工艺优化、过程控制及设备放大具有具有重要的指导意义。
符号说明
X—菌体浓度( g/L) ;t—发酵时间( h) ;X0—起始菌体浓度( g/L) ;Xm—最大菌体浓度( g/L) ; μm—最大比生长速率( h-1) ;S—葡萄糖浓度( g/L) ;S0—起始葡萄糖浓度( g/L) ;a,
b—与菌体生长量相关联的产物合成常数;ms—细胞维持系数[g/( g·s) ];P—2KGA 浓度( g/L) ;Yx/s—菌体对葡萄糖的得率系数( g/g) ;Yp/s—2KGA 对葡萄糖的得率系数( g/g) 。
[1] Chia M,Nguyen T B V,Choi W J. DO-stat fed-batch production of 2-keto-D-gluconic acid from cassava using immobilized Pseudomonas aeruginosa[J]. Appl Microbiol Biotechnol,2008,78(5):759 -765.
[2] Sun Wen-jing,Zhou Yan-zheng,Zhou Qiang,et al. Semicontinuous production of 2-keto-gluconic acid byPseudomonas fluorescensAR4 from rice starch hydrolysate [J].Bioresource Technology,2012,110:546 -551.
[3] 周强,魏转,孙文敬,等.D-异抗坏血酸生产技术研究进展[J]. 食品科学,2008,29(8):647 -651.
[4] Elseviers M,Coomans S M J,Lemmens H O J,et al.Process for the production of 2-keto-D-gluconic acid:US,6018034[P]. 2000 -1 -25.
[5] Boston M G,Swanson B A. Method for producing ascorbic acid intermediates:US,6599722[P]. 2003 -7 -29.
[6] Neeidleman S L,Amon JR W F,Geigert J. Production of 2-ketogluconic acid and hydrogen peroxide:US,4351902[P]. 1982 -9 -28.
[7] Tanimura R,Hamada A,Ikehara K,et al. Enzymatic synthesis of 2-keto-D-gluconate and 2-keto-D-galactonate from D-glucose and galactose with cell culture ofPseudomonas fluorescensand 2-keto-galactonate fromD-galactono 1,4-lactone with partially purified 2-ketogalactonate reductase[J]. J Mol Catal B:Enzymatic,2003,23:291 -298.
[8] 孙文敬,杨庆文,黄惠英,等. 荧光假单胞菌AR4 产2-酮基-D-葡萄糖酸发酵条件的研究[J]. 食品科学,2004,25(10):46 -49.
[9] 张炜,谢志鹏,罗玮,等. 沙雷氏菌Serratiasp. BK-98发酵生产2-酮基-D-葡萄糖酸的工艺优化及动力学研究[J]. 化工学报,2011,62(5):1 371 -1 376.
[10] Svitel J,Sturdik E. 2-Ketogluconic acid production byAcetobacter pasteurianus[J]. Applied Biochemistry and Biotechnology,1995,53:53 -63.
[11] 孙文敬,赵峰梅,郭金权,等. 2-酮基-D-葡萄糖酸产生菌球状节杆菌K1022 抗噬菌体菌株的选育[J]. 食品与发酵工业,2002,28(6):36 -39.
[12] Sun Wen-jing,Liu Chang-feng,Yu Lin,et al. A novel bacteriophage KSL-1 of 2-keto-gluconic acid producerPseudomonas fluorescensK1005:isolation,characterization and its remedial action [J]. BMC Microbiology,2012,12:127.
[13] Sun Wen-jing,Yu Lin,Yu Si-lian,et al. Kinetic modeling of 2-keto-gluconic acid production from rice starch hydrolysate usingPseudomonas fluorescensAR4[J]. Advanced Materials Research,2012,550 -553:1144 -1150.
[14] 戚以政,王淑雄. 生化反应动力学和反应器[M]. 第三版. 北京:化学工业出版社,2007:40.
[15] 肖冬光. 微生物工程原理[M]. 北京:中国轻工业出版社,2004:151 -153.
[16] Luedeking R,Priet E L. A kinetic study of the lactic acid fermentation:Batch process at controlled pH[J]. J Biochem Microbiol Technol Eng,1959,1(4):393 -412.

