乳鼠原代心肌细胞提取方法的改良
·论 著·
乳鼠原代心肌细胞提取方法的改良
刘 威1,张光明2,袁 瑞1,万晓明1,金 宏1*(1.吉林医药学院临床技能实验室,吉林 吉林 132013;2.北华大学附属医院泌尿外科,吉林 吉林 132001)
目的改进传统的SD大鼠乳鼠心肌细胞培养方法,探索更简便、高效的心肌细胞培养方法。方法用两种不同方法提取心肌细胞,比较两种不同提取方法对细胞存活率、搏动能力的影响。结果与传统法相比用改良法提取的心肌细胞存活率较高,起搏较早,差异有统计学意义(P﹤0.01)。结论用改良法提取心肌细胞,可获得存活率高、纯度高心肌细胞。且操作简便,重复性好,是一种较为理想的提取原代心肌细胞的方法,可建立满意的体外培养心肌细胞模型。
乳鼠;心肌细胞;原代培养
1960年Harry首次成功提取出心肌细胞[1]。体外培养的心肌细胞模型能保持心肌特点并排除神经和体液因素的影响,使细胞处于均一的环境[2],易于控制环境条件,具有简便、准确、易于重复等优点,在实验研究中广泛被应用。因心肌细胞对酶消化极为敏感,对消化力度的把握尤显重要。消化过度可使心肌细胞损伤;消化不充分,细胞聚集成团,贴壁后伸展不良,层叠生长,中心区密度过大致死亡,因此消化分离心肌细胞的方法对实验的成功至关重要。本实验对传统提取方法加以改良,提高细胞收获率、细胞活力,为建立满意的体外培养心肌细胞模型提供依据。
1 材料与方法
1.1实验动物
新生72 h内的SD大鼠乳鼠若干只,雌雄不限,由吉林大学实验动物中心提供。
1.2主要仪器及试剂
DMEM培养基(Sigma公司),磷酸盐缓冲溶液(Sigma公司),新生牛血清(杭州四季青公司),胰蛋白酶(Sigma公司),CO2培养箱(美国shell公司),超净工作台(苏州净化设备厂),Motic摄像倒置显微镜,高速离心机(北京京力离心机公司),恒温磁力搅拌器(江苏金坛康华电子仪器厂)。
1.3心肌细胞的分离及培养
取新生72 h内的SD大鼠8只,碘伏浸泡消毒后酒精擦洗2~3遍消毒,剪出心脏,立即放入盛有预冷含双抗的PBS溶液中,剪开心脏冲洗3次,修剪完毕后在大离心管内剪碎,将组织碎块平均分为两部分,置于两个大离心管中待消化。
1.3.1传统法
在上述一支装有组织块的大离心管内加入0.25%的胰蛋白酶5 mL左右,并加入一枚转子,置于恒温磁力搅拌器上37 ℃水浴中,调整转子转速为100 r/min,使组织块与酶液充分接触,消化7 min,沉淀后将上清液吸出,从第2次消化开始收集,加入含血清的培养液终止消化。重复上述步骤直至组织块消化完毕。
1.3.1改良法
对另一只大离心管中的组织块进行消化。首次同上法,弃上清。从第2次消化开始注意根据组织块的颜色,分散程度等情况,判断组织块被消化的程度,通过实时调整0.25%胰蛋白酶和PBS的比例调整消化力度,最大限度的保证细胞的完整性和分散性。在消化的前2~4次时,组织块色较红,分散度好,可将0.25%胰蛋白酶与PBS按2∶1,或3∶2比例加入,消化5~6 min,转子速度120 r/min。消化的第4~6次可调整0.25%胰蛋白酶与PBS比例为2∶3或1∶2,同时延长消化时间,降低转速,减少对细胞的机械和化学损伤。消化后期,可将0.25%胰蛋白酶与PBS比例调整为1∶2或1∶3,进一步将低转速,保护细胞的完整。每次消化结束后收集消化液,及时加入小牛血清以终止消化。
对两种方法收集到的消化液,分别以200目的滤网过滤,1 000 r/min离心10 min,去上清,重悬后接种于培养瓶内,培养箱中孵育90~120 min后吸出细胞悬液,离心,将沉淀重悬按105~106个/mL的密度接种于培养瓶内,置于37 ℃、5%CO2培养箱中培养。
1.4观察项目及检测指标
1.4.1光镜检查
镜下观察两种方法提取的心肌细胞的生长情况,如细胞形状、是否贴壁、伸展程度、何时起搏、计数心肌细胞每分钟搏动的次数、及起搏细胞的数量。心肌细胞的可搏动性是其区别于其他细胞的重要标志,是否搏动可直接反映心肌细胞的生长状态。对两种方法消化下来的心肌细胞培养48 h后,镜下任选5个视野计数有搏动的心肌细胞数量和,重复实验6次,来比较不同消化方法对细胞起搏能力的影响。
1.4.2细胞存活率的计算
用台盼蓝染液对不同消化方法获得的细胞进行染色,镜下观察,计数4大格内的细胞总数及活细胞数,计算细胞存活率。
1.5统计学分析
2 结 果
2.1心肌细胞的形态学观察
由于机械力和胰蛋白酶的共同作用,心肌细胞刚分离出来呈球形,悬浮与培养液中。传统法瓶内有少量细胞碎片和部分有少量细胞形成的细胞团;改良法瓶内罕有细胞碎片,细胞完整性好,分散度好(图1)。8~12 h后细胞开始贴壁生长,并逐渐伸出伪足伸展呈梭形、三角形、不规则形(图2)。改良法瓶内18~24 h后细胞绝大多数贴壁,且部分细胞出现自发性搏动,节律不规则,为30~70次/min。其中单个细胞贴壁较好,传统法瓶内细胞团贴壁生长较慢,伸展差(图3)。48~72 h细胞伸出伪足相互连接形成细胞层,产生同步性较好的搏动,频率为90~130次/min(图4)。培养48 h后有搏动的心肌细胞数量传统法为55.5±3.18个,改良法为76.5±2.07个,两者有显著性差异(P<0.01)。这与改良法在消化过程中对心肌细胞的刺激较小,有利于细胞恢复搏动有关。
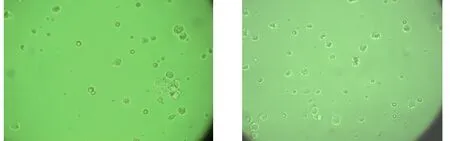
A:传统法 B:改良法图 1 刚提取出来的心肌细胞(×40)
2.2不同消化方法对心肌细胞存活率的影响
细胞存活率计数结果为:传统法83.47±2.05个,改良法95.79±1.44个 。对两种方法消化的大鼠心肌细胞存活率进行配对t检验,结果表明有显著性差异(P<0.01),说明用改良法消化心肌细胞,对心肌细胞破坏较轻,存活率较高。

图 2 改良法培养8~12 h后的心肌细胞(×40)
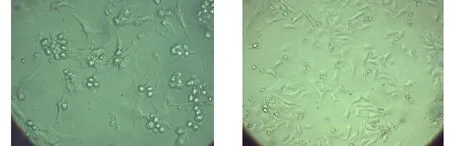
A:传统法 B:改良法图 3 培养18~24 h的心肌细胞(×40)

A:传统法 B:改良法图 4 培养48~72 h的心肌细胞(×40)
3 讨 论
传统的乳鼠心肌细胞提取方法[3]近年来在实际应用中发现有一些不足,如分离心肌细胞时收获率不够理想。因此一些改进方法应运而生,主要是采用几种消化酶合用,如Boerma法等[4-5]。但不同消化酶的作用时间和消化强度不同,不易确定共同消化时间,先消化下来的心肌细胞就会始终浸泡在消化液中,长时间在消化液的作用下,这些心肌细胞就有可能活力下降或死亡。因此两者一起对细胞进行消化时易造成消化不彻底或消化过度,导致大量细胞团形成或细胞破裂,细胞丧失贴壁能力和/或收缩现象,直接影响细胞生长状态。也有文献报道[6-8]利用不同类型的胶原蛋白酶(Ⅰ、Ⅱ、Ⅲ、Ⅳ型)以不同浓度与胰蛋白酶混合消化心肌细胞,但过程较复杂,成本昂贵。另有报道用单一的胰蛋白酶进行消化,每次消化的浓度和时间固定,但消化不够理想,细胞收获率不稳定[9-11]。本研究对传统的胰蛋白酶浓度和时间不变的消化法进行了改进,根据组织块的具体消化程度,及时调整消化力度,包括胰蛋白酶的浓度、消化时间、转子的转速等条件,最大限度的保证细胞的完整度和分散度,且操作简便,成本较低。
同时本研究通过反复实验得出一些经验,可提高培养的成功率。在选择新生乳鼠时应尽量选择鼠龄短的乳鼠,鼠龄越短,心肌细胞活力越好。一般选择出生72 h内的乳鼠,以24 h内为佳。细胞培养中污染是一个常见问题。为防止污染在对乳鼠消毒时要严格彻底;剪开胸廓时要避免剪开腹腔;在操作过程中要遵守无菌操作原则,也可在培养液中加入双抗防止细菌污染。另外,为最大限度的保持细胞的完整性,对总的消化时间应加以控制,一般将其控制在2 h以内,时间长会导致先消化下来的心肌细胞活力下降甚至破碎。同时接种心肌细胞时应注意调整细胞密度,细胞数过少,不利于心肌细胞的快速生长和起搏。在对换液时间的把握上,应每日观察培养液的外观,换液应视其颜色变化、浑浊程度等情况而定,一般48~72 h换液即可。换液过早、过频会刺激细胞,影响细胞生长,并加大污染机会;但长期不换液使营养消耗殆尽,细胞搏动能力下降,状态差,并发生转化。
总之,本研究改良了现存的心肌细胞提取方法,成功建立了活力好的培养心肌细胞模型,能满足药理、毒理等大多数实验研究的需求。
[1] Harary L,Farley B.Invitro studies of single isolated beating heart cells[J].Science,1960,131(3414):1674-1675.
[2] 徐叔云,卞如镰,陈 修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:1056-1057.
[3] Simpson P,Savion S.Simpaon P.Differentiation of rat myocytes in single cell cultures with and without proliferating nonmyocardial cells.Cross-striations,ultrastructure,and chronotropic response to isoproterenol[J] .Circ Res,1982,50(1):101-116.
[4] Boerma M,van der Wees C G,Wondergem J,et al.Separation of neonatal rat ventricular myocytes and non-myocytes by centrifugal elutriation[J] .Pflugers Arch,2002,444(3):452-456.
[5] 沈 静,谢苗荣,徐 雍,等.乳鼠心肌细胞培养及纯化方法的改良[J].中国医药导刊,2001,3(3):225-226.
[6] Bartoli M,Claycomb W C.Transfer of macromolecules into living adult cardiomyocytes by microinjection[J].Mol Cell Biochem,1997,172(1/2):103-109.
[7] Yonemochi H,Yasunaga S,Teshima Y,et al.Mechanism of beta-adrenergic receptor upregulation induced by ACE inhibition in cultured neonatal rat cardiac myocytes:roles of bradykinin and protein kinase C[J].Circulation,1998,97(22):2268-2273.
[8] Clark W A,Decker M L,Behnke-Barclay M,et al.Cell contact as an independent factor modulating cardiac myocyte hypertrophy and survival in long-term primary culture[J].J Mol Cell Cardiol,1998,30(1):139-155.
[9] Dosenko V E,Nagibin V S,Tumanovskaya L V,et al.Postconditioning prevents apoptotic necrotic and autophagic cardiomyocyte cell death in culture[J].Fiziol Zh,2005,51(3):12-17.
[10] Miki N,Hamamori Y,Hirata K,et al.Transforming growth factor-beta 1 potentiated alpha 1-adrenergic and stretch-induced c-fos mRNA expression in rat myocardial cells[J].Circ Res,1994,75(1):8-14.
[11] Weisensee D,Seeger T,Bittner A,et al.Cocultures of fetal and adult cardiomyocytes yield rhythmically beating rod shaped heart cells from adult rats[J].In Vitro Cell Dev Biol Anim,1995,31(3):190-195.
Improvementsofmethodsofprimaryculturingmyocardialcellsofneonatalrat
LIU Wei1,ZHANG Guang-ming2,YUAN Rui1,WAN Xiao-ming1,JIN Hong1*
(1.Laboratory of Clinical Skill,Jilin Medical College,Jilin City,Jilin Province,132013;2.Department of Urinary Surgery,the Affilated Hospital of Beihua University,Jilin city,Jilin Province,132001,China)
ObjectiveTo improve the existing culture method used for the myocardial cell culture of neonatal rats and explore a more convenient and efficient method to culture myocardial cells.MethodsTwo different methods were used to digest the myocardial cells,then compared through their influence on the cell survival rate and beating capacity.ResultsThere were significant differences (P﹤0.01) in the myocardial survival rates between the different groups,because the rate with the modified method was higher than that with the traditional method.ConclusionBy using the modified method,more intact and pure myocardial cells could be obtained by timely adjusting trypsin concentration,the digestion time and the rotor speed.It is satisfied for the culture of myocardial cells model.
neonatal rat;cell culture;myocardial cells
R-332
A
2013-09-21)
1673-2995(2013)06-0435-04
吉林省教育厅项目(2011281,2012330,2012329).
刘 威(1976-),女(汉),助理实验师,硕士.
金 宏(1977-),女(汉族),副教授,硕士.

