多耐药鲍曼不动杆菌噬菌体IME-AB6的分离、生物特性及保存方法研究
彭帆,童贻刚,柏长青
1.中南大学 湘雅三医院,湖南 长沙 410013;2.军事医学科学院 a.微生物流行病研究所,病原微生物生物安全国家重点实验室;b.附属医院呼吸危重症科;北京 100071
鲍曼不动杆菌广泛存在于自然界,属于条件致病菌,多感染老年患者、危重患者、肿瘤放化疗等抵抗力低下的患者,尤其是重症监护室的患者。随着广谱抗生素、免疫抑制剂、糖皮质激素的运用,多耐药鲍曼不动杆菌已成为医院的主要病原体[1]。噬菌体是针对耐药菌治疗与消毒的一种有效手段[2]。我们通过生物学方法,对多耐药鲍曼不动杆菌噬菌体进行了分离,并对分离的噬菌体的形态、一步生长曲线、裂解特性和不同保存条件对其活性的影响进行了初步研究,为噬菌体制剂的开发提供参考。
1 材料与方法
1.1 材料
鲍曼不动杆菌AB6分离自解放军307医院患者血液,用VITEK-2全自动微生物检测仪进行菌种及药敏测定。
1.2 噬菌体分离与纯化
从解放军307医院取消毒前污水离心,除去固体杂质,收集上清,再经滤器过滤上清;取4 mL滤液加到2 mL 3×LB中,加入100 μL培养至对数期的鲍曼不动杆菌富集;过夜培养后离心收集上清,经滤器过滤后的滤液即为噬菌体原液[3];以LB固体培养基做下层平板,将上述滤液梯度稀释,分别取100与500 μL指示菌加入上层半固体LB培养基中,凝固后于37℃培养6 h,观察噬菌斑,计算滴度;挑单个噬菌斑挑入对数期菌液中过夜富集,离心过滤后与指示菌铺板,连续几次便得到纯化的噬菌体[4]。
1.3 噬菌体浓缩
将单个噬菌斑挑入5 mL对数期菌液中6 h,之后将其接种于500 mL对数期菌液中,37℃过夜培养;在含噬菌体的裂解培养物中加入0.1%体积的氯仿,室温静置30 min;向培养物中加入NaCl(终浓度为1 mol/L),搅拌使其溶解;将培养物冰浴1 h,4℃、11 000×g离心10 min去除细胞碎片;将培养物的上清加固体聚乙二醇(PEG)至终浓度为100 g/L,室温下用磁力搅拌器慢慢搅拌溶解PEG[5];将溶液转移至聚丙烯离心管中,冰水浴冷却,至少放置1 h,以便使噬菌体颗粒发生沉淀;4℃、11 000×g离心10 min回收沉淀的噬菌体,去上清,将噬菌体沉淀轻轻重悬于SM中;加入等体积的氯仿抽提噬菌体悬浮液中的PEG和细胞碎片,温和振荡30 s;11 000×g离心10 min分离有机相和亲水相,回收含噬菌体颗粒的亲水相,经0.22 μm滤器过滤,4℃保存。
1.4 透射电镜形态观察
取25 μL噬菌体液滴在铜网上,待其沉淀15 min,用滤纸吸去多余液体,用2%的磷钨酸染色30 min,干燥后用Philip TECNAI-10透射电镜进行形态观察[6]。
1.5 一步生长曲线
在1.5 mL EP管中加入感染复数(MOI)为0.1的噬菌体及其宿主菌(D600nm=0.6),混匀,37℃温育15 min,11 000 ×g离心 30 s,吸去上清,再用预热的LB培养液洗涤2次(11 000 ×g离心30 s),弃上清,用预热的LB液混悬沉淀并充分混匀,加入含5 mL预热的LB液体的试管中,迅速于37℃摇床上振荡培养,同时开始计时,分别在0、10、20、30、40、50、60、90、120 min取出 0.2 mL,13 000 r/min离心 2 min,吸取100 μL上清,用预热的LB液倍比稀释后,用双层琼脂法测定噬菌体滴度[7]。
1.6 温度敏感性测定
将噬菌体原液分别置于50、60、70和80℃的恒温水浴中[8],经梯度稀释后,采用双层琼脂法分别测定水浴1 h的噬菌体存活数目。
1.7 噬菌体裂解特性分析
将鲍曼不动杆菌于5 mL液体培养基中培养,并测定其起始D600nm值,加入200 μL噬菌体(浓度为1010PFU/mL)IME-AB6,于37℃振荡培养,同时以不加噬菌体作为对照组,分别于 0、1、2、3、4 h 检测D600nm值的变化[9]。
1.8 保存方法
将效价为1013PFU/mL的噬菌体IME-AB6在LB液体培养基中分别存放于4、-20和-70℃[10],分别于0、1、2、3、4、6个月时经梯度稀释后测定其滴度。
2 结果
2.1 细菌药敏结果
细菌药敏结果见表1,此株鲍曼不动杆菌耐多种药物,表1页给出了其最小抑菌浓度(MIC)。
2.2 噬菌斑的观察与滴度测定
以多耐药鲍曼不动杆菌AB6为宿主菌分离出一株噬菌体,命名为IME-AB6。经3~5次纯化后,用双层琼脂平板培养的噬菌斑呈圆形,大小均一,边缘光滑,透明,直径约3 mm(图1),具有强裂解性噬菌体的噬菌斑特征。统计噬菌斑数,计算得本试验中分离纯化的噬菌体效价为1×1010pfu/mL,经PEG浓缩后的滴度达1×1013pfu/mL,提高了3个数量级。
2.3 噬菌体的形态观察
纯化的噬菌体IME-AB6颗粒经负染色后于透射电镜下观察其颗粒形态(图2)。该噬菌体呈现典型的二十面体头部和尾部结构,头部宽约40 nm,长约100 nm,尾部长60 nm,其下附有数根尾丝,因此该噬菌体属于肌尾噬菌体科。

表1 多耐药鲍曼不动杆菌AB6的药敏试验结果
2.4 一步生长曲线
图3显示噬菌体感染细菌的潜伏期约10 min,爆发时间约40 min。感染宿主菌在D600nm为0.6时,细菌计数为5×107/mL,裂解量=爆发末期噬菌体滴度/感染宿主菌浓度=8×109/5×107=160,即噬菌体的爆发量为160 pfu/细胞。不同噬菌体的潜伏期、爆发期及爆发量的差异很大。对于那些在临床上有应用前景的噬菌体而言,潜伏期短、爆发量大是特别被看好的。
2.5 温度敏感性测定
IME-AB6对热较敏感,50℃保存1 h其存活率约为80%,60℃时存活率明显下降,70℃时完全失活(图4)。40~50℃下噬菌体能保持较高滴度,表示其在相对高温下有一定的稳定性。

图1 以多耐药鲍曼不动杆菌为指示菌分离出的噬菌体IME-AB6

图2 噬菌体IME-AB6电镜图

图3 噬菌体IME-AB6在宿主菌中的一步生长曲线
2.6 噬菌体裂解特性分析
如图5所示,在不同起始D600nm值的菌液中加入噬菌体2 h后,其D600nm值下降明显,肉眼可观察到较对照组明显澄清,作用 4 h后培养液透亮且澄清,而阴性对照组D600nm值仍在上升且培养液较为混浊。由此可见,噬菌体IME-AB6能有效裂解宿主菌,裂解效能强,裂解时间快。
2.7 保存方法
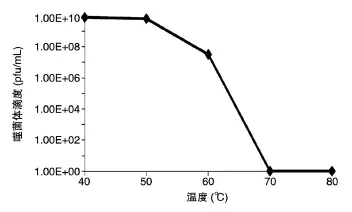
图4 噬菌体IME-AB6在不同温度下1 h后的滴度变化

图5 不同浓度菌液中加入噬菌体后的D600nm值变化
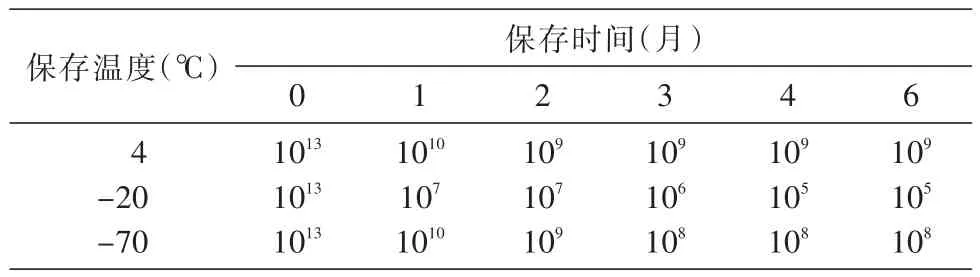
表2 不同保存温度对噬菌体效价的影响(PFU/mL)
从表2可见,4℃是最好的保存温度,4℃保存与-70℃保存的噬菌体之间无明显差别,6个月之内噬菌体的效价降低不明显。-20℃保存时,噬菌体的裂菌活性在半年内降低了多个指数级。综合来看,在LB培养基中于4℃保存噬菌体不需要特殊仪器,条件简单,操作方便,是最值得采用的保存方法。
3 讨论
治疗耐药性细菌已成为临床医生的难题,新的抗菌药物亟待开发[11]。但一种新抗生素的生产需要大量物力、人力和长时间的投入,而噬菌体治疗能克服这些缺点。我们选取的鲍曼不动杆菌AB6对耐大多数药物,以它为指示菌分离的噬菌体IME-AB6的裂解性强。虽然已有很多关于利用噬菌体治疗人类疾病的报道[12-13],但宿主谱狭窄一直是治疗中存在的问题。有很多鸡尾酒疗法的报道[14-15],即将不同的噬菌体混合以提高宿主谱。另一种发展趋势是个体化治疗,即针对抗生素无效或治疗不明显的某个病人的某种耐药菌分离噬菌体用于治疗,这样宿主谱狭窄就不再是影响治疗的问题。
基于噬菌体在抗菌方面的独特优势,我们开展了针对多耐药性鲍曼不动杆菌噬菌体生物学特征的初步研究,从污水中分离出一株IME-AB6噬菌体,属于肌尾噬菌体。一步生长曲线是研究噬菌体裂解细菌效能的重要指标,包括潜伏期、爆发期、平台期,也可以据其算出爆发量。随着宿主菌的不断裂解和新的子代噬菌体的释放,当宿主菌接近全部被裂解时,噬菌体的数量达到最大值。本株噬菌体潜伏期为10 min,显示的爆发时间是40 min。潜伏期和爆发期的时间短,可反映噬菌体裂解的高效能。噬菌体具有天然杀菌特性,而本实验所分离的IME-AB6噬菌体能使菌液D600nm值迅速下降,在4 h内能使菌液变清晰,也证实了其杀菌的高效能,为今后开发噬菌体制剂提供了基础。在50℃以下能很好地保持噬菌体的高滴度,在LB培养基中于4℃保存也很方便,说明该噬菌体稳定并易于保存,这是其作为制剂的一大优势。
[1]Perez F,Hujer A M,Hujer K M,et al.Global challenge of multidrug-resistant Acinetobacter baumannii[J]. Antimicrob Agents Chemother,2007,51(10):3471-3484.
[2]Alisky J,Iczkowski K,Rapoport A,Troitsky N.Bacteriophag⁃es show promise as antimicrobial agents[J].J Infect,1998,36(1):5-15.
[3]范华昊,范俊芬,滑玉会,等.快速从医院废水中大规模分离铜绿假单胞杆菌噬菌体[J].生物技术通讯,2012,23(4):567-571.
[4]Lu Z,Breidt Jr F,Fleming H,et al.Isolation and character⁃ization ofa Lactobacillus plantarum bacteriophage,ΦJL-1,from a cucumber fermentation[J].Int J Food Microbiol,2003,84(2):225-235.
[5]梁莉,杨洪江,金鑫.鲍曼不动杆菌烈性噬菌体的分离与纯化[J].生物学杂志,2010,(4):88-90.
[6]Yang H,Liang L,Lin S,Jia S.Isolation and characterization of a virulent bacteriophage AB1 of Acinetobacter baumannii[J].BMC Microbiol,2010,10(1):131.
[7]Popova A V,Zhilenkov E L,Myakinina V P,et al.Isolation and characterization ofwide hostrange lytic bacteriophage AP22 infecting Acinetobacterbaumannii[J].FEMS Microbiol Lett,2012,332:40-46.
[8]王雪松,李晓,杨光远,等.1株大肠杆菌O157鸭源噬菌体的分离,纯化及其特性鉴定[J].畜牧与兽医,2011,43(7):36-38.
[9]张辉,王冉,包红朵.李斯特菌噬菌体的分离鉴定及其裂解特性[J].食品科学,2012,33(7):228-232.
[10]李陇平,张智英.金黄色葡萄球菌烈性噬菌体的分离鉴定和最佳保存方法研究[J].中国畜牧兽医,2011,38(6):141-146.
[11]Pirisi A.Phage therapy—advantages over antibiotics[J]?Lan⁃cet,2000,356(9239):1418.
[12]Abedon S T,Kuhl S J,Blasdel B G,et al.Phage treatment of human infections[J].Bacteriophage,2011,1(2):66-85.
[13]Weber-DabrowskaB,Mulczyk M,GórskiA.Bacteriophage therapy for infections in cancer patients[J].Clin Appl Immu⁃nol Rev,2001,1(3):131-134.
[14]Niu Y,Johnson R,Xu Y,et al.Host range and lytic capabili⁃ty of four bacteriophages against bovine and clinical human isolates of Shiga toxin-producing Escherichia coli O157:H7[J].J Appl Microbiol,2009,107(2):646-656.
[15]Merabishvili M,Pirnay J P,Verbeken G,et al.Quality-con⁃trolled small-scale production of a well-defined bacteriophage cocktail for use in human clinical trials[J].PLoS One,2009,4(3):e4944.

