牛耳枫生物碱2-hydroxyyunnandaphnine D体外抗肿瘤活性及作用机制
王蓓,戎瑞雪,郑聪毅,曹志然,罗都强
(1.河北大学 基础医学院,河北 保定 071000;2.河北大学 生命科学学院,河北 保定 071002)
牛耳枫生物碱2-hydroxyyunnandaphnine D体外抗肿瘤活性及作用机制
王蓓1,戎瑞雪1,郑聪毅1,曹志然1,罗都强2
(1.河北大学 基础医学院,河北 保定 071000;2.河北大学 生命科学学院,河北 保定 071002)
为了研究牛耳枫生物碱2-hydroxyyunnandaphnine D体外抗肿瘤活性及作用机制,用MTT法检测 6.25~100 mg/L 2-hydroxyyunnandaphnine D分别作用于人肝癌细胞(HepG-2)、人乳腺癌细胞(MCF-7)及人宫颈癌细胞(HeLa)后不同时间点的细胞存活并计算细胞增殖抑制率和IC50;FDA/PI双染色荧光显微镜观察细胞死亡情况;分光光度法检测Caspase-3酶活性变化;MTT法检测凋亡抑制剂Z-VAD-FMK对2-hydroxyyunnandaphnine D抑瘤活性的影响.结果显示:2-hydroxyyunnandaphnine D对3种瘤株均有明显的抑制作用,且具有明显的时效量效关系,其48 h的IC50值分别为(1.30±0.09),(7.32±0.10)和(8.41±0.11)mg/L.FDA/PI双染色荧光显微镜观察显示2-hydroxyyunnandaphnine D组中死亡细胞数较正常对照组细胞死亡数量增加,且随着剂量的加大细胞死亡数量增加.MTT法显示凋亡抑制剂Z-VAD-FMK不能阻断2个浓度的2-hydroxyyunnandaphnine D对HepG-2细胞的增殖抑制作用.Caspase-3酶活性测定显示l0,30 mg/L 2-hydroxyyunnandaphnine D作用后肿瘤细胞的Caspase-3酶活力单位与正常对照组比较无统计学意义.结果表明:牛耳枫生物碱2-hydroxyyunnandaphnine D 在体外具有明显的抑制肿瘤细胞增殖的作用, 其作用机制并非通过激活Caspase-3途径.
牛耳枫;2-hydroxyyunnandaphnine D; MTT; Z-VAD-FMK;Caspase-3
牛耳枫(DaphniphyllumcalycinumBenth)为虎皮楠科(Daphniphyllaceae)虎皮楠属(Daphniphyllum)植物, 原产于我国华南地区,以根、叶入药,清热解毒,活血舒筋.该科植物的主要特征是含有次生代谢物质生物碱类,其多变的骨架和复杂的多环结构吸引了许多学者对其深入的研究[1-2].生物碱大多数存在于植物当中,又称植物碱.大量研究表明,天然植物中的生物碱具有明显的抗肿瘤功效,如长春碱是从夹竹桃科植物长春花中提取出的生物碱,具有抑制微管蛋白组装的活性,并且毒性低,目前已成为一类作用于M期的特异性肿瘤化疗药物[3];瑞香狼毒总生物碱对肝癌BEL-7402细胞和胃癌SGC-7901细胞表现出较强的杀伤作用[4].前期研究发现虎皮楠生物碱对某些肿瘤细胞有抑制作用[5].本课题组采用色谱方法从牛耳枫茎叶中提取分离到了10种生物碱[6],其中2-hydroxyyunnandaphnine D是从该植物中首次分离到的一种新的生物碱[7],有关其抗肿瘤活性的研究还未见报道.本文采用MTT法观察了2-hydroxyyunnandaphnine D 在体外对人肝癌细胞株(HepG-2)、人宫颈癌细胞(Hela)、人乳腺癌细胞株(MCF-7) 的抑制增殖作用,并选择最敏感的HepG-2作为研究对象,通过FDA/PI双染色荧光显微镜观察法、凋亡抑制剂阻断实验、Caspase-3酶活性检测等手段初步探讨了2-hydroxyyunnandaphnine D抗肿瘤作用机制,从而为该化合物的合理开发及利用提供了实验依据.
1 材料与方法
1.1细胞系、主要试剂及仪器
HepG-2, MCF-7,Hela细胞系(中国科学院药物研究所);二甲基亚砜DMSO(Sigma公司);RPMI1640培养基(GIBCO公司);2-hydroxyyunnandaphnine D(河北大学生命科学学院);凋亡抑制剂Z-VAD-FMK 、PKC抑制剂Staurosporine、 Caspase-3活性检测试剂盒、 Bradford蛋白浓度测定试剂盒(碧云天生物技术研究所).
荧光显微镜(OlymPus公司);CO2培养箱HF90(上海力申科学仪器有限公司);洁净工作台SW-CJ-2FD(苏州安泰空气技术有限公司); ELX-800全自动酶标仪(ELISA Reader 美国宝特有限公司).
1.2细胞培养
常规复苏细胞,用RPMI1640完全培养液(含体积分数为10%的胎牛血清、100万U/mL青霉素、100 μg/mL链霉素)培养肿瘤细胞,置于含体积分数5%的CO2培养箱中37 ℃培养,胰酶消化传代,取对数生长期的细胞调整所需密度,进行实验.
1.3样品的配制
用DMSO溶解2-hydroxyyunnandaphnine D,使其质量浓度为10 mg/mL,然后用无血清的培养液进行稀释,使其成为1 mg/mL 的储备液,过滤除菌,分装后在-80 ℃储存,使用时再稀释成所需质量浓度.
1.4MTT法检测2-hydroxyyunnandaphnineD对肿瘤细胞增殖的影响
分别取对数生长期的HepG-2细胞、Hela细胞和MCF-7细胞,调整细胞密度为2×107L-1, 接种于96孔板中,90 μL/孔,培养24 h贴壁后,每孔加入不同质量浓度的2-hydroxyyunnandaphnine D 10 μL,使其终质量浓度分别为100,50,25,12.5和6.25 mg/L,阳性对照组每孔加10 μL的顺铂(DDP),终质量浓度分别为100,50,25,12.5和6.25 mg/L,阴性对照组每孔加10 μL含相应浓度DMSO(体积分数分别为1%,0.5%,0.25%,0.125%和0.062 5%)的培养液;每组设3个复孔,空白对照孔只加培养液不加细胞.于37 ℃、含体积分数5% CO2培养箱分别继续培养20,44,68 h后取出,每孔加MTT(10 g/L)10 μL,4 h后弃去上清液,加入100 μL DMSO振荡器振荡5 min,在490 nm波长下检测其吸光度值(A),并计算肿瘤细胞增殖抑制率(IR),IR=(1-药物A/阴性对照A)×100%.并根据改良寇氏法计算半数抑制浓度[8]lgIC50=Xm-I×(P-(3-Pm-Pn)/4)[Xm:1g最大剂量;I:1g(最大剂量/相临剂量);P:阳性反应率之和;Pm:最大抑制率;Pn:最小抑制率].
1.5FDA/PI双染色荧光显微镜观察
取对数期的HepG-2细胞,使细胞密度为1×107L-1,置于37 ℃恒温恒湿、含体积分数为5% CO2的培养箱培养24 h;按照分组分别加入含2-hydroxyyunnandaphnine D的RPMI 1640培养液(终质量浓度分别为10和30 mg/L),对照组只加入RPMI 1640培养液,继续培养24 h后收集细胞、并用PBS缓冲液洗涤,各组分别加入2 μL FDA染液(200 mg/L)及70 μL PI染液(100 mg/L),室温闭光10 min,于荧光显微镜观察并拍照.
1.6凋亡抑制剂Z-VAD-FMK对2-hydroxyyunnandaphnineD抑瘤活性的影响
将HepG-2细胞按每孔8×103个接种于96孔板,37 ℃、含体积分数5% CO2培养箱培养24 h,细胞贴壁后进行以下实验.实验设正常对照组、Staurosporine(STS)50 mol/L组、STS 50 mol/L+Z-VAD-FMK 20 μmol/L组、2-hydroxyyunnandaphnine D 10 mg/L组、2-hydroxyyunnandaphnine D 10 mg/L + Z-VAD-FMK 20 μmol/L组、2-hydroxyyunnandaphnine D 30 mg/L组及2-hydroxyyunnandaphnine D 30 mg/L + Z-VAD-FMK 20 μmol/L组,每组设3个复孔,分别作用12 h后,采用MTT法测定细胞存活,同时计算各组细胞的增殖抑制率,实验重复3次.
1.72-hydroxyyunnandaphnineD对HepG-2细胞Caspase-3酶活性的影响
取对数生长期的HepG-2细胞,接种于4个100 mL培养瓶(每瓶1×106个细胞 ),37 ℃恒温恒湿、含体积分数为5% 的CO2条件孵育24 h;实验设10和30 mg/L 2-hydroxyyunnandaphnine D组、正常对照组及STS组;收集细胞后分别按试剂盒进行蛋白的提取并按试剂盒进行Caspase-3酶活性的检测.
1.8统计学分析
采用单因素方差分析和t检验,所有数据的统计均在计算机SPSS16.0软件包内进行.检验水准α=0.05,P<0.05表示有显著性差异.
2 结果
2.12-hydroxyyunnandaphnineD对几种肿瘤细胞增殖的影响
MTT实验结果显示,2-hydroxyyunnandaphnine D对人肝癌细胞株(HepG-2)、人宫颈癌细胞(Hela)、人乳腺癌细胞株(MCF-7)3种瘤株均有明显的抑制作用,其48 h的IC50值分别为(1.30±0.09),(7.32±0.10)和(8.41±0.11)mg/L,且其抑制作用具有较好的时效和量效关系,顺铂对照组48 h的IC50值分别为(3.23±0.12),(1.28±0.11),(0.38±0.08)mg/L(图1~3).
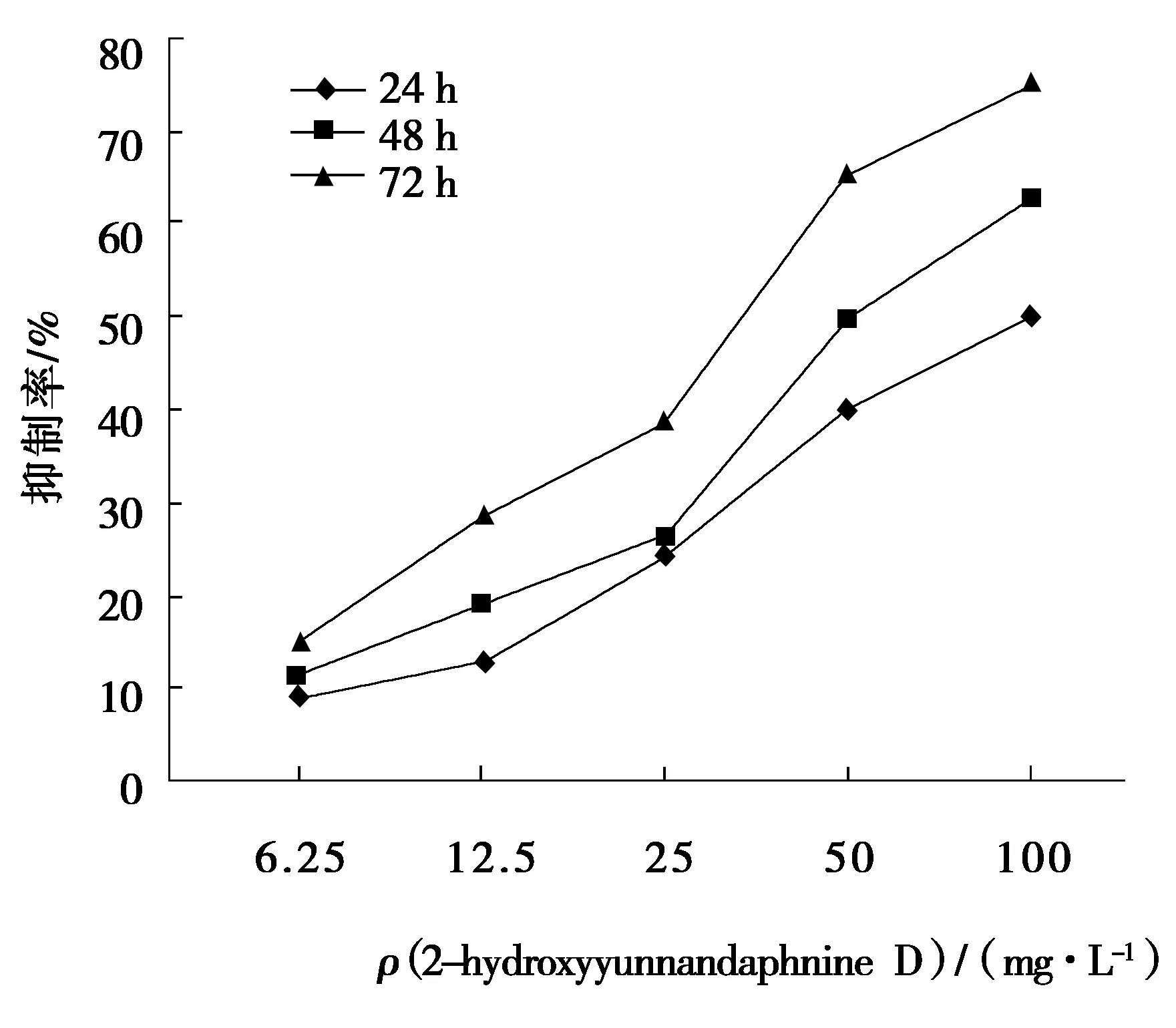
图1 2-hydroxyyunnandaphnine D对HepG-2细胞增殖的影响

图2 2-hydroxyyunnandaphnine D对Hela细胞增殖的影响

图3 2-hydroxyyunnandaphnine D对MCF-7细胞增殖的影响
2.2荧光显微镜观察2-hydroxyyunnandaphnineD作用后细胞死亡情况
结果表明:正常对照组中细胞绝大部分发绿色荧光,细胞为活细胞,个别细胞发红色荧光,可能为自然死亡细胞;10 mg/L组中发红色荧光的细胞稍增加,细胞死亡数量增加;30 mg/L组红色荧光数量较小剂量组增多,表明细胞死亡增多(图4).

a.正常对照组;b.2-hydroxyyunnandaphnine D组(10 mg/L);c.2-hydroxyyunnandaphnine D组(30 mg/L).
2.3Z-VAD-MFK对2-hydroxyyunnandaphnineD抑瘤活性的影响
表1结果显示,经STS作用12 h后,与正常对照组比较A值显著降低(P<0.05),细胞增殖抑制率为(60.13±0.01)%,表明STS成功诱导细胞凋亡; STS+Z-VAD-MFK组与STS组比较,A值增大明显(P<0.05),其抑制率为(4.05±0.01)%,而与正常对照组比较,A值则无明显变化,表明Z-VAD-FMK成功抑制了STS诱导的细胞凋亡;10,30 mg/L 2-hydroxyyunnandaphnine D组的增殖抑制率分别为(16.20±0.09)%和(40.02±0.01)%,而10,30 mg/L 2-hydroxyyunnandaphnine D+Z-VAD-FMK组的细胞增殖抑制率分别为(18.07±0.00)%和(41.12±0.01)%, 2-hydroxyyunnandaphnine D组与2-hydroxyyunnandaphnine D+Z-VAD-FMK组之间均无显著差异(P>0.05).这表明2-hydroxyyunnandaphnine D杀伤肿瘤细胞的作用没有被Z-VAD-FMK抑制,即其杀伤肿瘤细胞的机制与胱天蛋白酶Caspase-3激活通路无关.

表1 凋亡抑制剂Z-VAD-FMK对2-hydroxyyunnandaphnine D抑瘤活性的影响
2.4Caspase-3酶活性的测定
由表2可知,10,30 mg/L 2-hydroxyyunnandaphnine D组Caspase-3酶活力单位分别与正常对照组比较均无统计学意义(P>0.05),表明2-hydroxyyunnandaphnine D未激活Caspase-3酶,即未通过激活Caspase-3途径引起肿瘤细胞凋亡;而凋亡阳性对照组(STS组)中催化的酶活力单位量与正常对照组比较具有统计学差异(P<0.05),表明STS组成功激活Caspase-3酶发生细胞凋亡(表2).

表2 2-hydroxyyunnandaphnine D对HepG-2细胞Caspase-3酶活性的影响
3 讨论
自第1个植物来源生物碱类的抗肿瘤药物长春新碱应用于临床以来, 生物碱类抗肿瘤药物发展得十分迅速.其中天然生物碱成分是很有前途的一类活性物质,并已成功开发了几种药物,如紫杉醇、喜树碱等,成为具有划时代意义的抗肿瘤药.2-hydroxyyunnandaphnine D是本课题组采用现代的分离鉴定技术从牛耳枫中获得的新生物碱,本研究结果表明,2-hydroxyyunnandaphnine D在体外对HepG-2细胞、MCF-7细胞和Hela细胞3种肿瘤细胞株均具有抑制细胞增殖的作用,尤其是对其中的HepG-2细胞抑制作用最强,且抑制作用具有较好的时效和量效关系.
国内外研究表明生物碱可以通过多种机制作用于肿瘤细胞,例如可以诱导肿瘤细胞的凋亡;诱导肿瘤细胞的分化;抑制肿瘤细胞增殖;抑制拓扑异构酶Ⅰ活性;还可作用于肿瘤细胞的微管,抑制其聚合或解聚等[9].本实验以最敏感的HepG-2 细胞作为研究对象,通过FDA/PI双染色荧光显微镜观察,结果表明2-hydroxyyunnandaphnine D可引起肿瘤细胞的死亡.目前研究表明细胞死亡的方式有多种,一般可分为程序性细胞死亡和非程序性细胞死亡,程序性细胞死亡一般是指细胞凋亡,非程序性细胞死亡是指细胞坏死[10],如果按其发生机制的不同还可分为Caspase依赖型和Caspase非依赖型,典型的细胞凋亡是Caspase依赖型的,然而有些细胞死亡的形态用坏死或凋亡并不能解释.最近有文献报道还存在着一种非凋亡性程序性细胞死亡.它是一种新的细胞死亡方式, 命名为亚凋亡(Paraptosis),而亚凋亡属于Caspase非依赖型的程序性细胞死亡[11-14].星形孢菌素STS是一种广谱的细胞凋亡诱导剂,可以通过抑制蛋白激酶C,诱导细胞凋亡[15].为了研究2-hydroxyyunnandaphnine D诱导肿瘤细胞死亡的机制,本文以凋亡诱导剂STS作为阳性对照,观察了凋亡阻断剂Z-VAD-FMK对2-hydroxyyunnandaphnine D抑瘤活性的影响,结果表明Z-VAD-FMK可成功阻断STS诱导的肿瘤细胞凋亡但不能阻断2-hydroxyyunnandaphnine D诱导的细胞死亡;Caspase-3酶活性检测也表明2-hydroxyyunnandaphnine D作用后肿瘤细胞内的Caspase-3酶活性没有明显变化;光学显微镜下观察死亡细胞的形态既不同于坏死又不同于典型的凋亡,上述的实验结果提示2-hydroxyyunnandaphnine D可能通过类似于Paraptosis的方式作用于HepG-2细胞来发挥抗肿瘤作用[16-18],其确切作用机制尚待进一步研究.
[1]FAN Chengqi, YIN Sheng, XUE Junjuan, et al. Novel alkaloids, paxdaphnines Aand B with unprecedented skeletons from the seeds ofDaphniphyllumpaxianum[J]. Tetrahedron, 2007, 63(1): 115-119.
[2]SAITO S, KUBOTA T, KOBAYASHI J. Calyciphylline G, a novel alkaloid with an unprecedented fused-hexacyclic skeleton fromDaphniphyllumcalycinum[J]. Tetrahedron Letters, 2007, 48(32): 5693-5695.
[3]吴虹, 韦敏. 植物来源的生物碱抗肿瘤活性及其作用机制研究进展[J]. 医学信息, 2011, 24(9): 6294-6296.
[4]王敏, 王学习, 贾正平, 等. 瑞香狼毒总生物碱的抗肿瘤活性和机理研究[J]. 中药材, 2010, 33(12): 1919-1922.
[5]曹志然, 王海, 唐志远, 等. 4种源于虎皮楠的生物碱对人肝癌细胞株HepG-2增殖的影响[J]. 医学研究与教育, 2010, 27(6): 6-10.
CAO Zhiran, WANG Hai, TANG Zhiyuan, et al. Effect of four alkaloids fromDaphniphyllumoldhamion proliferation of human cell HepG-2[J]. Medical Research and Education, 2010, 27(6): 6-10.
[6]朱文粮, 罗都强, 刘召阳. 牛耳枫中生物碱的研究[J]. 天然产物研究与开发, 2010, 2(6): 1024-1027.
ZHU Wenliang, LUO Duqiang , LIU Zhaoyang. Alkaloids fromDaphniphyllumcalycinumBenth[J]. Natural Product Research and Development, 2010, 2(6):1024-1027.
[7]LUO Duqiang, ZHU Wenliang, YANG Xiaolong, et al. Two new daphniphyllum alkaloids fromDaphniphyllumcalycinum[J]. HELVETICA CHIMICA ACTA, 2010, 93 (6): 1209-1215.
[8]赵斌, 葛金芳, 朱娟娟, 等. 小议在MTT法测细胞增殖抑制率中IC50的计算方法[J]. 安徽医药, 2007, 11(9): 834-836.
[9]LU Cuixian, FAN Tingjun, HU Guobin, et al. Apoptosis-inducing factor and apoptosis[J]. Acta Biochimica et Biophysica Sinica, 2003, 35(10):881-885.
[10]李中海, 端木德强, 王敬泽. 凋亡抑制蛋白XIAP研究进展[J]. 河北大学学报:自然科学版, 2003, 23(1): 100-105.
LI Zhonghai, DUANMU Deqiang, WANG Jingze. Research progress of the inhibitor-of-protein XIAP[J]. Journal of Hebei University: Natural Science Edition, 2003, 23(1): 100-105.
[11]王淳, 陈誉华, 陈澄. Paraptosis一种新的细胞死亡方式[J]. 解剖科学进展, 2002, 8(3): 257-260.
[12]洪振亚. Caspase非依赖性细胞程序性死亡[J]. 国际输血及血液学志, 2006, 29(2): 137-139.
[13]陈同生,王小平,孙磊,等. 紫杉醇诱导不依赖于Caspase-3细胞类似Paraptosis的荧光光谱分析[J]. 光谱学与光谱分析, 2008, 28(11): 2623-2627.
CHEN Tongsheng, WANG Xiaoping, SUN Lei, et al. Fluorescence analysis of taxol-induced paraptosis-like Independent of Caspase-3 activation[J]. Spectroscopy and Spectral Analysis, 2008, 28(11): 2623-2627.
[14]陈同生, 王小平, 孙磊, 等. 紫杉醇诱导ASTCa1细胞的程序性死亡机制研究[J]. 光电子·激光, 2008, 19(12): 1706-1709.
CHEN Tongsheng, WANG Xiaoping, SUN Lei, et al. Real-time fluorescence analysis of taxol-induced human lung adenocarcinoma ( ASTCa1) PCD[J]. Journal of Optoelectronics·Laser, 2008, 19(12): 1706-1709.
[15]LI Yumei, LI Qian, WANG Zhigang, et al. 15-HETE suppresses K(+) channel activity and inhibits apoptosis in pulmonary artery smooth muscle cells[J]. Apoptosis, 2009, 14(1): 42-51.
[16]YOON MJ, KIM EH, LIM JH, et al. Superoxide anion and proteasomal dysfunction contribute to curcumin-induced paraptosis of malignant breast cancer cells[J]. Free Radical Biology & Medicine, 2010, 48(5): 713-726.
[17]ASARE N, LANDVIK NE, LAGADIC-GOSSMANN D, et al. 1-Nitropyrene (1-NP) induces apoptosis and apparently a non-apoptotic programmed cell death (paraptosis) in Hepa1c1c7 cells[J]. Toxicology and Applied Pharmacology, 2008, 230(2): 175-186.
[18]解树涛. 康宁霉素(Trichokonins)抗菌、抗肿瘤活性及作用机制[D]. 济南:山东大学, 2007.
XIE Shutao. Antimicribial and antitumor activity of trichokonins from trichoderma koningii SMF2[D]. Ji’nan:Shandong University, 2007.
Anti-tumoractivityandthemechanismof2-hydroxyyunnandaphnineDfromDaphniphyllumcalycinuminvitro
WANGBei1,RONGRuixue1,ZHENGCongyi1,CAOZhiran1,LUODuqiang2
(1.College of Basic Medical Science, Hebei University, Baoding 071000, China;
2.College of Life Sciences, Hebei University, Baoding 071002, China)
To study the anti-tumor activity and the mechanism of 2-hydroxyyunnandaphnine D fromDaphniphyllumcalycinum. The proliferation inhibition rate and IC50of HepG-2, MCF-7 and HeLa cells were measured by MTT assay in vitro treated by 2-hydroxyyunnandaphnine D(6.25--100 mg/L)after 24 , 48 and 72 h. The cell death was observed by fluorescence microscopy . The inhibition pathway of 2-hydroxyunnandaphnine D was analyzed by apoptosis inhibitor Z-VAD-FMK by MTT. The activity of Caspase-3 in tumor cells was detected by spectrophotography. The MTT assay results revealed that 2-hydroxyyunnandaphnine D could inhibit the proliferation of the three kinds of tumor cells obviously and the inhibitory rates significantly increased in a dose-dependent and time-dependent manner. The IC50were(1.30±0.09),(7.32±0.10)and(8.41±0.11)mg/L after 48 h treated with 2-hydroxyyunnandaphnine D respectively. There were more death cells in 2-hydroxyyunnandaphnine D groups than that of normal group. The killing effect on HepG-2 cells of 2-hydroxyyunnandaphnine D was not impacted by Z-VAD-FMK. The Caspase-3 enzyme activity of HepG-2 cells was no obvious change compared with the control group, which indicated that Caspase-3 had not been activated in the course of cell death induced by 2-hydroxyyunnandaphnine D. The results suggested that 2-hydroxyyunnandaphnine D could inhibit the proliferation of tumor cells and the mechanism were not by activating Caspase-3.
Daphniphyllumcalycinum; 2-hydroxyyunnandaphnine D; MTT; Z-VAD-FMK;Caspase-3
10.3969/j.issn.1000-1565.2013.04.012
2012-09-21
国家自然科学基金资助项目(30671385)
王蓓(1978-),女,河北献县人,河北大学讲师,硕士,主要从事肿瘤免疫及抗感染免疫研究.
E-mail:wp780203@163.com
曹志然(1963-),女,河北景县人,河北大学教授,主要从事中药药理抗肿瘤研究.E-mail:caozhiran@163.com
罗都强(1968-),男,陕西扶风人,河北大学教授,博士,主要从事天然药物性成分分析.
E-mail:Duqiangluo@163.com
R96
A
1000-1565(2013)04-0401-07
(责任编辑赵藏赏)

